克林霉素磷酸酯聚氨酯水凝胶栓剂的制备及体外释放
2012-01-12赵万利包全英赵泽恺
赵万利, 包全英, 赵泽恺, 张 灿
(中国药科大学新药研究中心,江苏南京210009)
水凝胶为可吸水溶胀的三维网状结构,具有很高的含水量、柔软度和生物相容性,在创伤敷料、组织工程、药物传递等生物医学领域具有广泛的应用;此外,因其具有高度微孔化结构,在用作药物载体时,还可通过调节交联率来控制药物的释放速率[1],故已被广泛应用于缓释药物传递系统及局部给药系统如经皮给药、直肠及阴道给药等[2]。
传统的水凝胶易碎、机械性能差,不能承受高压力及高应力[3]。聚氨酯水凝胶作为一种聚氨酯材料,兼有聚氨酯与水凝胶两者的优点,具有良好的机械性能[4]。目前,一种基于聚氨酯水凝胶的制剂地诺前列酮栓(商品名:欣普贝生)已上市,并以其良好的缓释性能及临床效果而在同类产品中脱颖而出,主导欧美市场。
克林霉素磷酸酯(clindamycin phosphate,CLP)为半合成的克林霉素衍生物,是一种高效的广谱抗生素,对厌氧菌及革兰阳性需氧菌具有较强的抗菌活性,临床上可用于治疗各类感染。其中,治疗细菌性阴道炎时,CLP的传统给药剂型主要为阴道乳膏、阴道胚珠及口服制剂,但这些剂型均有一定的局限性,如:口服制剂存在胃肠道刺激、肝肾功能损伤等副作用;乳膏及胚珠可能会溢出给药部位,导致给药量不足且顺应性差[5]。为克服CLP传统阴道剂型的局限,本文以聚乙二醇(PEG)、二环己基甲烷二异氰酸酯(DMDI)和1,2,6-己三醇(HT)为原料,采用一步法合成了聚氨酯水凝胶材料,通过傅里叶变换红外光谱(FTIR)分析及溶胀率对其进行了表征,制备了CLP阴道栓剂并探讨了其体外释放行为。
1 材料
1.1 药品及试剂
CLP(纯度99%,郑州兴人化工产品有限公司);PEG6000(相对分子质量为5 400~7 800,西陇化工股份有限公司);DMDI(日本TCI公司);HT (Acros Organics公司);无水氯化铁(Alfa Aesar公司);乙腈(色谱纯,国药试剂);其他试剂均为市售分析纯。
1.2 仪器
电子天平(德国赛多利斯公司);LC-2010A HT型色谱仪(日本岛津公司);ZRS-8G型智能溶出试验仪(天津大学无线电厂);Nicolet2000型红外光谱仪(美国Nicolet公司);KH5200DB型超声波清洗器(江苏昆山禾创超声仪器有限公司)。
2 方法
2.1 聚氨酯水凝胶的合成与表征
2.1.1 聚氨酯水凝胶的合成 称取PEG6000(9 g,按-OH计,0.003 mol)置于三颈瓶,加入FeCl3(质量约为PEG6000的0.1%),120℃加热,搅拌熔融,抽真空除湿4 h以上;降温至80℃,加入HT (0.201 2 g,按-OH计,0.004 5 mol),真空除湿约30 min;快速加入DMDI(0.984 0 g,按-NCO计,0.007 5 mol),搅拌约5 min,倒入85℃预热的模具中,固化10 h,冷却至室温,得表面光滑、略带黄色的薄板,避光防潮保存备用。
2.1.2 傅里叶变换红外光谱分析 取聚氨酯薄板磨成细粉后与KBr混匀压成薄片,通过红外光谱仪进行测定。
2.1.3 溶胀率测定 将聚氨酯薄板待测样品剪成质量约为0.2 g的小片,置37℃的去离子水50 mL中。分别于5、10、20、30、60、90、120、180、240及360 min时,将样品取出,用吸水纸擦干表面的水分,立即称重。将样品取出称重过程中消耗的时间从溶胀时间中扣除,按公式1[6]计算溶胀率(S):

其中,wt表示t时刻样品的质量(g),w0表示样品的初始质量(g)。
2.2 克林霉素磷酸酯阴道栓剂的制备
2.2.1 栓剂的几何形状 将合成的聚氨酯薄板用裁刀切成几何尺寸为29mm×9.5mm,厚度分别为0.8、1.3及1.6 mm的边缘圆滑的空白栓剂(见图1)。

图1 栓剂的几何形状Figure 1 Geometric shape of the pessary
2.2.2 克林霉素磷酸酯栓剂的制备 将空白栓剂置适量水-乙醇(50∶50)混合溶剂中,充分溶胀纯化12 h后于25℃下真空干燥24 h以上。
载药方法:将一定量(目标载药量)的CLP溶于适量水-乙醇(50∶50)中,并将纯化后的空白栓剂置于该溶液中,25℃下充分溶胀12 h,然后将载药完毕的栓剂于25℃下真空干燥48 h以上。
2.2.3 栓剂药物载药量测定 取栓剂一枚,剪成小块,置于250 mL量瓶中,加水适量,超声60 min,放冷至室温后,加水定容,摇匀,过0.45μm滤膜,取续滤液供液相分析。平行测定10枚。计算实际载药量与目标载药量之比。
HPLC条件:色谱柱为Diamonsil C18柱(250 mm×4.6mm,5μm),流动相为乙腈-磷酸盐缓冲液(磷酸二氢钾13.6 g溶于水1 000 mL中,磷酸调pH 2.5) (28∶72),柱温为30℃,流速为1 mL·min-1,检测波长为210 nm,进样量为20μL。
2.3 克林霉素磷酸酯栓剂的体外释放度的测定
2.3.1 分析方法 HPLC方法同“2.2.3”项。以pH 4.5磷酸盐缓冲液(磷酸二氢钾6.8 g溶于水1 000 mL中,以磷酸调节pH至4.5)为溶剂,配制CLP溶液,考察液相色谱方法的线性范围、精密度及回收率。
2.3.2 释放条件 采用中国药典(2010版)附录ⅩC溶出度测定法中浆法进行测定,释放介质为pH 4.5的磷酸盐缓冲液500 mL,温度为(37±0.5)℃,转速为50 r·min-1。在5、10、20 min及0.5、1、1.5、2、2.5、3、4、6、8 h时,取样1 mL,过0.45μm滤膜,取续滤液供液相分析,并同时补充释放介质1 mL。
2.4 影响栓剂体外释放的因素考察
2.4.1 聚氨酯的化学组成对药物释放的影响 分别取PU/1.5HT(PEG6000中与HT中羟基的物质的量比为1∶1.5,下面依此类推)、PU/2.0HT、PU/2.5HT及PU/3.0HT材料,切成厚度为1.6 mm的空白栓剂,制备成含CLP 50 mg的栓剂,并按“2.3.2”项下方法考察释放行为,每个规格平行测定3份。
2.4.2 栓剂厚度对药物释放的影响 取PU/2.0HT材料,切成厚度分别为0.8、1.3及1.6 mm的空白栓剂,制备成含CLP 50 mg的栓剂,按“2.3.2”项下方法考察释放行为,每个规格平行测定3份。
2.4.3 栓剂载药量对药物释放的影响 取PU/ 2.0HT材料,切成厚度为1.6 mm的空白栓剂,制备成分别含CLP 25、50、75及100 mg的栓剂,按“2.3.2”项下方法考察释放行为,每个规格平行测定3份。
2.4.4 pH对药物释放的影响 取PU/2.0HT材料,切成厚度为1.6 mm的空白栓剂,制备成含CLP 50 mg的栓剂,分别以pH 4.5、6.0及7.4的磷酸盐缓冲液(磷酸二氢钾6.8 g溶于水1 000 mL中,以0.5 mol·L-1NaOH溶液调节pH)为释放介质,按“2.3.2”项下方法考察释放行为,每个规格平行测定3份。
2.5 克林霉素磷酸酯的体外释放机制的探讨
Ritger-Peppas方程[7](方程1)可用于分析溶胀型药物载体系统的药物释放数据,本文采用该方程对CLP体外释放数据进行拟合,以探讨CLP的释放机制。栓剂以 PU/2.0HT材料为基质,厚度为1.6 mm,载药量为50 mg。

Rt表示t时刻药物释放百分数;k表示特定结构或几何形状释药系统的释放常数;n表示释放指数。
3 结果
3.1 聚氨酯水凝胶的合成与表征
3.1.1 聚氨酯水凝胶材料的合成 本文在参考文献[8]的基础上,采用一步法合成不同化学组成的聚氨酯水凝胶材料(见表1),所得材料表面光滑,略带黄色,具有良好的韧性。
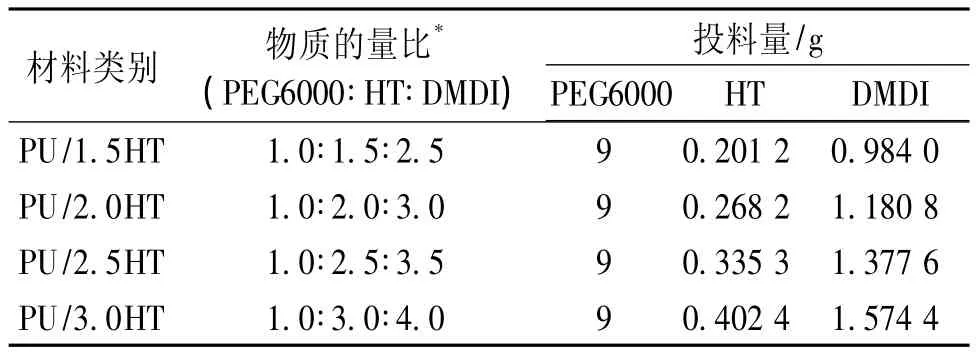
表1 各组聚氨酯水凝胶材料的化学组成Table1 Chemical composition of polyurethane hydrogels
3.1.2 傅里叶变换红外光谱分析 通过FTIR对聚氨酯材料的分子结构进行定性表征,一般主要参考2个波长区域:N-H伸缩振动(3 200~3 500 cm-1)和C==O伸缩振动(1 700~1 730 cm-1)[9-10](见图2)。结果显示:在2 250~2 270 cm-1范围未见明显的峰,表明聚合物中-NCO可忽略不计,即反应完全[11-12];在约1 714和1 112 cm-1处的伸缩振动峰(分别归属于-C==O和-C-O)表明酯键的形成,在3 422和1 531 cm-1处的伸缩振动峰显示-NH-的形成,在1 243 cm-1的伸缩振动峰则归属于-C-N,以上信息证实了聚氨酯材料被成功合成。

图2 聚氨酯材料的红外光谱Figure 2 FTIR spectra of the polyurethanes
3.1.3 溶胀率测定 作为药物缓释载体材料,聚氨酯水凝胶的溶胀性能对控制药物的释放行为具有重要的影响。本实验结果显示:各组成聚氨酯材料在6 h时达到溶胀平衡,在溶胀过程中,材料逐渐由半透明状变成透明状,表面光滑,质地柔软;从材料PU/1.5HT到PU/3.0HT,平衡溶胀率由494%降至243%,可见随着交联度的增加,溶胀率逐渐降低(见图3),推测随着聚氨酯交联度的增大,溶胀后所形成的水凝胶网络结构中,网格更加致密,吸水量减少。
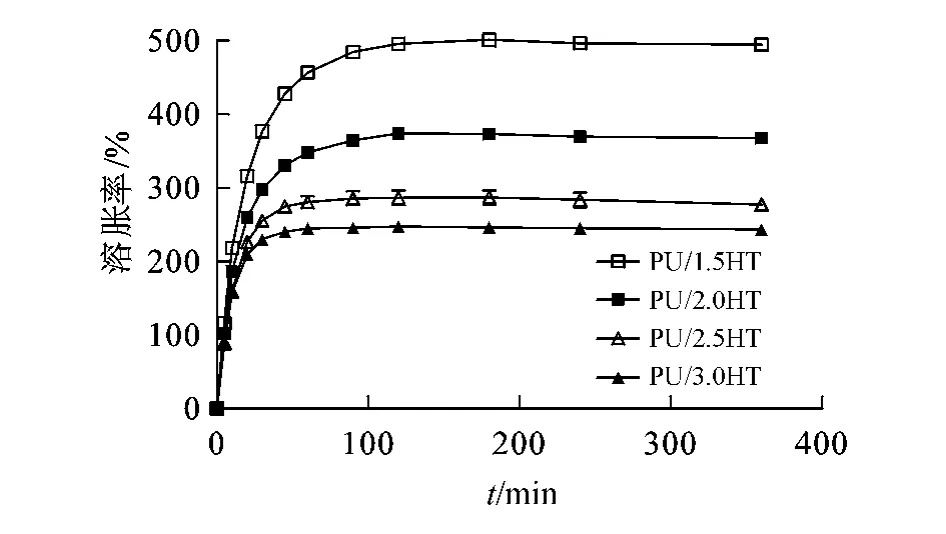
图3 聚氨酯水凝胶在37℃去离子水中的溶胀曲线(±s,n=3)Figure 3 Swelling profile of polyurethanes of different composition in deionized water at37℃
3.2 克林霉素磷酸酯栓剂的制备
制备的栓剂呈淡黄色,表面光滑,且能保持空白栓剂的几何形状。测得栓剂中CLP占目标载药量的95% ~105%,平均为103.0%,RSD为1.8% (n=10),表明该方法载药效果良好。
3.3 克林霉素磷酸酯栓剂体外释放行为及其影响因素
3.3.1 分析方法 在给定的色谱条件下样品色谱峰分离度良好,理论塔板数不低于3 000,CLP溶液在10~200 mg·L-1范围内具有良好的线性关系(r=0.999 9),精密度良好(RSD=0.5%,n=6),平均回收率为99.6%(RSD=0.9%,n=9)。
3.3.2 聚氨酯的化学组成对药物释放的影响 为模拟人体阴道环境,本文采用pH 4.5的磷酸盐缓冲液作为体外释放介质[13],体外释放结果见图4。结果显示:各组栓剂的CLP释放曲线几乎重合,在0.5、1和4 h时,CLP的释放百分数分别约为40%、59%及96%,8 h释放百分数接近100%,表明栓剂具有一定的缓释效果。由图4可见,在一定化学组成范围内,聚氨酯水凝胶对CLP的体外释放基本无影响。
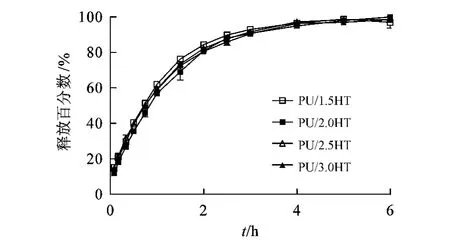
图4 不同化学组成的聚氨酯水凝胶栓剂中克林霉素磷酸酯的释放曲线(±s,n=3)Figure 4 Release curve of clindamycin phosphate from pessaries of different composition
3.3.3 栓剂厚度对体外释放的影响 不同厚度栓剂中CLP的体外释放曲线见图5。结果显示:随着栓剂厚度的增加,CLP释放速度变慢,0.5 h时,0.8、1.3和 1.6 mm组栓剂 CLP释放百分数依次为77%、42%和36%。提示当栓剂厚度增加时,栓剂对CLP的缓释作用更明显;厚度过薄时,则会丧失对CLP的缓释作用,因此,在设计栓剂时,可通过调节栓剂的厚度来控制释药速率。

图5 不同厚度栓剂中克林霉素磷酸酯的释放曲线(±s,n=3)Figure 5 Release curve of clindamycin phosphate from pessaries of different thickness
3.3.4 栓剂载药量对体外释放的影响 不同载药量的栓剂体外释放曲线见图6。结果显示:载药量对CLP体外释放基本没有影响。在0.5、1和4 h时,不同载药量的栓剂中CLP的释放百分数分别约为36%、58%和95%,8 h时基本释放完全。
3.3.5 pH对药物释放的影响 栓剂中CLP在pH分别为4.5、6.0和7.4的磷酸盐缓冲液中的体外释放曲线见图7。结果显示:pH由4.5升至6.0,CLP的释放基本没有变化;而当pH升至7.4时,释放有所减缓,其1、2和6 h释放百分数分别比pH 4.5时降低了9%、11%和6%,缓释效果更佳。
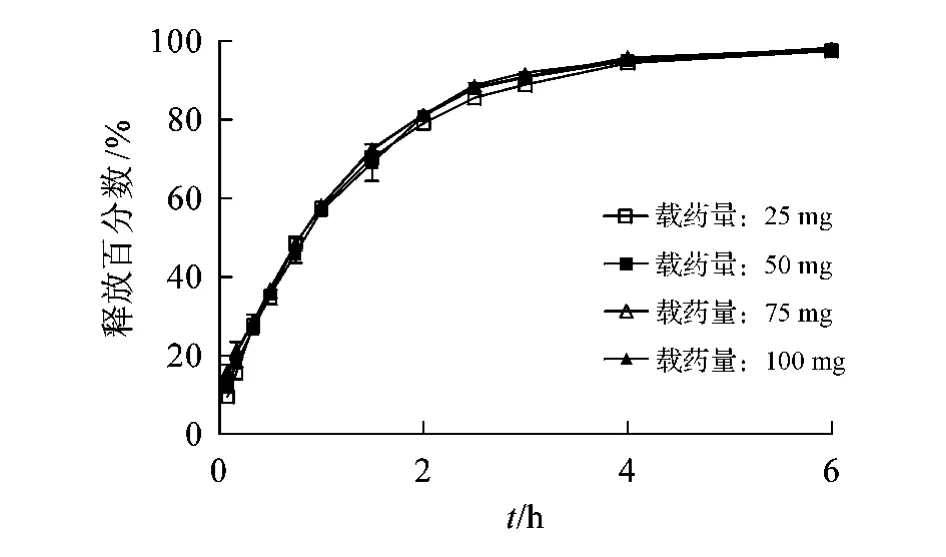
图6 不同载药量的栓剂中克林霉素磷酸酯的释放曲线(±s,n=3)Figure 6 Release curve of clindamycin phosphate from pessaries of different drug loading

图7 不同pH条件下栓剂中克林霉素磷酸酯的释放曲线(±s,n=3)Figure 7 Release curve of clindamycin phosphate from pessaries in different releasemedia
3.4 克林霉素磷酸酯的体外释放机制 CLP栓剂在pH分别为4.5、6.0和7.4的释放介质中的体外释放数据的拟合结果见表2。由表2可知,拟合方程中n介于0.61~0.68,表明CLP释放为非Fick扩散,由溶胀及扩散双重机制控制。

表2 不同pH条件下栓剂中克林霉素磷酸酯体外释放数据的拟合方程Table2 The fitting equation of in vitro release data of CLP under different pH conditions
4 讨论
4.1 聚氨酯水凝胶的合成与表征
聚氨酯合成的方法有半预聚体法、预聚体法和一步法,其中,一步法因具有操作简便、成本低的优点而被广泛应用。本文亦采用该法合成聚氨酯水凝胶材料。
合成聚氨酯材料时,投料比一般按照原料DMDI中异氰酸根(-NCO)的物质的量与PEG6000和HT中-OH的物质的量之和相等的原则。-NCO与-OH反应后生成氨基甲酸酯基团(-NH-COO-),形成三维网状结构(见图8)。当原料中-NCO的物质的量大于-OH的物质的量时,多余的-NCO会与生成的氨基甲酸酯反应,生成副产物脲基甲酸酯[14];当-OH的物质的量过量时,则无法形成完整的聚氨酯水凝胶网状结构,尤其是-OH大大过量时,最终产物会呈现PEG的特点,导致材料的脆性较大。
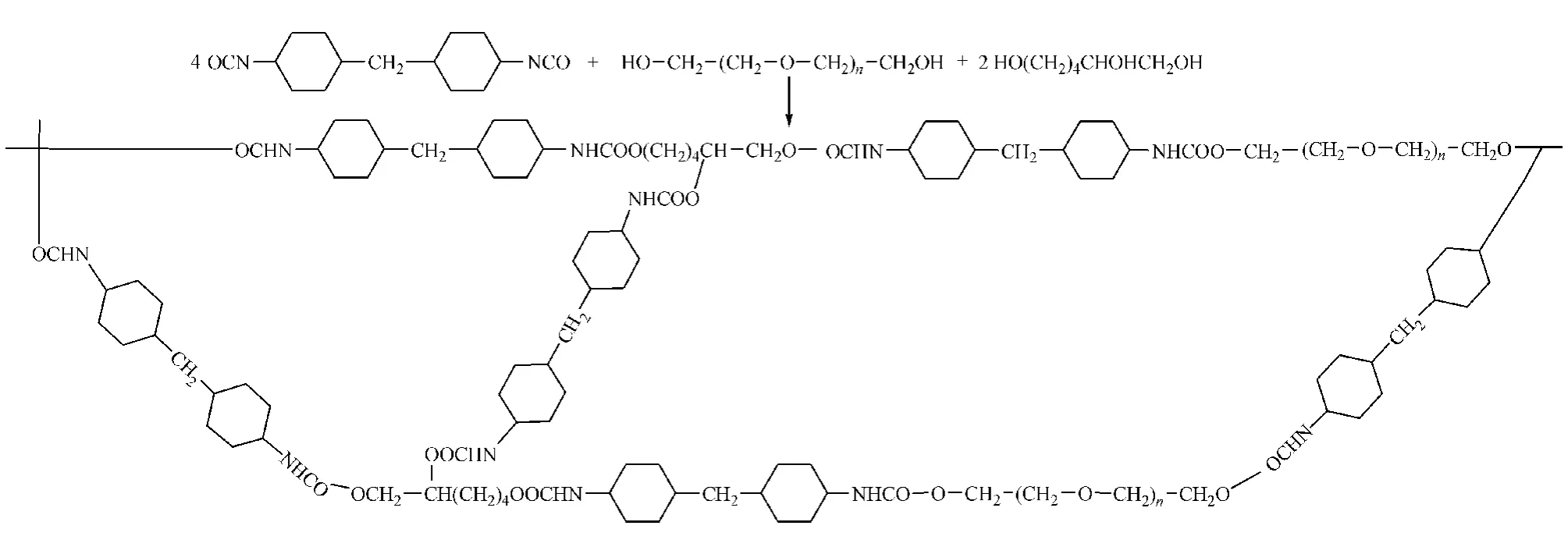
图8 聚氨酯水凝胶的合成示意图Figure 8 Reaction scheme of polyurethane hydrogel
DMDI与PEG、HT发生反应的活性不高,不加FeCl3几乎不反应。经过优化,确定FeCl3的加入量为PEG6000的0.1%,这样既可保证反应时间不会过长,又能确保操作过程中反应混合物不会凝胶化而影响操作。
目前,聚氨酯材料的确证方法主要有NMR及FTIR等,前者只适用于线型聚氨酯材料,后者则适用于线型及体型聚氨酯材料。本文合成的材料为体型聚氨酯材料,故采用FTIR对其进行结构表征。FTIR图谱显示:-NCO基团特征峰消失,-NH-COO特征峰产生,从而确证了聚氨酯水凝胶材料合成成功。一般来说,聚氨酯材料中羰基的游离态吸收峰在1 730 cm-1左右,羰基氢键化后吸收峰则降低至1 710 cm-1左右,故可认为本文合成的聚氨酯材料中有一部分羰基参与了氢键化作用[15]。
本文合成的水凝胶材料具有良好的生物相容性[16],虽然尚需对其纯度及人体安全性作进一步的评价,但已为其应用于生物医药领域提供了良好的基础。
4.2 CLP栓剂的制备
常见的阴道栓剂有球形、卵形、鸭嘴形等形状。其几何形状可根据需要进行调节,本文参考了市售制剂欣普贝生的几何形状(29mm×9.5mm×0.8mm)。
本实验中,载药前通过水-乙醇(50∶50)对空白栓剂进行纯化以除去可溶性杂质(如未反应的PEG6 000及HT)。纯化并干燥后,空白栓剂能恢复原有的几何形状,失重率仅约为1.5%,既保证了栓剂的质量又不至于影响其载药性能。结果表明本实验中采用的制备方法载药效果良好,操作方便,可控性强,具有良好的工业化应用前景。
4.3 克林霉素磷酸酯栓剂体外释放行为
健康女性阴道pH介于3.8~4.5,而细菌性阴道炎患者阴道中的pH会升高,严重者pH可接近7,故有必要考察CLP栓剂在不同pH环境下的释放行为。本文综合考虑影响栓剂释放的制剂学性质及生理因素,考察了化学组成、栓剂厚度、栓剂载药量及释放介质的pH对CLP体外释放行为的影响,并探讨了其释放机制。结果显示:CLP的体外释放受栓剂厚度及pH的影响,而栓剂的化学组成及载药量对其基本无影响。其中,栓剂厚度对释放的影响可能是由于厚度的不同导致了比表面积的不同,厚度增加,比表面积减少,释放减缓。pH对释放的影响则可能是因不同解离状态的CLP在聚氨酯水凝胶中的扩散速率不同所导致[17]。CLP的解离常数(p Ka)为7.5[18],根据 Handerson-Hasselbach方程,当pH为4.5及6.0时,CLP几乎全部处于解离状态,而当pH为7.4时,CLP仅约有一半处于解离状态。这种解离状态的不同可能最终导致释放速率略微不同。对于细菌性阴道炎患者来说,阴道内pH的升高可能会带来更好的缓释效果,使栓剂在体内持续释放出药物,维持局部较高的药物浓度,从而发挥良好的杀菌作用。
对于完全溶胀水凝胶,其药物释放一般遵循Fick扩散[8]。本实验制备的水凝胶栓剂则首先需吸水溶胀,溶解栓剂中的药物,随后才进行药物释放,因此,其控释药物的机制并非简单的Fick扩散。Ritger-Peppas方程中,对于片状释药系统来说,当n=0.5时,显示药物释放符合Fick扩散,为扩散控制型释放;当n=1.0时,显示药物释放为溶胀控制型;当0.5<n<1.0时,则说明药物释放非Fick扩散,由溶胀及扩散双重机制控制。拟合结果证实,栓剂在pH4.5、6.0及7.4时均为非Fick扩散,由溶胀及扩散双重机制控制。
[1] Hoare T R,Kohane D S.Hydrogels in drug delivery:progress and challenges[J].Polymer,2008,49(8): 1993-2007.
[2] Bhattarai N,Gunn J,Zhang M.Chitosan-based hydrogels for controlled,localized drug delivery[J].Adv Drug Deliv Rev,2010,62(1):83-99.
[3] Ferse B,Graf M,Krahl F.Photopolymerization as alternative concept for synthesis of poly(N-isopropylacrylamide)-clay nanocomposite hydrogels[J].Macromol Symp,2011,306(1):59-66.
[4] Jiang G,Tuo X,Wang D,et al.Syntheses and self-assembly of novel polyurethane-itaconic acid copolymer hydrogels[J].React Funct Polym,2010,70(3):175-181.
[5] Ibe C,Simon JA.Vulvovaginalatrophy:currentand future therapies(CME)[J].J Sex Med,2010,7(3): 1042-1050.
[6] Zhang T,Xi K,Yu X,et al.Synthesis,properties of fullerene-containing polyurethane-urea and its optical limiting absorption[J].Polymer,2003,44(9): 2647-2654.
[7] Ritger P L,Peppas N A.A simple equation for description of solute release II.Fickian and anomalous release from swellable devices[J].J Controlled Release,1987,5(1): 37-42.
[8] McNeill M E,Graham N B.Vaginal pessaries from crystalline/rubbery hydrogels for the delivery of prostaglandin E2[J].JControlled Release,1984,1(2):99-117.
[9] Papadimitrakopoulos F,Sawa E,MacKnight W J.Investigation of a monotropic liquid crystal polyurethane based on biphenol,2,6-tolylene diisocyanate,and a six methylene containing flexible spacer.2.IR spectroscopic phase characterization[J].Macromolecules,1992,25(18): 4682-4691.
[10]Yuan D,Ju C,Ding S,et al.Synthesis of 1-octadecanolmodified water-swelling polyurethane hydrogels as vaginal drug-delivery vehicle[J].J Biomater Sci Polymer Ed,2010,21(4):493-505.
[11]Sun Y X,Xiao W,Cheng S X,et al.Synthesis of(Dex-HMDI)-g-PEIs as effective and low cytotoxic nonviral gene vectors[J].J Controlled Release,2008,128(2): 171-178.
[12]Solís-Correa R E,Vargas-Coronado R,Aguilar-Vega M,et al.Synthesis of HMDI-based segmented polyurethanes and their use in themanufacture of elastomeric composites for cardiovascular applications[J].JBiomater Sci Polym Ed,2007,18(5):561-578.
[13]Paveli Z,Škalko-Basnet N,Schubert R.Liposomal gels for vaginal drug delivery[J].Int JPharm,2001,219(2): 139-149.
[14] Dušek K,ŠpirkováM,Havliˇcek I.Network formation of polyurethanes due to side reactions[J].Macromolecules,1990,23(6):1774-1781.
[15]罗宁,王得宁,应圣康.聚氨醋红外光谱氢键化谱带的归属与定量分析[J].合成橡胶工业,1995,18(4): 200-203.
[16]Graham N B,McNeill M E.Hydrogels for controlled drug delivery[J].Biomaterials,1984,5(1):27-36.
[17]Gupta P,Vermani K,Garg S.Hydrogels:from controlled release to pH-responsive drug delivery[J].Drug Discov Today,2002,7(10):569-579.
[18]Fujita Y,Tokunaga T,Kataoka H.Saline and buffersminimize the action of interfering factors in the bacterial endotoxins test[J].Anal Biochem,2011,409(1):46-53.
[3] 全国第四届脑血管病学术会议组.各类脑血管疾病诊断要点[J].中华神经科杂志,1996,29(6):379-379.
[4] 林波,谭少华.短暂性脑缺血发作发展至脑梗死危险因素分析[J].广东医学,2010,31(12):1547-1549.
[5] 解新荣,曹莹,宁红霞,等.血液炎性因子与短暂性脑缺血发作的相关性[J].临床医学,2011,31(8): 41-43.
[6] 亓勤德,吕翠,张德庆,等.短暂性脑缺血发作患者血清IL-6、IL-18水平检测及意义[J].山东医药,2009,49 (7):85-86.
[7] Tanne D,Benderly M,Goldbourt U,et al.C-reactive protein as a predictor of incident ischemic stroke among patients with preexisting cardiovascular disease[J].Stoke,2006,37(7):1720-1724.
[8] Hashimoto H,Kitagawa K,Hougaku H,et al.Relationship between C-reactive protein and progression of early carotid atherosclerosis in hypertensive subjects[J].Stroke,2004,35(7):1625-1630.
[9] 乔伟,王淑贞,庞珂,等.氯吡格雷对急性缺血性脑卒中患者血清炎性标志物的影响[J].山东医药,2012,52,(5):92-93.
[10]任美书,王玉顺,张明义,等.老年急性缺血性脑卒中患者血清白细胞介素-6和肿瘤坏死因子-α的观察[J].中国现代神经疾病杂志,2007,7(5):445-446.
