大肠癌ART1的表达与VEGF、整合素αVβ3表达及微血管形成的相关性
2012-01-11王娅兰盛永涛徐剑侠
杨 炼,王娅兰,盛永涛,熊 薇,徐剑侠,唐 怡,李 娴
(重庆医科大学病理教研室,重庆400016)
大肠癌ART1的表达与VEGF、整合素αVβ3表达及微血管形成的相关性
杨 炼,王娅兰*,盛永涛,熊 薇,徐剑侠,唐 怡,李 娴
(重庆医科大学病理教研室,重庆400016)
目的 探讨大肠癌组织中单ADP核糖基转移酶ART1的表达与VEGF、整合素αVβ3表达的相关性及其对大肠癌组织微血管生成的影响。方法 免疫组化检测大肠癌组织中ART1、VEGF及整合素αVβ3的表达;免疫荧光双标检测ART1/VEGF及ART1/整合素αVβ3的共表达,用Chalkley分析法评估微血管的形成。结果 ART1、VEGF与整合素αVβ3的表达高于对照(P<0.05),且ART1与VEGF、整合素αVβ3的表达呈正相关(P<0.05)。ART1/VEGF及ART1/整合素αVβ3共表达的大肠癌组织微血管密度较高(分别为25.4±8.23和22.3±5.9),且高于非共表达组(分别为5.5±2.0和8.1±3.3,P<0.01)。结论 ART1在大肠癌组织中表达增强,并与VEGF及整合素αVβ3的表达具有正相关性,可能促进肿瘤微血管生成。
ART1;VEGF;整合素αVβ3;大肠癌;微血管形成
单 ADP核糖基转移酶[mono(ADP-ribosyl)transferase,ARTs]催化单ADP核糖基化反应(mono-ADP-ribosylation),将ADP-核糖从 NAD+转移到受体蛋白质氨基酸残基上,对细胞多种蛋白质进行翻译后修饰,影响细胞分化和增殖过程。有研究者发现幽门螺旋杆菌可激活ARTs,诱发ADP核糖基转移并改变黏膜蛋白结构,与胃癌的发生发展相关[1]。在哺乳动物中已发现5种 ARTs(ART1~ART5)。ART1存在于人类的骨骼肌细胞、心肌细胞、白细胞及气道上皮细胞中[2-3]。ART1可以修饰成纤维细胞生长因子2(fibroblast growth factor 2,FGF-2),改变FGF-2与细胞表面受体结合的亲和性从而影响FGF-2信号传导过程[4]。但ART1与肿瘤关系的研究还很少。ART1能否通过调节VEGF和整合素αVβ3的表达影响大肠癌血管生成是本研究的重点,并为进一步研究ART1调节肿瘤侵袭机制奠定基础。
1 材料与方法
1.1 材料
大肠癌标本来自重庆医科大学附属第一医院病理科2005年-2010年间经明确诊断病例80例。病理学分级严格按照WTO大肠癌分级标准。其中高分化腺癌(Ⅰ级)20例、中分化腺癌(Ⅱ级)24例、低分化腺癌及黏液腺癌(Ⅲ级)36例。另20例正常肠黏膜作对照。所有标本经10%甲醛固定,石蜡包埋,5 μm连续切片。
1.2 试剂
羊抗人 ART1(S-15,SC-20255)多克隆抗体(Santa Cruz公司),羊抗小鼠VEGF多克隆抗体(北京中衫金桥公司),羊抗小鼠整合素αVβ3、兔抗人CD34多克隆抗体、荧光素Cy3标记兔抗羊IgG、荧光素FITc分别标记的羊抗小鼠及羊抗兔IgG(北京博奥森公司)。免疫组化试剂盒(EnVisionTMDetection Kit)(基因科技上海公司)。
1.3 方法
1.3.1 免疫组化:按照EnVisionTMDetection Kit免疫组化试剂盒说明书操作。结果判定参照文献[5]进行。阳性范围:随机观察5~10个中倍视野(×200倍),将每个视野中阳性细胞数的平均百分比作为该切片的阳性细胞百分比率。判别标准:阳性百分比<5%为0分,介于5% ~25%之间判为1分,26% ~50%之间为2分,>50%为3分。染色强度:无着色为0分,黄色为1分,(深)棕黄色为2分,棕褐色为3分;上述两项结果相加,0分为阴性(-),1~3分为弱阳性(+),4~5分为中等度阳性(2+),6分为强阳性(3+)。另以PBS代替一抗为阴性对照,已知阳性小鼠大脑图片为阳性对照。
1.3.2 免疫荧光双标染色:按常规免疫荧光双标染色法,对同一切片组织ART1/VEGF、ART1/整合素αVβ3的共表达进行检测。FITc标记的荧光抗体在525 nm光波激发下呈现绿色荧光;Cy3标记的荧光抗体在570 nm光波激发下呈现红色荧光。用Emage-Pro Express软件进行图像叠加处理同一切片组织在2种光波下的呈色。PBS分别代替一抗、荧光抗体作为阴性对照,已知阳性小鼠脑组织切片为阳性对照。
1.3.3 肿瘤微血管密度(MVD):按照文献[6]的评判标准,用Chalkley分析法计数肿瘤内着色的毛细血管和微小血管数量。棕色单个内皮细胞或者实心内皮细胞团均作为一个血管计数。肿瘤内纤维增生区、坏死区及与肿瘤交界处软组织内的微血管不计数。肿瘤间质中的厚壁血管及管腔直径超过8个红细胞直径之和的较大血管也排除在外。计数方法:每张染色切片选择3~5个血管数量最多的癌间质区,在高倍视野(×400倍)下进行血管计数。每例标本分别计数3~5个视野,取每个视野血管数量的平均值.
1.4 统计学分析
采用SPSSl2.0统计软件进行χ2检验、Wilcoxon秩和检验及Speaman相关分析。
2 结果
2.1 免疫组化染色结果
ART1、VEGF、整合素 αVβ3染色均位于肿瘤细胞胞质及胞膜 (图 1),80例大肠癌中,ART1、VEGF、整合素 αVβ3阳性表达率分别为 67.5%(54/80例)、85%(68/80 例)、70%(56/80 例)。阳性率及表达强度均明显高于正常肠黏膜组织(P<0.05)(表1)。
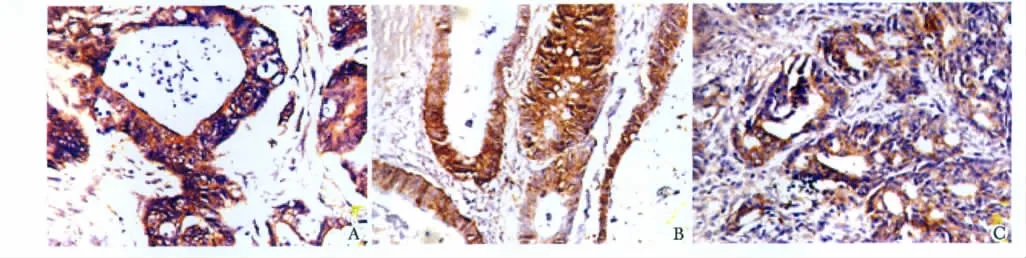
图1 ART1、VEGF及整合素αVβ3在大肠癌组织中的表达Fig 1 The expression of ART1,VEGF and integrin αVβ3 in colorectal carcinoma by immunohistochemical staining(×200)

表1 ART1、VEGF和整合素αVβ3在大肠癌及对照肠黏膜中的表达Table 1 The expression of ART1,VEGF and integrin αVβ3 in colorectal carcinoma and control colon mucosa
从临床资料上看,ART1、VEGF、整合素 αVβ3的表达在患者年龄、性别及病理学分级等方面未见明显差别。同时,肿瘤浆膜浸润和(或)伴有淋巴结转移的患者组与无浆膜浸润和(或)无淋巴结转移组之间,ART1的表达阳性率统计显示差别不明显,但是VEGF和整合素αVβ3的表达在肿瘤浆膜浸润和(或)伴有淋巴结转移的患者组中的表达阳性率明显增高(P<0.05)(表2)。
2.2 免疫荧光双标染色结果
ART1为Cy3标记显示红色荧光,显色部位位于肿瘤细胞胞质及胞膜;VEGF和整合素αVβ3为FITc标记显示绿色荧光,显色部位均位于肿瘤细胞胞质;ART1/VEGF、ART1/整合素αVβ3共表达经激光共聚焦显示橙色荧光(图2)。80例大肠癌组织中 ART1、VEGF、整合素 αVβ3 表达率分别为72.5%(58/80)、85%(68/80)、72.5%(58/80)。其中ART1/VEGF、ART1/整合素αVβ3共表达分别为51例、40例,同时阴性表达分别为5例、10例。Spearman相关性分析显示两者表达呈正相关(P<0.05)(表3)。此外,正常肠黏膜组织中几乎无荧光显示(P<0.01)。

表2 ART1、VEGF和整合素αVβ3的表达与大肠癌临床病理学特征的关系Table 2 The relation of the expression of ART1,VEGF and integrin αVβ3 with the clinpathological characteristics of colorectal carcinoma

图2 ART1/VEGF、ART1/整合素αVβ3在大肠癌组织中的共表达Fig 2 The co-expression of ART1/VEGF and ART1/integrin αVβ3 in colorectal carcinoma by immunofluorescence double staining(×400)

表3 大肠癌组织中ART1与VEGF和整合素αVβ3表达的相关性分析Table 3 The correlation analysis of expression of ART1 with VEGF and integrin αVβ3 in colorectal carcinoma
2.3 大肠癌微血管计数
采用CD34标记大肠癌组织中的微血管内皮细胞,可见肠癌组织中不同区域微血管大小、形态及密度有明显区别。微血管密度较高的区域血管多为单个CD34阳性细胞或阳性实心细胞团,无明显管腔,部分小血管管腔不规则,部分小血管呈树枝状;微血管密度较低的区域则单个CD34阳性细胞及实心细胞团比较少见,血管腔圆形或椭圆形,管腔直径较大,形状相对规则且数量少(图3)。统计学显示,在20例ART1表达较强或ART1/VEGF、ART1/整合素αVβ3共表达较强烈的大肠癌组织微血管密度较高,而 ART1阴性或 ART1/VEGF、ART1/整合素αVβ3均不表达的大肠癌组织中血管密度低(P<0.01)(表4)。
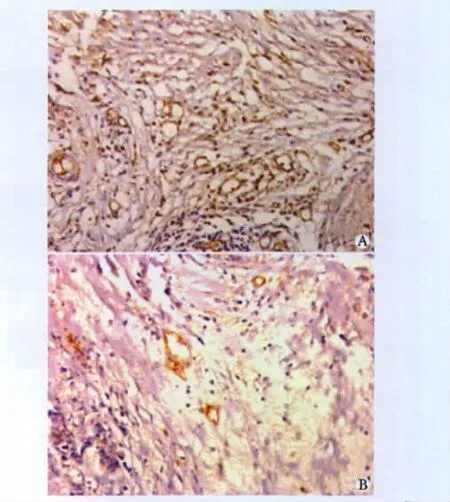
图3 CD34在大肠癌组织中的表达Fig 3 The expression of CD34 in colorectal carcinoma by immunohistochemical staining(×200)
表4 ART1/VEGF、ART1/整合素αVβ3共表达组与非共表达组微血管密度的比较Table 4 The comparison of microvessel density between co-expressed group and non-co-expressed group(±s,n=20)
*P <0.01 compared with group of non-co-expression.
group ART1/VEGF ART1/integrin αVβ3 co-expression 25.4±8.3* 22.3±5.9*non-co-expression 5.5±2.0 8.1±3.3
3 讨论
ART1是精氨酸特异性单ADP核糖基转移酶,催化NAD+的ADP核糖基转移到受体蛋白质的精氨酸残基上,修饰该蛋白质并改变该蛋白质的活性,参与细胞分化与增殖。
文献报道ART1可以糖基化血小板衍生生长因子 BB(platelet-derived growth factor BB,PDGF-BB),调节PDGF-BB与其受体的结合以及其信号传导能力,并发现转染ART1的成纤维细胞表面ART1衰减的同时,PDGF-BB与其受体的结合也受到了抑制[7]。在骨骼肌细胞中,整合素α7也可成为ARTs的底物,接受其调节从而改变相关功能[8]。使用ART1特异性抑制剂MIBG作用于人骨骼肌细胞、平滑肌细胞及血管内膜细胞,结果无论在体外还是在体内,MIBG可以明显抑制这些细胞的生长和增殖,有力证实了ART1对细胞生长和增殖的作用,但其机制仍不清楚[9-11]。由于 MIBG是小分子精氨酸的类似物,可作为ART1的底物,竞争性地与ART1相结合,因此推测,MIBG与ART1结合可能影响细胞因子的翻译后修饰,改变了生长因子的结构,从而影响信号传导通路,阻止了细胞对生长因子的反应。在对视网膜ADP核糖基转移酶的研究中发现ARTs可直接调节磷酸二酯酶的功能,改变细胞信号传导过程[12]。
血管内皮生长因子(vascular endothelial growth factor,VEGF)和整合素 αVβ3(integrin αVβ3)是参与肿瘤血管生成的重要生长因子,与ART1的关系尚未见文献报道。VEGF结构上归属于PDGF,通过受体VEGFR2/KDR刺激内皮细胞活化,降解基底膜,边迁移边增殖并形成新的血管[13]。整合素αVβ3位于细胞膜,作为一种信号受体能够诱导蛋白酪氨酸磷酸化以传递细胞信号,参与VEGF诱导的血管生成,刺激肿瘤生长和VEGF进一步的产生以支持血管生成[14]。本实验观察了大肠癌组织中ART1、VEGF及整合素αVβ3的表达。结果显示大肠癌组织中ART1表达增强,且ART1与VEGF和整合素 αVβ3的表达正相关;且 ART1/VEGF、ART1/整合素αVβ3共表达组微血管密度增高,提示ART1的表达可能促进肿瘤组织血管生成,推测ART1可能通过对VEGF和整合素αVβ3的核糖基化修饰来影响该因子信号传导通路,进而影响肿瘤细胞的血管生成。
[1]Akai T,Nabeya Y,Yahiro K.Helicobacter pylori induces mono-(adenosine 5'-diphosphate)-ribosylation in human gastric adenocarcinoma[J].Int J Oncol,2006,4:965 -972.
[2]Kefalas P,Allpopt JR,Donnelly LE,et al.Arginine-specific mono(ADP-ribo-syl)transferase activity in human neutrophil polymorphs possible link with the assembly of filamentous actin and chemotaxis [J].Adv Exp Med Biol,1997,419:241-244.
[3]Balducct E,Horiba K,Usuki J,et al.Selective expression of RT6 superfamily in human bronchial epithelial cells[J].Am J Respir Cell Mol Biol,1999,21:337 -346.
[4]Jones EM,Baird A.Cell surface ADP-ribosylation of fibroblast growth factor-2 by an arginine-specific ADP-ribosyltransferase[J].Biochem J,1997,323:173 -177.
[5]Brow Rs,Walll RL.0verexpression of glut-1 glucose transporter in human breast cancer:an immunohistochemical study[J].Cancer,1993,72:2979 -2985.
[6]Weidner N,Semple JP,Welch WR,et al.Tumor angiogenesis and metastasis-correlation in invasive breast carcinoma[J].N Engl J Med,1991,324:1 -8.
[7]Barbara A,Saxty M,Yadollahi F,et al.Inactivation of platelet derived growth factor BB following modification by ADP-ribosyltransferase[J].Bri J Phar,2001,133:1219 -1226.
[8]Zhao Z,Gruszczynska BJ,Zolkiewska.A.ADP-ribosylation of integrin alpha7 modulates the binding of integrin alpha7beta1 to laminin[J].Biochem J,2005,385:309 -317.
[9]Yau L,Litchie B,Thomas S,et al.Endogenous mono-ADP-ribosylation mediates smooth muscle cell proliferation and migration via protein kinase N-dependent induction of c-fos expression[J].Eur J Biochem,2003,270:101 -110.
[10]Yau L,,Litchie B,Zahradka P.MIBG,an inhibitor of arginine-dependent mono(ADP-ribosyl)ation,prevents differentiation of L6 skeletal myblasts by inhibiting expression of myogenin and p21 [J].Exp Cell Res,2004,301:320 -330.
[11]Lorraine Y,Peter M,Michael C.Meta-Iodobenzylguanidine,an inhibitor of arginine-dependent mono(ADP-ribosyl)ation,prevents neointimal hyperplasia[J].Ame Soc Phar Exp Thera,2008,3:717-724.
[12]Bondarenko VA,Yamazaki A.Characterization of argininespecific mono-ADP ribosyltransferase isolated from frog retina and its function in signal transduction[J].Invest Ophthalmol Vis Sci,2009,50:5440.
[13]Zachary I.VEGF signalling:integration and multi-tasking in endothelial cell biology[J].Biochem Soc Trans,2003,31:1171-1177.
[14]De S,Chen J,Narizhneva NV,et al.Molecular pathway for cancer metastasis to bone[J].J Biol Chem,2003,40:39044-39050.
The correlation of ART1 expression with angiogenesis in colorectal carcinoma and it relationship with VEGF and integrin αVβ3 expressions
YANG Lian,WANG Ya-lan*,SHENG Yong-tao,XIONG Wei,XU Jian-xia,TANG Yi,LI Xian
(Dept.of Pathology,Chongqing University of Medical Sciences,Chongqing 400016,China)
ObjectiveTo study correlation of the ART1 expression on VEGF and integrin αVβ3 expression and the effect of ART1 on microangiogenesis in colorectal carcinoma.MethodsImmunohistochemical was used to detect the expression of ART1,VEGF and integrin αVβ3,and immunofluorescence double staining was used to detect coexpression of ART1/VEGF and ART1/integrin αVβ3;and the microvascular density(MVD)quantified by Chalkley analysis.ResultsThe expressions of ART1,VEGF and integrin αVβ3 were significantly higher than in the control group(P<0.05),and there was a positive correlation of ART1 with VEGF and integrin αVβ3(P<0.05).The group of co-expression of ART1/VEGF and ART1/integrin αVβ3 showed higher microvessel density(25.4 ±8.23,22.3±5.9)than non-co-expression group(5.5±2.0,8.1±3.3,P<0.01).ConclusionsThe activity of ART1 is increased in colorectal carcinoma tissues,and shows positive relation with the expressions of VEGF and integrin αVβ3.It may possibly induce tumor angiogenesis.
ART1;VEGF;integrin αVβ3;colorectal carcinoma;angiogenesis
R 735.34
A
1001-6325(2012)09-1064-06
2011-10-21
2011-12-28
高等学校博士学科点专项科研基金联合资助项目(20105503110009);重庆市教委科学技术研究项目(KJ 110322)
*通信作者(corresponding author):wangyalan074@126.com
