PTEN mRNA和Smad4 mRNA在甲状腺乳头状癌中的表达及意义
2012-01-11李青山徐大为
黄 亮,刘 镭,黄 旭,李青山,徐大为
(1.承德医学院附属医院,河北承德 067000;2.承德医学院)
甲状腺乳头状癌(PTC)是甲状腺癌中最常见的类型,约占甲状腺癌的60%-89%[1]。PTC有许多组织学变型,它们的临床特点、病理改变和预后差异较大。高明等[2]曾按颈淋巴结转移发生率的高低将PTC分为高、中、低转移变型组,各组之间肿瘤的侵袭性、淋巴结转移率及预后均有显著差异。PTEN基因和Smad4基因是近年发现的两种抑癌基因,与多条细胞信号转导通路相关,参与肿瘤的发生与发展。本研究采用实时荧光定量聚合酶链反应(FQ-PCR)方法检测了PTEN mRNA、Smad4 mRNA在PTC中的表达水平,并证实了它们与PTC侵袭及转移的关系。
1 材料与方法
1.1 一般资料 2009年3月-9月在天津医科大学附属肿瘤医院和承德医学院附属医院手术切除的新鲜组织标本,均经术后病理检查证实。PTC 94例,男22例、女72例,年龄4-81岁,中位年龄48岁;甲状腺腺瘤29例,男9例、女20例,年龄16-75岁,中位年龄44岁。同时,收集甲状腺癌旁组织94例。
1.2 标本收集 术中收集PTC病灶中央组织,癌旁组织距癌灶边缘至少1cm,甲状腺腺瘤组织约100mg。标本装入无菌管内,迅速投入液氮内冷冻。
1.3 提取总RNA和合成cDNA 参照Trizol说明书操作提取总RNA,所得RNA用75%乙醇洗涤后晾干,溶于20ml DEPC水中,测定RNA浓度及A260/A280,琼脂糖凝胶电泳检测RNA质量,选取A260/A280比值为1.8-2.0的RNA进行反转录,所得cDNA产物-20℃保存。
1.4 FQ-PCR PTEN、Smad4及内参照GAPDH的引物序列由北京奥科生物公司合成。PTEN上、下游引物序列分别为F-5’CCAGTCAGAGGCGCTAT 3’和R-5’AACTTGTCTTCCCGTCGTGT 3’(208bp);Smad4上下游引物序列分别为F-5’ATGACCTTCGTCGCTTA TGC 3’和R-5’GGCCCGGTGTAAGTGA 3’(119bp);GAPDH上下游引物序列分别为F-5’ATGGCCTCCAA GGAGTAAGAC 3’和R-5’GATGGTACATGACAAGG TGCG 3’(195bp)。20μl PCR 反应体系包括:10μl 2×SYBR Premix Ex TaqTM(Takara 公司),0.4μl 50×ROX Reference Dye Ⅱ,10μmol/L的上、下游引物各1μL,1μL cDNA,GAPDH为内参照。每个样本的每个待测项目均测3次,取平均值。反应条件:94℃变性4min,94℃ 1min,58℃ 30s,共40个循环扩增。记录各样品的Ct值,计算-△Ct值(目的基因的相对表达量)以及Q值(待测组目的基因相对癌旁组表达量)。计算公式如下:△Ct目的基因=Ct目的基因-CtGAPDH;△△Ct=△Ct目的基因-△Ct癌旁组;Q=2-ΔΔCt。
1.5 统计处理 采用SPSS 17.0统计软件包进行统计分析。组间比较采用方差分析,两两比较采用Bonfferoin法,相关分析采用两个变量pearson关联性分析。
2 结果
2.1 各组PTEN mRNA和Smad4 mRNA的表达 见附表。PTC高、中、低转移变型组PTEN mRNA和Smad4 mRNA的表达明显低于甲状腺腺瘤组及癌旁组(P<0.05)。PTC高、中转移变型组明显低于低转移变型组(P<0.05),高转移变型组明显低于中转移变型组(P<0.05)。
附表 各组PTEN mRNA和Smad4 mRNA的表达(±s)
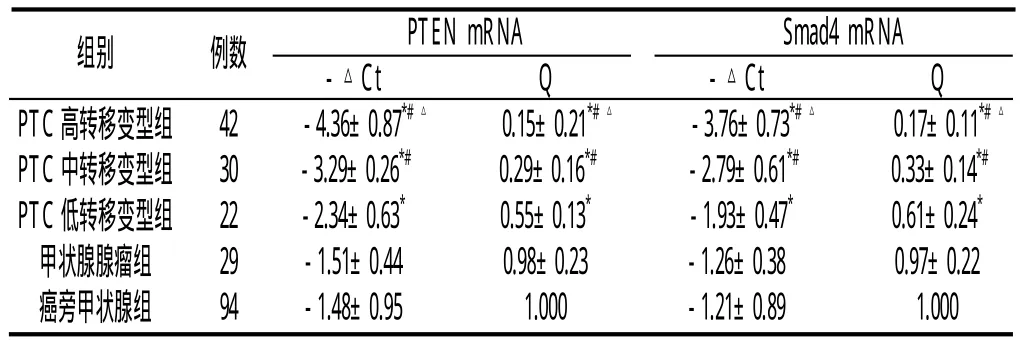
附表 各组PTEN mRNA和Smad4 mRNA的表达(±s)
与腺瘤组和癌旁组比较:*P<0.05;与低转移变型组比较:#P<0.05;与中转移变型组比较:△P<0.05
组别 例数 PTEN mRNA Smad4 mRNA-△Ct Q -△Ct Q PTC高转移变型组 42 -4.36±0.87*#△ 0.15±0.21*#△ -3.76±0.73*#△ 0.17±0.11*#△PTC中转移变型组 30 -3.29±0.26*# 0.29±0.16*# -2.79±0.61*# 0.33±0.14*#PTC低转移变型组 22 -2.34±0.63* 0.55±0.13* -1.93±0.47* 0.61±0.24*甲状腺腺瘤组 29 -1.51±0.44 0.98±0.23 -1.26±0.38 0.97±0.22癌旁甲状腺组 94 -1.48±0.95 1.000 -1.21±0.89 1.000
2.2 PTEN与Smad4的相关性 PTEN mRNA与Smad4 mRNA的表达存在正相关性,r=0.89(P<0.05)。
3 讨论
正常血管生成需要PI3K-AKT/PKB信号途径,PIP3通过作用于下游靶蛋白,促进血管内皮生长因子(VEGF)的合成,进而促进血管生成[3]。PTEN可使PIP3的D3位去磷酸化,降低AKT/PKB的磷酸化水平,抑制VEGF的表达,从而抑制血管生成[4]。PTEN蛋白表达降低或缺失时失去对PI3K/AKT途径的下调作用,从而促进血管内皮细胞增殖和肿瘤微血管形成,继而使肿瘤细胞的侵袭转移能力增高[5]。目前已经明确VEGF的启动子区含有典型的能被Smad4识别的核苷酸元件,是Smad4参与调节的下游靶基因[6]。Schwarte等[7]在研究胰腺癌细胞株时发现,体内Smad4的重新表达抑制了肿瘤的生长,更为重要的是抑制了血管的形成,减少了VEGF的表达,提示Smad4可能是通过对体内肿瘤血管生成的影响发挥抑瘤作用。
本研究显示,在PTC高、中、低转移变型组,甲状腺腺瘤组及癌旁甲状腺组随着恶性程度的升高,作为VEGF的上游调控基因的抑癌基因PTEN、Smad4的表达逐渐降低。可能机制为:高度恶性的PTC细胞,由于PTEN和(或)Smad4表达的缺失或减少,直接导致下游被调控基因VEGF表达的增高,其编码的VEGF蛋白合成增多并从癌细胞内分泌到细胞外,与血管(或淋巴管)内皮细胞上的受体结合后发挥作用,造成PTC的高侵袭性及高转移性。随着肿瘤恶性程度的降低,PTEN和(或)Smad4的表达逐渐增高,下游被调控的VEGF表达逐渐降低,侵袭性和转移性也随之降低。
目前,PTEN与Smad4之间的相互关系尚在研究之中。XU等[8]通过对胆管细胞癌的研究发现,在大部分PTEN失活的同时约一半的Smad4也失去了表达。另外还有研究发现,单独的Smad4蛋白表达缺失并不导致胰腺肿瘤,但却增强了PTEN的失活;单独的PTEN缺失只是引起广泛的癌前病变和较低的肿瘤发病率,但却加快了Smad4蛋白的缺乏;而PTEN与Smad4同时缺乏(或突变)却提高了胰腺癌细胞的增殖和转移[9]。Teng等[10]发现,PTEN和Smad4双基因剔除的小鼠食管和胃粘膜上皮的增殖显著增加,提示Smad4介导的TGF-β和PTEN调节的PI3K/AKT信号通路之间存在协同作用。结合本研究结果,PTC中PTEN和Smad4的表达存在正相关关系,亦证明PTEN和Smad4之间存在相互协调的作用,但具体机制尚需要进一步的研究。
PTC的侵袭和转移是一个复杂的过程,涉及到多个基因和多条信号转导通路,作为与肿瘤侵袭和转移密切相关的VEGF基因的上游调控基因,PTEN和Smad4及相关的信号通路是其中的重要因素。二者在PTC的发生发展过程中有协同作用,PTEN和Smad4低表达使PTC具有较高的侵袭和转移潜能,可作为判断PTC预后的指标。
[1]Belfiore A, Giufrida D, La Rosa GL, et al.High frequency of cancer in cold thyroid nodules occurring at young age[J].Acta Endocrinol, 2003, 121(2):197-202.
[2]高明,李小龙,高松源,等.甲状腺乳头状癌组织学变型的临床生物学特性[J].中华普通外科杂志,2006,21(8):588-590.
[3]Huang J, Kontos CD.PTEN modulates vascular endothelial growth factor-mediated signaling and angiogenic effects[J].J Biol Chem,2002,277(13):10760-10766.
[4]Pore N, Liu S, Haas-Kogan DA, et al.PTEN mutation and epidermal growth factor receptor activation regulate vascular endothelial growth factor(VEGF)mRNA expression in human glioblastoma cells by transactivating the proximal VEGF promoter[J].Cancer Res,2003,63(1): 236-241.
[5]Connor KM, Subbaram S, Regan KJ, et al.Mitochondrial H2O2regulates the angiogenic phenotype via PTEN oxidation[J].J Biol Chem, 2005 ,280(17):16916-16924.
[6]Schiffer M, Bitzer M, Roberts IS, et al.Apoptosis in podocytes induced by Dijke P, Mundel TGF-beta and Smad7[J].J Clin Invest, 2001, 108(6):807-816.
[7]Schwarte-Waldhoff I, Volpert OV, Bouck NP, et al.Smad4/DPC4-mediated tumor suppression through suppression of angiogenesis[J].Proc Natl Acad Sci USA,2000,97(17):9624-9629.
[8]Xu X, Kobayashi S, Qiao W, et al.Induction ofintrahepatic cholangiocellular carcinoma by liver-specific disruption of Smad4 and PTEN in mice[J].J Clin Invest, 2006,116(7):1843-1852.
[9]Xu X, Ehdaie B, Ohara N,et al.Synergistic action of Smad4 and PTEN in suppressing pancreatic ductal adenocarcinoma formation in mice[J].Oncogene, 2010,29(5):674-686.
[10]Teng Y, Sun AN, Pan XC, et al.Synergistic function of Smad4 and PTEN in suppressing forestomach squamous cell carcinoma in the mouse[J].Cancer Res, 2006, 66(14): 6972-6981.
