土壤细菌群落密度实时荧光定量PCR检测体系的建立
2012-01-11,,,3,
,, ,3,
(1.中国科学院 东北地理与农业生态研究所 黑土区农业生态院重点实验室,海伦农田生态系统国家野外观测研究站,黑龙江 哈尔滨 150081;2.东北林业大学,黑龙江 哈尔滨 150040;3.中国科学院 研究生院,北京 100049; 4.中国科学院 生态环境研究中心,北京 100085)
在土壤微生物群落生态学研究中量化微生物群落的组成、确定群落的优势种群和检测具有某种生物学功能微生物类群的丰度是非常必要的[1-2]。然而,由于许多环境微生物的不可培养性,为研究增添了一些障碍[3]。实时荧光定量PCR(Real-Time PCR)技术作为一种核酸定量的手段,以其高灵敏性、高特异性、高精确度、实时性和污染少等优点,在微生物生态学中逐渐得到广泛的应用[2]。同时与其他的分子生物学技术的联合应用,不仅可以定性也可以定量研究微生物群落结构组成及数量变化,深入探索微生物群落与环境因子之间的相互作用及其动态变化过程[2]。Real-Time PCR技术在土壤微生物环境监测和研究上的应用始于近年,国外在环境中微生物群落变化的动态监测、微生物群落生理代谢研究和环境微生物群落分布的研究等方面已有了很多的应用[2,4-7],国内在土壤微生物研究领域这项技术的应用方面的报道还比较少。Real-Time PCR标准曲线的标准样品一般是含有与PCR目的片断同源且纯度较高的DNA模板[8-9],但分析土壤环境样品时,特别是目的片断为某些功能基因的时候,很难得到这样的标准品。因此,利用构建克隆子的方法制作土壤样品的标准样品,并对相关参数进行优化,建立土壤样品的实时Real-Time PCR检测体系,为Real-Time PCR这一技术在土壤微生物群落生态学研究中的应用作初步尝试,为后续动态研究土壤微生物群落变化提供依据。
1 材料与方法
1.1 土壤样品
共采集3个土壤样品作为处理,编号P1和P2的两个样品采自大庆市让胡路区代号为分别为中101-X308和中922-X309的两处油井附近,生产时间均不足5 a。样品C采自中国科学院海伦农业生态试验站裸地生态系统土壤,无多环芳烃污染始和农药施用历史。3个土壤样品均为去除表层后5 cm~15 cm深的土壤,pH值分别为9.68、9.02和7.56。
1.2 Real-Time PCR测定总细菌数量
1.2.1土壤微生物基因组总DNA提取。土壤微生物DNA提取采用Bio 101 FastDNA SPIN Kit(Bio 101,Inc.,USA),土壤用量为0.5 g鲜土。用体积分数为1.0 %的琼脂糖凝胶电泳和微量核酸蛋白质分析仪(Nanodrop)检验DNA质量并确定其浓度。
1.2.2普通PCR反应条件和反应体系的优化。优化后的PCR 反应体系和反应程序如下:50 μL体系,buffer 5 μL,dNTP 4 μL,MgCl21.5 μL,BSA 0.3 μL,Taq 0.3 μL,H2O 35.9 μL,引物每条各100 nM,模版DNA 1 μL。16S rDNA片段PCR反应程序为预变性94 ℃ 4 min后,94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min,30个循环。
引物序列:16Sr DNA序列:F27 5′-AGAGTTTGATCMTGGCTCAG-3′,R1492 5′-TACGGYTACCTTGTTACGACTT-3′[10],引物订自上海生物工程公司。
1.2.3Real-Time PCR标准样品的制作。选取1份质量较高的PCR产物,采用DNA凝胶纯化试剂盒纯化扩增后的基因片段,将片断连接在pGEM-T Easy 载体中,然后转化到E.coli.JM109中,涂布到含有氨苄青霉素(Ampicillin)/IPTG/X-Gal的LB(Luria-Bertani)培养基上,37 ℃下培养16 h~24 h。随机挑选2~3个白斑克隆子测序,基因测序工作由上海生物工程公司完成。
将测序结果导入MEGA 4.0软件,经过剪裁处理选取一个插入片段序列完整(两端引物完整)、长度合适(目标长度1 500 bp)的克隆子。利用质粒提取试剂盒提取克隆子的质粒,测定其DNA浓度,并将其以10倍为间隔系列稀释成实时荧光定量PCR测定标准品。
1.2.4样品定量。将样品与标准品一起进行Real-Time PCR检测,包括阴性对照在内每个样品设3个重复。Real-Time PCR反应体系为25 μL,其中包含0.5 μL(约2.5 ng)模板DNA,12.5 μL SYBR Premix Ex Taq(TaKaRa Biotechnology),引物各100 nM,反应在Axygen公司200 μL圆顶PCR管中进行。Real-Time PCR定量扩增仪型号为iQ5(Bio-rad,USA)。16S rDNA片段PCR反应程序为预变性94 ℃ 4 min后,94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min,30个循环。每个循环中荧光收集在83 ℃下进行,以防止由于引物二聚体的存在所引起的误差。 溶解曲线程序为65 ℃~98 ℃,每0.2 ℃读数,其间停留6 s。Real-Time PCR测定控制软件iCycler software(version 1.0.1384.0 CR)。
2 结果与分析
2.1 标准样品的测序结果
经过筛选,最后确定将细菌16S rDNA 序列的C0-B31号克隆子作为制作标准曲线的标准样品,其16S rDNA片段序列长度为1467 bp,符合完整的16S rDNA序列要求。两端划线部分为引物,且序列完整。该序列与NCBI数据库相似序列比对结果表明,其与Actinoplanes sp.SE50/110(CP003170)具有98 %的相似度。
2.2 Real-Time PCR标准曲线测定结果及可信性分析
将10倍浓度梯度的标准样品PCR过程中检测荧光的结果绘制成扩增曲线,见图1。如图所示,各样品平行间所测定的Ct值差异很小,即样品平行间一致度较好试验测定值可信度较高。
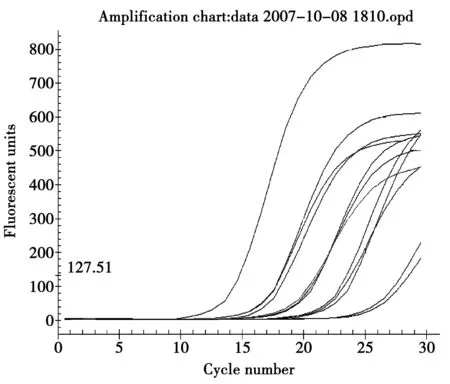
图1 Real-Time PCR扩增曲线Fig.1 Real-Time PCR amplification curve
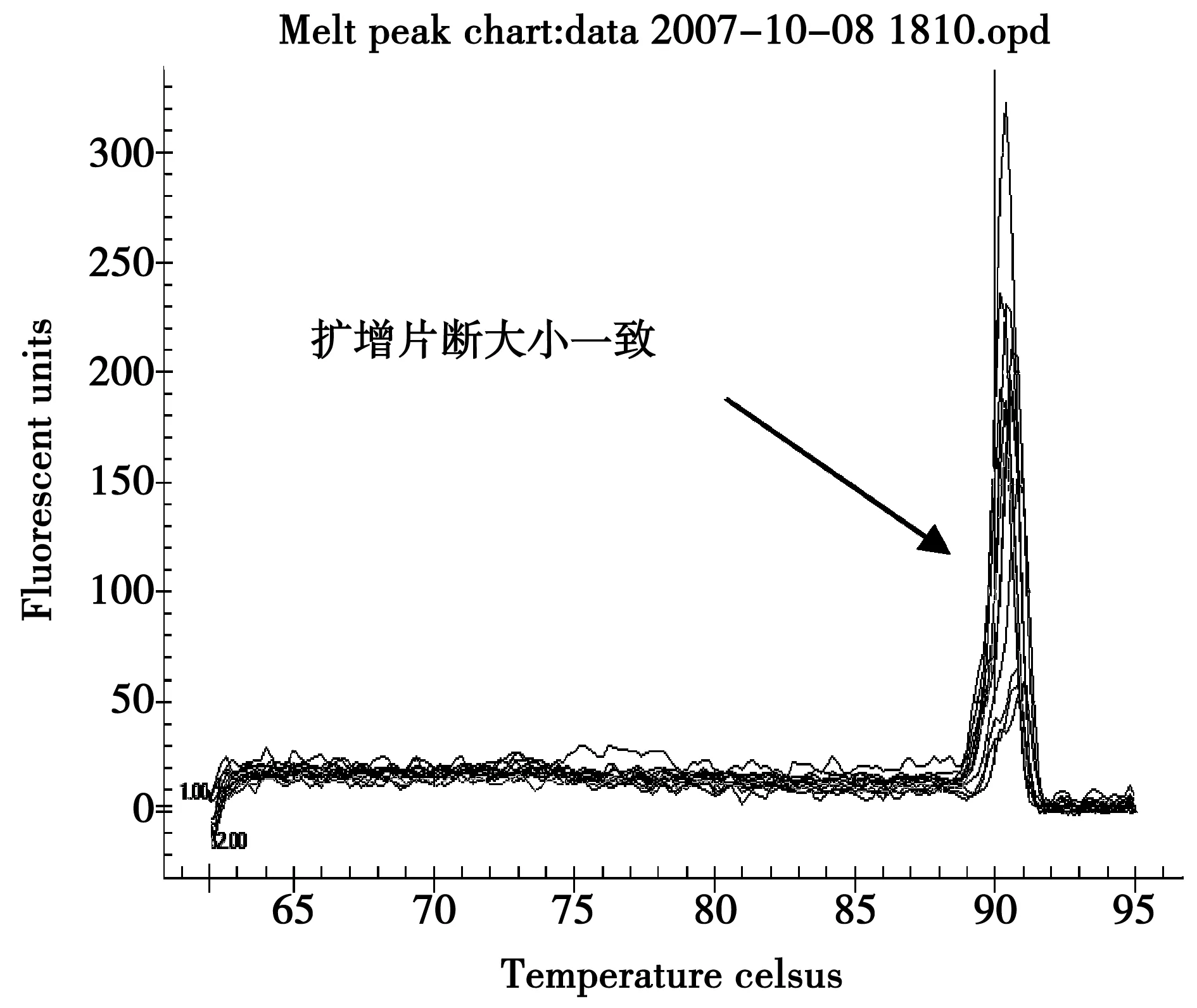
图2 Real-Time PCR溶解曲线Fig.2 Real-Time PCR melting curve
利用10倍浓度梯度的标准样品PCR过程中熔解温度的测定值做熔解曲线,见图2,熔解曲线无杂峰表明扩增片段长度一致无引物二聚体。
分别以10倍浓度梯度的标准样品中DNA模板浓度与Ct值为横纵坐标的标准曲线,见图3。由于Real-Time PCR绝对定量是建立在模板的初始浓度与域值循环数Ct(Cycle threshold)值关系的基础上,因此,为保证样本定量有稳定可重复的试验结果,Real-Time PCR标准曲线参数的优化非常的重要。理论上一条合格的标准曲线具有3个特点:一致的重复反应、高的线性(R2> 0.980)和高的扩增效率(E:90 %~105 %)以及斜率(S≈-3.32)。标准曲线参数符合要求(标准品扩增效率E=101.7 %,R2=0.985,S=-3.28)且重复性好,说明以此标准样品构建的标准曲线是合格的。
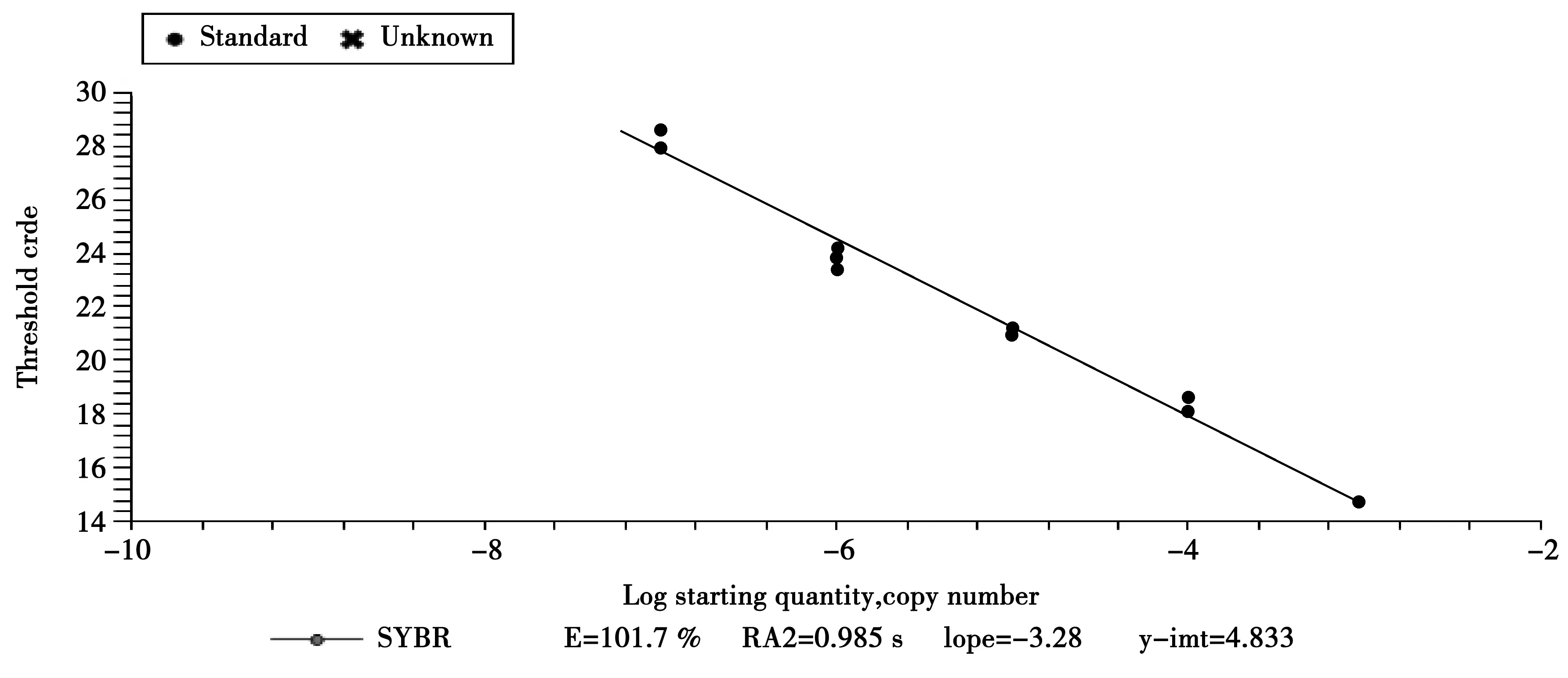
图3 Real-Time PCR标准曲线Fig.3 Real-Time PCR standard curve
2.3 细菌的定量结果
利用Real-Time PCR的方法测定了3个土壤样品中16S rDNA片段的拷贝数,结果显示:编号为C的土壤样品细菌16S rDNA片段拷贝数达到5.0×109个·g-1,高于其它两个处理。编号P2的土壤16S rDNA片段拷贝数为4.0×109个·g-1,编号P1的土壤总细菌的含量最低,16S rDNA片段拷贝数为1.4×109个·g-1。
3 讨 论
传统的平板计数法定量研究土壤微生物的群落数量变化有很大的缺陷,因为在现有技术下可分离培养的微生物只占环境微生物的0.1 %~10 %,平板计数法会大大低估土壤微生物的真实数量。利用Real-Time PCR技术对土壤微生物细胞个体数量进行绝对定量的方法快捷且准确性比较高,不仅可以定量细菌、真菌和放线菌等微生物类群,而且还可以对某些微生物功能基因拷贝数进行定量,从而有目的的对功能微生物进行研究。利用16S rDNA片段PCR克隆库作为标准品制作的标准曲线方法简便且可以重复使用,是制作标准品的好方法。在不同细菌细胞中16S rDNA片段拷贝数一般为每个细胞1~13个,因此如定义平均细胞拷贝数为6.5个,则本研究中C、P1和P2样品的细菌细胞数分别为7.7×108个·g-1、2.2×108个·g-1和6.2×108个·g-1,这一结果要比传统方法得到的结论高1~3个数量级[11]。
反应体系中扩增效率大于100 %的原因有可能是因为反应抑制剂的存在。因为反应样品模板中反应抑制剂的浓度也随稀释度增加而减小,低浓度模板样本中抑制剂的浓度低对反应Ct值的延迟程度较小,导致低浓度样品Ct值比理想情况略高,使标准曲线斜率的绝对值以及由其计算所得的扩增效率会略微增加。由于本试验样本DNA来自于土壤,导致以此为基础制作的标准样品也不可避免地含有微量的PCR反应抑制剂,所以出现反应扩增效率略大于100 %属于正常现象,只要其小于105 %就不会显著影响定量结果。综上所述,本研究建立的实时荧光定量PCR检测体系可以较传统方法更灵敏地定量未知模板的土壤细菌数量。
参考文献:
[1] 夏 月,Khan S,朱永官,等.限制性片段长度多态性分析(ARDRA)方法对重金属污染土壤中细菌群落多样性的研究 [J].环境科学学报,2007,27(6):953-960.
[2] 张 晶,张惠文,张成刚.实时荧光定量PCR及其在微生物生态学中的应用 [J].生态学报,2005,25(6):1445-1450.
[3] 沈菊培,张丽梅,郑袁明,等.土壤宏基因组学技术及其应用 [J].应用生态学报,2007,18(1):212-218.
[4] 张 蓓,沈立松.实时荧光定量PCR的研究进展及其应用 [J].国外医学:临床生物化学与检验学分册,2003,24(6):327-329.
[5] 欧阳松应,杨 冬,欧阳红生,等.实时荧光定量PCR技术及其应用 [J].生命的化学,2004,24(1):74-76.
[6] 李文涛,王俊东,杨利峰,等.实时荧光定量PCR技术及其应用 [J].生物技术通讯,2006,17(1):112-114.
[7] 付春华,陈孝平,余龙江.实时荧光定量PCR的应用和进展 [J].激光生物学报,2005,14(6):466-471.
[8] 罗勇军,刘 昕.实时荧光定量PCR标准品的制备及应用 [J].重庆医学,2005,34(3) :414-415.
[9] 朱永芳.实时荧光聚合酶链反应(PCR)检测技术 [M].北京:中国计量出版社,2003.
[10] Lane D J.16S/23S rRNA sequencing Nucleic Acid Techniques in Bacterial Systematics [M].New York:John Wiley&Sons,1991.
[11] 丁克强,骆永明,刘世亮,等.多环芳烃菲对淹水土壤微生物动态变化的影响 [J].土壤,2002,34(4):229-236.
