α-甘露糖苷酶法测定家兔血清中苦马豆素含量
2012-01-04吴书奇陈根元胡建军马春晖
王 帅,吴书奇,陈根元,胡建军,张 玲,马春晖
(新疆生产建设兵团塔里木畜牧科技重点实验室/塔里木大学动物科学学院,阿拉尔 843300)
苦马豆素(swainsonine,SW)是小花棘豆等疯草的主要有毒成分,严重影响了新疆畜牧业的发展[1-2]。SW有调节动物免疫功能的作用,该作用与SW的浓度密切相关。目前,SW的免疫学研究已成为热点,因此,动物血清中SW含量的测定显得极为重要。目前,国内采用的苦马豆素含量测定方法有薄层色谱扫描法[3]、α-甘露糖苷酶法[4-5]、气相色谱法[6]和高效液相色谱法[7]。薄层色谱扫描法重现性和精确性都较差;气相色谱法前处理繁琐,检测样品易受蒸气压、温度等的限制,而且苦马豆素不易气化,需进行衍生化处理,其应用也受到限制;高效液相色谱法需要的仪器特殊,溶剂系统选择也不成熟,需要进一步研究[5-7]。目前,关于α-甘露糖苷酶法测定家兔血清中SW含量的文献报道较少。α-甘露糖苷酶活性抑制分析属于酶分析法(enzymatic assay)。α-甘露糖苷酶可降解甘露糖苷,而SW与α-甘露糖苷酶的结构相似,能竞争性抑制α-甘露糖苷酶的活性,且随着SW浓度的变化,这种抑制作用的强弱也发生相应变化,可以通过测定甘露糖苷或其分解产物的量间接测定SW的含量。当SW的浓度达到0.5μg/mL以上时就对α-甘露糖苷酶表现出抑制作用,且该抑制作用与溶液pH密切相关[4-5]。本试验旨在建立快速、准确、灵敏的SW含量测定方法,为测定试验动物血清、组织、排泄物、胃肠内容物等中SW的含量提供参考。
1 材料与方法
1.1 材料、试剂与仪器 小花棘豆样品于2010年8月采自新疆克州阿合奇县色帕巴依乡(40°59′2′′N,78°42′28′′E),采集时正值结实期,标本由塔里木大学动物科学学院草业科学学科组鉴定。
试验动物:家兔8只,雌雄各半(雌兔的编号为1、3、5、7,雄兔的编号为 2、4、6、8)。体重(2.0±0.1)kg/只,购于塔里木大学动物科学学院试验基地。每只家兔以10 g/(d·kg)饲喂小花棘豆。试验开始后每隔7 d采集血液一次,并分离血清,-20℃保存。共采血5次。
试剂:苦马豆素(SW)标准品,SIGMA;α-甘露糖苷酶、对硝基苯基-α-D-甘露糖苷,美国SUPELCO;其它试剂如氢氧化钠、柠檬酸等均为国产分析纯。
仪器:PowerWave XS型全波长酶标仪,美国;MR231型高速冷冻离心机,法国Jouan;Direct-Q3型超纯水系统,美国Millipore;BCD-223GB型冰箱,广东科龙电器;FA/4A型电子天平,上海精密电子仪器有限公司。
1.2 方法
1.2.1 技术路线 试验反应器皿为96孔酶标板。向酶标板每孔中依次加入反应缓冲溶液50 μL、0.025 u/mL α-甘露糖苷酶溶液 50 μL、待测样品液 50 μL,混匀后37℃孵育15 min;然后加入底物(20 mmol/L对硝基苯基-α-D-甘露糖苷溶液)50 μL,混匀后 37℃孵育 90 min;孵育结束后加入反应终止液(pH 9.8的硼酸钠缓冲溶液)100μL,立即使用酶标仪测吸光度值。测定波长405 nm[5]。
1.2.2 试验条件的选择 于酶标板第1行的各孔中加入pH 2.5的反应缓冲溶液50 μL,第2行的其余各孔中加入 pH 3.0 的反应缓冲溶液 50 μL;第 3、4、5、6、7、8 行各加入 pH 值为 3.5、4.0、4.5、5.0、5.5、6.0 的反应缓冲溶液50 μL;然后第1列和第2列不添加SW标准品溶液,第3列和第4列加入浓度为10-5mol/L的SW标准品溶液50 μL,第5列和第6列加入浓度为10-6mol/L的SW标准品溶液50 μL,依此类推,最后向第11列和12列加入浓度为10-9mol/L的SW标准品溶液50 μL[5];最后各孔中加入0.025 u/mL α-甘露糖苷酶溶液50 μL,混匀后立即37℃孵育15 min;然后加入底物(20 mmol/L对硝基苯基-α-D-甘露糖苷溶液)50 μL,混匀后37℃孵育90 min;孵育结束后加入反应终止液(pH 9.8的硼酸钠缓冲溶液)100 μL,立即使用酶标仪测吸光度值。测定波长405 nm。以第1列和第2列的平均值作为100%α-甘露糖苷酶活性,计算不同SW浓度下α-甘露糖苷酶活性变化。筛选吸光度值变化呈线性相关的条件为样品测定方法。
1.2.3 苦马豆素标准曲线的绘制 准确配制1.73(10-6mol/L)、0.865(5×10-7mol/L)、0.433(2.5×10-7mol/L)、0.217(1.25×10-7mol/L)、0.109 mg/mL(6.25×10-8mol/L)5 个质量浓度梯度的SW标准溶液。每个浓度梯度做8孔。以SW浓度Y对其吸光度X进行回归分析。
1.2.4 加标回收试验 精密量取0.865 mg/mL SW标准溶液50 μL于96孔酶标板中,然后加入50 μL 1.73 mg/mL SW标准溶液,测定吸光度值,共做8孔。
1.2.5 血清样品的测定 每个血清样品做8孔,以未采食小花棘豆的正常兔血清作为阴性对照,计算血清中SW含量。
1.3 数据分析 数据采用EXCEL 2007进行处理,用SPSS 11.5中One-Way ANOVA进行单因素方差分析。
2 结果与分析
2.1 试验条件的确定 当反应缓冲液的pH值为4.5时不同浓度SW溶液反应光度值变化线性相关度最好。根据图1所示,随着SW浓度的升高,α-甘露糖苷酶的活性逐渐降低。当SW的浓度在10-9~10-5mol/L范围内时,α-甘露糖苷酶的活性呈“S”形;当SW浓度不低于10-8mol/L时,对α-甘露糖苷酶的抑制作用明显增强;当SW浓度高于10-6mol/L时,α-甘露糖苷酶的活性全部被抑制。根据SW浓度与与其抑制的AMA活性百分比做线性回归,结果SW浓度在10-8~10-6mol/L时SW浓度与其抑制的α-甘露糖苷酶活性呈线性关系。
2.2 苦马豆素标准曲线的制作 以SW浓度Y对其吸光度X(见表1)进行回归分析,得回归方程:Y=-0.012X+0.034,R2=0.999(图 2),表明 SW 浓度在 0.109~1.73 mg/mL范围内线性关系良好。根据8次重复测定的RSD值,α-甘露糖苷酶法测定苦马豆素含量的精密度较好。
2.3 加标回收试验结果 待测样中SW质量0.140 7 mg,理论值0.139 8 mg,平均回收率100.64%,RSD=2.743%。结果见表2。

图1 SW抑制α-甘露糖苷酶剂量范围的测定结果
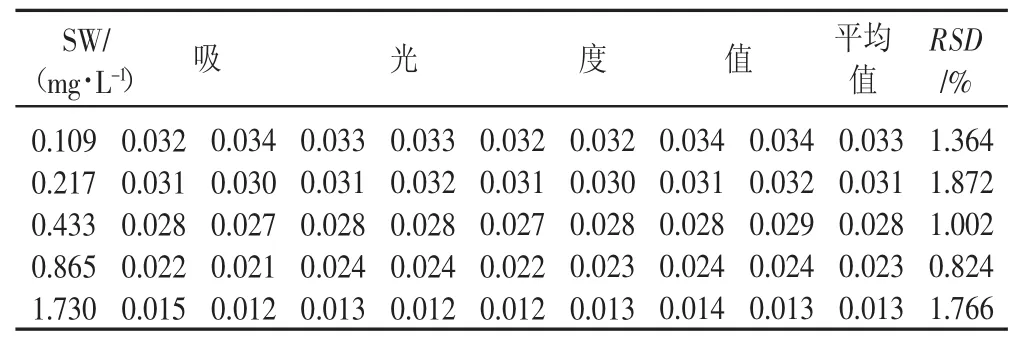
表1 苦马豆素标准曲线测定结果

图2 苦马豆素标准曲线

表2 加标回收试验结果
2.4 样品中SW的含量 试验家兔血清中SW的含量结果见表3。7 d时试验兔的血清SW含量差异明显。这可能与兔子的个体差异有关;而且在饲喂小花棘豆的初期,部分试验兔采食情况不佳,也可能导致血清样品中SW含量的差异。随着试验的进行,同种性别的试验兔血清SW含量差异趋于不显著,且雄性试验兔的数据更为整齐。家兔血清中SW的含量随着饲喂时间的延长呈现由低到高的趋势,由此说明α-甘露糖苷酶法测定家兔血清中SW含量的方法能够满足试验研究。另外,雌性试验兔血清SW含量一直显著高于雄性试验兔,说明雌性家兔较雄性家兔易发生小花棘豆中毒。这与沈明华等[8]报道的雌性家兔甘肃棘豆中毒症状的出现时间早于雄性家兔的研究结果一致。
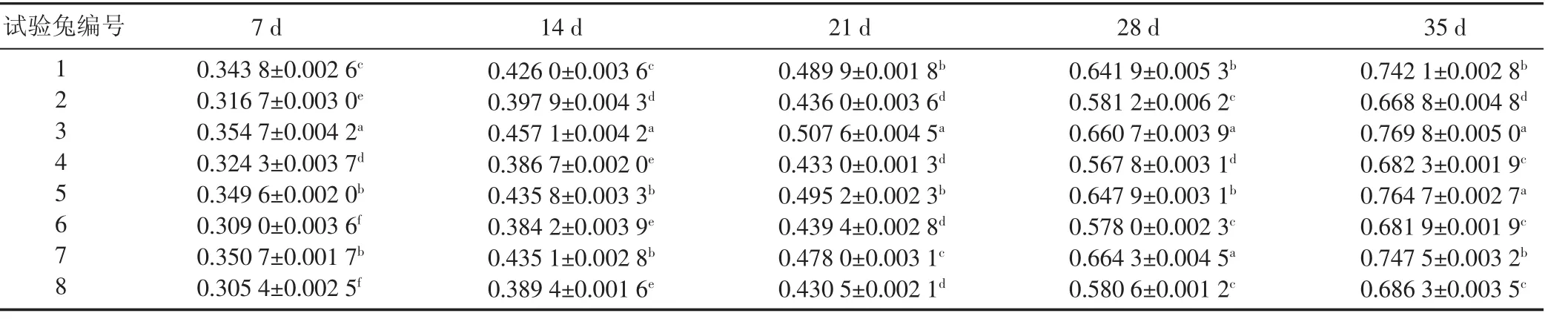
表3 样品中苦马豆素含量 mg/L
3 讨论
3.1 不同方法测定血清SW含量的比较 目前国内外所采用的方法主要有薄层扫描法、气相色谱法、高效液相色谱分析法和酶法测定等。薄层扫描法简单快捷,易于操作,但用于定量分析时误差较大[3]。高效液相色谱分析的检测器检测的是样品中的发色基团,需要将苦马豆素衍生化,而且高效液相色谱分析所需仪器较复杂,成本较高,不利于推广[5,7]。目前SW定量测定应用最多的是气相色谱法,该方法具有检出率高,检测速度快,可实时监测SW合成过程,适用于精确分析样品中苦马豆素含量;但SW不易气化,高温下易发生脱水从而导致结构改变,故检测时需制备易升华且稳定的SW衍生物,而且对血清样品的前处理极为繁琐[6],所以目前SW的气相色谱分析更多的应用于植物样品分析中。α-甘露糖苷酶活性抑制分析法多用于血清中SW的定性定量分析[9-10],由于血液中各种有机物质和无机离子较多,采用色谱法很难分离完全,定量分析就更为困难;而酶分析法不需要对样品进行分离,也不需要复杂的仪器,简单而适用,同时可跟踪分析血清中SW的含量。而且酶分析法灵敏度高,适用于血清、乳制品等样品中SW含量的微量分析。
3.2 α-甘露糖苷酶法测定SW含量的影响因素 Dorling等[11]研究发现SW在pH 4.0左右时对刀豆属α-甘露糖苷酶表现出抑制作用。Kim等[12]利用酶分析法绘制出了刀豆属α-甘露糖苷酶活性与SW浓度变化的标准曲线图。Scaman等[13]报道了一种简单且通用的分光光度分析法测定α-甘露糖苷酶的活性,可用于天然底物或人工合成底物。这些为α-甘露糖苷酶活性抑制分析法测定SW含量提供了基础。Taylor等[4]以此发展了一种定性定量分析血清、乳中SW含量的方法。将样品置于微孔板中并加入柠檬酸盐缓冲液和α-甘露糖苷酶于37℃下孵育,以对硝基苯基-α-D-甘露糖苷作为底物,反应完全后,采用分光光度法测定产物的光密度以间接评价样品中的SW含量。α-甘露糖苷酶活性抑制分析法的灵敏度直接依赖于SW对α-甘露糖苷酶活性抑制程度,如果SW浓度过低,对α-甘露糖苷酶活性抑制作用就不明显,使用酶分析法就无从谈起。本试验发现当苦马豆素浓度在10-9~10-6mol/L范围内,反应pH值为4.5时,α-甘露糖苷酶分析法具有较好的准确性,与孔祥雅等[5]的研究结果较为一致。
4 结论
本试验采用α-甘露糖苷酶法测定血清中SW的含量。数据表明,α-甘露糖苷酶法具有回收率和准确度高、精密度好、灵敏可靠、操作简便快速、特异性好等优点,可作为血清SW的微量定量检测方法。
[1]王帅.新疆小花棘豆中苦马豆素的提取方法研究[D].阿拉尔:塔里木大学硕士学位论文,2010.
[2]高木木.新疆棘豆属植物研究[D].石河子:石河子大学硕士学位论文,2008.
[3]童德文,曹光荣,耿果霞,等.薄层扫描测定5种疯草中苦马豆素含量[J].中国兽医学报,2003,23(2):183-185.
[4]Taylor J B,Strickland J R.Appearance and disappearance of swainsonine in serum and milk of lactating ruminants with nursing young following a single dose exposure to swainsonine(locoweed;Oxytropis sericea)[J].American Society of Animal Science,2002,80:2476-2484.
[5]孔祥雅,荆心堂,张丽慧,等.苦马豆素抑制α-甘露糖苷酶的剂量效应关系[J].动物医学进展,2011,32(1):43-46.
[6]宋毓民,王建华,王爱华,等.家兔血清中苦马豆素的气相色谱测定方法[J].中国兽医学报,2010,30(3):402-405.
[7]段秋燕,黄新异,柳军玺,等.HPLC法测定小鼠血浆中苦马豆素浓度及药动学研究[J].药物分析杂志,2010(4):25-28.
[8]沈明华,莫重辉,赵宝玉,等.家兔实验性甘肃棘豆中毒的临床症状和病理形态学观察[J].动物医学进展,2010,31(1):44-49.
[9]Stegelmeier B L,James L F,Panter K E,et al.Tissue swainsonine clearance in sheep chronically poisoned with locoweed(Oxytropis sericea)[J].Animal Science,1998,76(4):1140-1144.
[10]Panter K E,James L F,Stegelmeier B L,et al.Locoweeds:effects on reproduction in livestock[J].Nat Toxins,1999,8(1):53-62.
[11]Dorling P R,Huxtable C R,Colegate S M.Inhibition of lysosomalαmannosidase by swainsonine,an indolizidine alkaloid isolated from Swainsona canescens[J].Biochem J,1980,191:649-651.
[12]Kim Lan Sim,Perry D.Swainsonine production by Metarhizium anisopliae determined by means of an enzymatic assay[J].Mycological research,1995,99(9):1078-1082.
[13]Scaman C H,Lipari F,Herscovics A,et al.A spectrophotometric assay for α-mannosidase activity[J].Glycobiology,1996,6(3):265-270.
