NaCl胁迫对马蔺生长及生理生化指标的影响
2011-12-31张明轩黄苏珍绳仁立原海燕
张明轩,黄苏珍,绳仁立,原海燕
〔江苏省·中国科学院植物研究所(南京中山植物园),江苏 南京 210014〕
盐碱土是一种广泛分布的土壤类型,在全球五大洲及大多数岛屿的滨海地带和干旱、半干旱地带都有分布。全世界盐碱地总面积约为9.55×108hm2,占地球陆地总面积的7.26%;中国盐碱地总面积约为9.913×107hm2,主要分布在东北、华北、西北内陆地区以及长江以北沿海地带[1]。目前,盐碱胁迫是人类面临的生态危机之一,给农业生产造成的损失仅次于干旱,而粮食安全问题是人类正面临的前所未有的挑战,因此人类必须尽可能地利用各种土地资源,包括面积较大的盐碱土地。然而,一般植物(作物)对盐碱胁迫的适应能力有限,因此提高农作物和经济作物的抗(耐)盐能力及利用耐盐碱植物改良盐碱土地是迫切需要解决的问题之一。近年来,人们对植物的耐盐性进行了大量的研究,在盐碱胁迫对植物的伤害机制、植物对盐碱胁迫的适应性反应和如何提高植物的耐盐性等方面取得了一定的成果[2-3]。
马蔺〔Iris lactea Pall.var.chinensis(Fisch.) Koidz.〕也称马莲(花、草)、马兰(花)、紫蓝草、兰花草等,是鸢尾科(Iridaceae)鸢尾属(Iris L.)多年生宿根草本植物,广泛分布于中国的东北、华北和西北等地[4-5]。马蔺不仅分布范围广、生态类型丰富,而且是鸢尾科中观赏价值最高的种类之一[6]。该种植物不仅抗性强、适应性广、生物量较大,且对多种重金属胁迫均具有较好的抗性。近几年来,国内学者对马蔺的部分生物学特性、栽培技术和耐重金属胁迫能力等进行了研究[7-8],但对马蔺耐盐胁迫方面的研究报道较少。
作者采用水培法研究了NaCl胁迫对马蔺部分生长及生理生化指标的影响,以期探讨NaCl胁迫对马蔺的毒害机制及其耐盐机制,为进一步开展耐盐碱植物种质资源的研究及利用耐盐碱植物对盐碱地进行生态修复奠定实验基础。
1 材料和方法
1.1 实验材料
实验用马蔺种子为引种自中国黑龙江并栽培于江苏省·中国科学院植物研究所鸢尾种质圃6 a以上的无性繁殖群体自然结实的籽实。用自来水浸泡种子,发芽后播种于盛满石英砂的苗盘中,每天用1/4 Hoagland营养液浇灌2次(营养液浇灌量视石英砂干湿程度而定)。待苗高约10 cm时取出幼苗,用去离子水冲洗干净后,选取长势一致的幼苗用于NaCl胁迫处理。
1.2 实验方法
1.2.1 NaCl胁迫的处理方法 实验于2009年8月至10月在南京中山植物园普通温室内进行。将供试幼苗用海绵条和1 cm厚的泡沫板固定在5 L的塑料周转箱中,用1/2Hoagland营养液预培养7 d后,加入固体NaCl,使培养液中NaCl的最终质量浓度分别为0(CK)、1、2、3、4、6、8和10 g·L-1。每处理30株幼苗,各3次重复。实验过程中,每4天更换1次含相应质量浓度NaCl的1/2Hoagland营养液,共胁迫处理30 d。分别于NaCl胁迫处理的7、14、21及28 d取样测定各生理生化指标,并于胁迫处理结束时(30 d)取样测定各生长指标。
1.2.2 生长及生理生化指标的测定方法 用直尺直接测量每株幼苗的株高和根长,结果取平均值。将幼苗用自来水冲洗干净,吸水纸吸干表面水分,用剪刀将地上部分和根系分开,分别置于105℃杀青2 h,然后于60℃烘干至恒质量后称量,记录马蔺植株的地上部分和根系的干质量,并计算全株干质量。
各处理组均随机选取幼苗若干株,迅速用去离子水冲洗干净后用吸水纸吸干表面水分,分别称取叶片0.5 g用于测定各生理生化指标。参照文献[9]的方法测定叶绿素含量;参照文献[10]的方法测定丙二醛(MDA)含量;参照文献[11]的方法测定脯氨酸含量;参照文献[12]的电导仪法测定细胞膜相对透性(即相对电导率);参照文献[13]的方法测定可溶性蛋白质含量;参照文献[14]的方法测定超氧化物歧化酶(SOD)的活性。各指标均重复测量3次,结果取平均值。
1.3 数据处理
采用Excel 2010和SPSS 10.0软件对实验数据进行统计和处理。
2 结果和分析
2.1 NaCl胁迫对马蔺生长指标的影响
不同质量浓度NaCl胁迫对马蔺幼苗生长指标的影响见表1。由表1可以看出,较低质量浓度的NaCl胁迫对马蔺的生长有一定的促进作用,而较高质量浓度的NaCl胁迫则表现出抑制作用。1和2 g·L-1NaCl胁迫条件下马蔺幼苗株高和地上部分干质量基本上较对照显著增加(P<0.05),株高分别为对照的1.124和1.045倍,地上部分干质量分别为对照的1.151和1.070倍;其中,1 g·L-1NaCl处理组马蔺幼苗的株高和地上部分干质量最大,这一结果与郭建华等[15]对小麦(Triticum aestivum L.)的研究结果一致。质量浓度3~10 g·L-1的NaCl胁迫对马蔺幼苗株高和地上部分生长有抑制作用,随NaCl质量浓度的提高,马蔺幼苗的株高和地上部分干质量均呈持续下降的趋势,且4~10 g·L-1NaCl胁迫处理组的株高和地上部分干质量显著低于对照(P<0.05)。在3、4、6、8和10 g·L-1NaCl胁迫条件下,马蔺幼苗的株高分别为对照的92.6%、81.7%、79.7%、77.2%和 68.8%,地上部分干质量分别为对照的 97.7%、86.6%、75.0%、68.6%和53.5%。
表1结果还显示,随NaCl质量浓度的提高,马蔺幼苗根系生长受到明显抑制,根长和根干质量不断下降。在NaCl质量浓度相对较高的条件下,马蔺的根长和根干质量均显著低于对照(P<0.05);在6、8和10 g·L-1NaCl胁迫条件下,马蔺根长分别为对照的65.9%、54.9%和50.0%,根干质量分别为对照的56.8%、50.6%和43.2%,降幅均大于株高和地上部分干质量。根系是植物暴露于盐碱环境中的首要组织[16],由于NaCl处理液直接作用于根系,因而根系受到的抑制作用大于地上部分。
由表1还可见,在1 g·L-1NaCl胁迫条件下,马蔺的全株干质量最大且显著高于对照(P<0.05),为对照的1.087倍,说明低质量浓度NaCl对马蔺生长有一定的促进作用。随NaCl质量浓度的继续提高,马蔺全株干质量呈逐渐下降趋势且均低于对照;高质量浓度NaCl导致根系损伤加重,同时影响地上部分生物量的合成和积累。据此推断,NaCl胁迫对马蔺幼苗的伤害可能是通过限制根系的伸长生长以影响对矿质养分的吸收,从而对马蔺全株的生长产生影响。
表1 不同质量浓度NaCl胁迫对马蔺幼苗生长指标的影响(±SD)1)Table 1 Effect of NaCl stresswith different concentrations on grow th indexes of Iris lactea Pall.var.chinensis(Fisch.)Koidz.seedling(± SD)1)
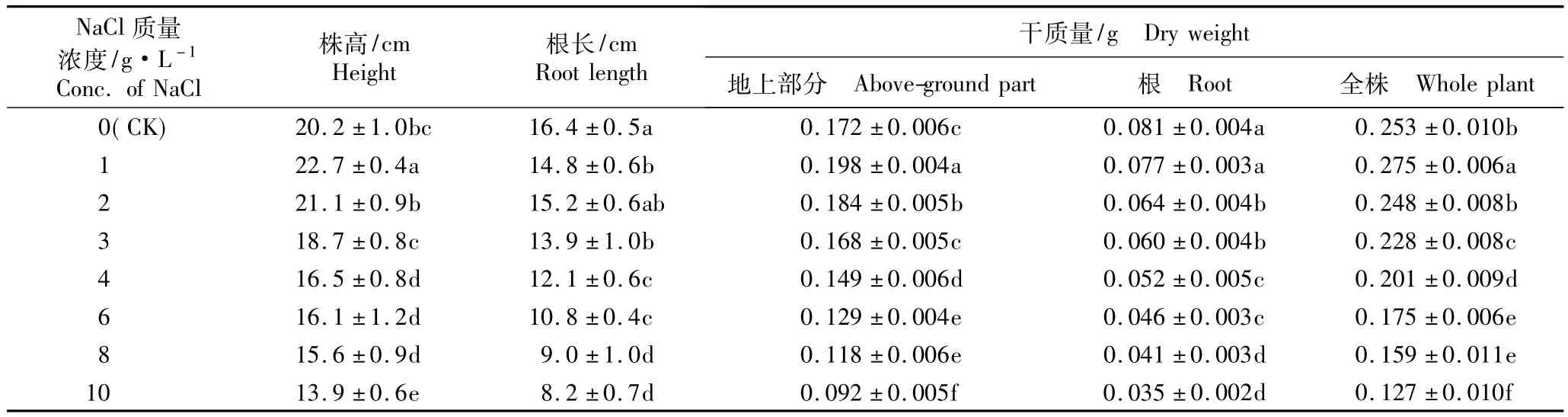
表1 不同质量浓度NaCl胁迫对马蔺幼苗生长指标的影响(±SD)1)Table 1 Effect of NaCl stresswith different concentrations on grow th indexes of Iris lactea Pall.var.chinensis(Fisch.)Koidz.seedling(± SD)1)
1)同列中不同的小写字母表示差异显著(P<0.05)Different small letters in the same column indicate the significant difference(P<0.05).
NaCl质量浓度/g·L-1 Conc.of NaCl株高/cm Height 根长/cmRoot length干质量/g Dry weight地上部分 Above-ground part 根 Root 全株Whole plant 0(CK)20.2±1.0bc 16.4±0.5a 0.172±0.006c 0.081±0.004a 0.253±0.010b 1 22.7±0.4a 14.8±0.6b 0.198±0.004a 0.077±0.003a 0.275±0.006a 2 21.1±0.9b 15.2±0.6ab 0.184±0.005b 0.064±0.004b 0.248±0.008b 3 18.7±0.8c 13.9±1.0b 0.168±0.005c 0.060±0.004b 0.228±0.008c 4 16.5±0.8d 12.1±0.6c 0.149±0.006d 0.052±0.005c 0.201±0.009d 6 16.1±1.2d 10.8±0.4c 0.129±0.004e 0.046±0.003c 0.175±0.006e 8 15.6±0.9d 9.0±1.0d 0.118±0.006e 0.041±0.003d 0.159±0.011e 10 13.9±0.6e 8.2±0.7d 0.092±0.005 f 0.035±0.002d 0.127±0.010f
2.2 NaCl胁迫对马蔺生理生化指标的影响
2.2.1 对叶绿素含量的影响 不同质量浓度NaCl胁迫对马蔺幼苗叶片叶绿素含量的影响见表2。由表2可见,在不同质量浓度NaCl胁迫条件下,各处理组马蔺叶片叶绿素含量均随胁迫时间的延长而呈先升高后下降的变化趋势,最大值出现在胁迫的第21天;但在胁迫处理的第28天,尽管各处理组马蔺叶片叶绿素含量有所降低,但降低幅度不大。在NaCl质量浓度较低的条件下,马蔺叶片叶绿素含量随NaCl质量浓度提高呈增加的趋势,在3和4 g·L-1NaCl胁迫处理条件下达到最大值,且显著高于对照(P<0.05);而在NaCl质量浓度较高的条件下,叶绿素含量随NaCl质量浓度的提高呈现逐渐降低的趋势。
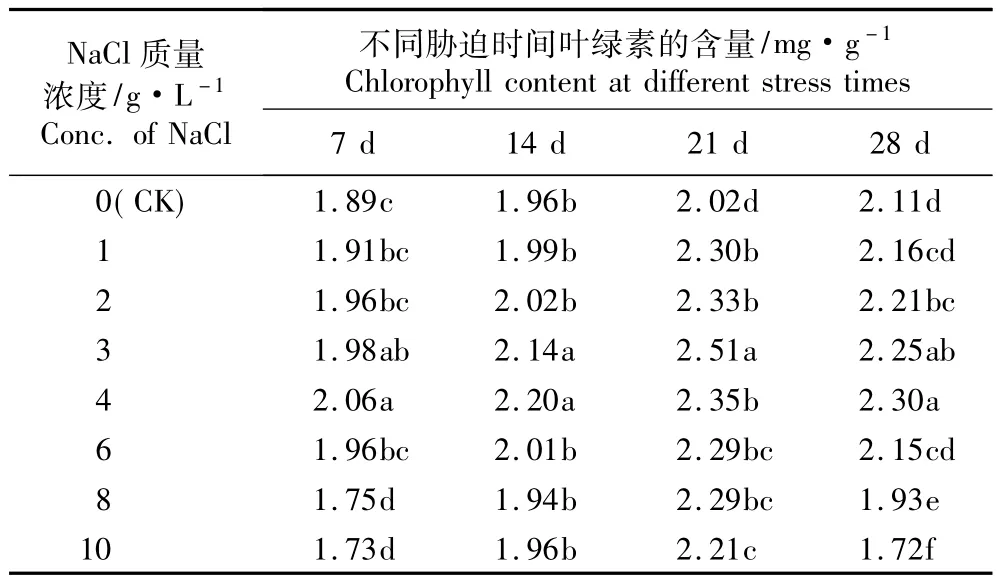
表2 不同质量浓度NaCl胁迫对马蔺幼苗叶片叶绿素含量的影响1) Table 2 Effect of NaCl stress w ith different concentrations on chlorophyll content in leaf of Iris lactea Pall.var.chinensis(Fisch.) Koidz.seedling1)
2.2.2 对叶片相对电导率的影响 不同质量浓度NaCl胁迫对马蔺幼苗叶片细胞相对电导率的影响见表3。由表3可见,随NaCl胁迫浓度的提高和处理时间的延长,马蔺幼苗叶片细胞的相对电导率总体上呈增加趋势并均高于对照,说明NaCl胁迫处理对细胞膜造成伤害,改变了细胞膜的结构,破坏了细胞膜的正常生理功能,反映在生理指标上则为相对电导率增加。其中,1、2、3和4 g·L-1NaCl胁迫处理7或14 d,相对电导率有小幅增加但与对照差异不显著;而10 g·L-1NaCl胁迫处理7 d或6、8和10 g·L-1NaCl胁迫处理14 d,相对电导率显著高于对照(P<0.05)。随着胁迫时间的延长(21和28 d),叶片细胞膜受伤害的程度加剧,与对照相比,各胁迫处理组的相对电导率均显著增加。用10 g·L-1NaCl胁迫处理28 d,马蔺幼苗叶片细胞膜受伤害的程度最大,相对电导率为对照的2.39倍。
以上实验结果说明,在较低质量浓度NaCl胁迫条件下,马蔺叶片细胞膜受伤害的程度不大,而较高质量浓度NaCl胁迫对叶片细胞膜造成了较大程度的破坏;在胁迫初期对细胞膜的伤害程度较小,但随胁迫时间的延长,对细胞膜的伤害程度加剧。

表3 不同质量浓度NaCl胁迫对马蔺幼苗叶片相对电导率的影响1) Table 3 Effect of NaCl stressw ith different concentrations on relative conductivity in leaf of Iris lactea Pall.var.chinensis(Fisch.)Koidz.seed ling1)
2.2.3 对脯氨酸含量的影响 不同质量浓度NaCl胁迫对马蔺幼苗叶片脯氨酸含量的影响见表4。由表4可见,用1或2 g·L-1NaCl胁迫处理7 d,马蔺幼苗叶片脯氨酸含量略低于对照但差异不显著;除此之外,各处理组和不同的处理时间马蔺幼苗叶片的脯氨酸含量均高于对照,仅差异幅度不同。随处理时间的延长,各胁迫处理组马蔺叶片脯氨酸含量呈先增加后下降的趋势,最高值出现在胁迫处理的第14天或第21天;而随NaCl胁迫浓度的提高,在同一处理时间,马蔺叶片的脯氨酸含量表现出逐渐增加的趋势。用10 g·L-1NaCl胁迫处理7、14、21和28 d,脯氨酸含量均最高,分别为对照的1.522、2.007、2.931和2.574倍,显著高于其他处理组和对照组。
以上结果表明:在较高质量浓度NaCl胁迫条件下马蔺体内能够积累大量的脯氨酸,而在较低质量浓度NaCl胁迫条件下脯氨酸积累不明显;随胁迫时间的延长脯氨酸含量呈现先增加后减小的变化趋势,说明经过一段时间的胁迫处理后,马蔺对NaCl胁迫具有了一定的适应性。

表4 不同质量浓度NaCl胁迫对马蔺幼苗叶片脯氨酸含量的影响1) Table 4 Effect of NaCl stressw ith different concentrations on proline content in leaf of Iris lactea Pall.var.chinensis(Fisch.)Koidz.seed ling1)
2.2.4 对丙二醛(MDA)含量的影响 不同质量浓度NaCl胁迫条件下马蔺幼苗叶片的丙二醛(MDA)含量见表5。由表5可以看出,马蔺叶片MDA含量基本上随NaCl质量浓度的提高和处理时间的延长而增加。用质量浓度1~8 g·L-1NaCl胁迫处理7 d,MDA含量与对照差异不显著;而用质量浓度10 g·L-1NaCl胁迫处理28 d,MDA含量大幅增加,为对照的1.860倍,显著高于对照。
以上实验结果说明,马蔺幼苗体内细胞膜脂质过氧化的程度受到NaCl胁迫浓度和胁迫时间的双重影响,NaCl胁迫浓度越高、胁迫时间越长,MDA含量越高,即细胞膜脂质过氧化的程度越高,植株受到的伤害也越大。

表5 不同质量浓度NaCl胁迫对马蔺幼苗叶片丙二醛(MDA)含量的影响1)Table 5 Effect of NaCl stress with different concentrations on MDA content in leaf of Iris lactea Pall.var.chinensis(Fisch.)Koidz.seed ling1)
2.2.5 对可溶性蛋白质含量的影响 不同质量浓度NaCl胁迫对马蔺幼苗叶片可溶性蛋白质含量的影响见表6。用1~10 g·L-1NaCl胁迫处理7或14 d,各处理组马蔺幼苗叶片的可溶性蛋白质含量略低于对照或与对照持平。用1~6 g·L-1NaCl胁迫处理21 d,马蔺幼苗叶片的可溶性蛋白质含量均高于对照,其中3 g·L-1NaCl处理组最高,达到4.28 mg·g-1;用8~10 g·L-1NaCl胁迫处理21 d,叶片的可溶性蛋白质含量均低于对照,且随着NaCl质量浓度的提高不断减小。胁迫处理28 d,各处理组的可溶性蛋白质含量均低于对照,并随NaCl质量浓度的提高不断减小,其中,用10 g·L-1NaCl胁迫处理28 d,叶片的可溶性蛋白质含量最低,仅为对照的80.9%。
以上结果说明,较低质量浓度和短时间的NaCl处理对马蔺叶片可溶性蛋白质合成和积累的影响不大,甚至略有促进作用;只有在NaCl胁迫浓度和胁迫时间达到一定程度后(8~10 g·L-1NaCl胁迫21 d或3~10 g·L-1NaCl胁迫28 d),马蔺幼苗叶片的可溶性蛋白质的合成及积累才受到明显的抑制,表明马蔺对NaCl胁迫具有一定的耐受性。

表6 不同质量浓度NaCl胁迫对马蔺幼苗叶片可溶性蛋白质含量的影响1)Table 6 Effect of NaCl stressw ith different concentrations on soluble protein content in leaf of Iris lactea Pall.var.chinensis(Fisch.) Koidz.seedling1)
2.2.6 对超氧化物歧化酶(SOD)活性的影响 不同质量浓度NaCl胁迫对马蔺幼苗叶片SOD活性的影响见表7。由表7可见,随NaCl质量浓度的提高,马蔺幼苗叶片的SOD活性呈上升的趋势;除用1 g·L-1NaCl胁迫处理28 d后SOD活性略低于对照外,其他各处理组不同胁迫时间的SOD活性均高于对照,其中在10 g·L-1NaCl胁迫条件下SOD活性均最高。
随胁迫时间的延长,马蔺幼苗叶片的SOD活性呈先升后降的趋势,在胁迫处理的第14天达到最高;其中用10 g·L-1NaCl胁迫处理14 d,SOD活性达到峰值,为对照的3.262倍。之后,叶片SOD活性逐渐降低,表明随胁迫时间的延长,马蔺体内的抗氧化酶防御系统可能受到一定程度的破坏。

表7 不同质量浓度NaCl胁迫对马蔺幼苗叶片SOD活性的影响1)Table 7 Effect of NaCl stress w ith different concentrations on SOD activity in leaf of Iris lactea Pall.var.chinensis(Fisch.)Koidz.seed ling1)
3 讨 论
植物耐盐性是一个受多基因控制的极为复杂的生理过程,不同植物的耐盐机制不尽相同。在盐胁迫条件下,植物体内的许多生理代谢过程发生紊乱,表现为生长受到明显抑制,抑制作用的程度既取决于盐胁迫水平,又取决于植物的抗盐能力和盐胁迫的时间[17]。因此,本研究从胁迫水平和胁迫时间2个方面探讨马蔺的耐盐能力。
生物量是植物对盐胁迫反应的综合体现,也是体现植物耐盐性的直接指标之一[18]。本实验结果表明:在较高质量浓度(4~10 g·L-1)的NaCl胁迫条件下,马蔺植株地上部分的生长受到明显抑制,这与甜菊(Stevia rebaudiana Bertoni)、甘草(Glycyrrhiza uralensis Fisch.)、莴苣(Lactuca sativa L.)和海滨锦葵〔Kostelezkya virginica(L.)Presl〕等植物在不同盐胁迫条件下的生长状况相一致[19-22]。然而,较低质量浓度(1~3 g·L-1)NaCl胁迫对马蔺植株地上部分的生长有一定的促进作用,表现在株高和地上部分干质量及全株干质量均略有升高。NaCl胁迫对马蔺根长和根干质量均有明显的抑制作用并随NaCl质量浓度提高不断减小,这可能与根系直接暴露于盐胁迫环境中并直接受到盐胁迫的伤害有关。
叶绿素含量的高低能够反映出植物在盐胁迫条件下光合作用能力的强弱,常与其他指标共同作为植物抗盐性能力的判断依据[23]。总体来说,马蔺幼苗叶片叶绿素含量随着NaCl胁迫时间的延长和质量浓度的提高表现出先升后降的趋势,表明低质量浓度和短时间的NaCl胁迫可使马蔺叶片叶绿素含量增加,可能的原因是:一方面低质量浓度和短时间的NaCl胁迫对叶绿素的合成有一定的促进作用;另一方面NaCl胁迫使马蔺叶片失水,导致叶片中的水分含量下降,间接表现为叶绿素含量的增加。随着NaCl胁迫浓度提高和胁迫时间延长,特别是在NaCl胁迫浓度相对较高的条件下,马蔺叶片的叶绿素合成受到抑制,且这种抑制作用的强度呈逐渐加强的趋势。
在低浓度和短时间NaCl胁迫条件下,马蔺叶片的可溶性蛋白质含量略低于对照或与对照持平,而高浓度及较长时间的NaCl胁迫可导致马蔺叶片可溶性蛋白质含量明显下降。结合NaCl胁迫条件下马蔺幼苗株高、地上部分干质量、全株干质量和叶绿素含量的变化,初步认为低质量浓度和短时间的NaCl胁迫对马蔺幼苗有“刺激生长”的作用,其作用机制有待进一步研究。
为了抵抗逆境造成的伤害,植物通过盐胁迫应答基因的作用产生渗透调节物质脯氨酸,以维持细胞正常的渗透势。在高质量浓度NaCl胁迫条件下,马蔺幼苗叶片脯氨酸含量迅速积累,特别是在10 g·L-1NaCl条件下,脯氨酸含量达到最高;而随NaCl胁迫时间的延长,脯氨酸含量呈现先升高后下降的趋势。NaCl胁迫条件下马蔺体内脯氨酸含量的这种变化趋势与前人的研究结果是一致的[24]。有研究表明,盐胁迫对植物危害的另一个重要方面是对细胞膜结构和组成的影响[25],丙二醛(MDA)含量和细胞膜透性(即相对电导率)是反映细胞膜脂质过氧化程度强弱和质膜受破坏程度的重要指标。随NaCl胁迫浓度提高和胁迫时间的延长,马蔺叶片的MDA含量和相对电导率总体上不断增高,说明在高质量浓度NaCl长时间胁迫条件下,马蔺的细胞膜系统受到损伤,从而诱发细胞膜的脂质过氧化,这与李明等对甘草的研究结果相似[26]。
超氧化物歧化酶(SOD)是重要的抗氧化酶之一,在受到一定时间和一定质量浓度的NaCl胁迫后,马蔺体内的抗氧化酶系统启动,SOD活性明显升高,以及时清除体内产生的活性氧,避免膜脂过氧化。但随胁迫时间的延长,抗氧化酶防御系统可能也遭到破坏,导致SOD活性有所下降,随之活性氧增加、膜脂过氧化程度加强,引起MDA含量升高。
综上所述,低质量浓度和短时间的NaCl胁迫对马蔺幼苗没有明显的伤害甚至有一定的“刺激生长”作用,随NaCl胁迫浓度的提高和胁迫时间的延长,各项生长和生理生化指标出现明显变化,表明马蔺受到明显伤害。但经过较高质量浓度NaCl胁迫处理30 d后,供试的全部马蔺幼苗并没有死亡且都能够存活,在一定程度上说明马蔺对NaCl胁迫具有较强的耐性。
[1]王遵亲.中国盐渍土[M].北京:科学出版社,1993.
[2]林栖凤,李冠一.植物耐盐性研究进展[J].生物工程进展,2000,20(2):20-25.
[3]冯 固,李晓林,张福锁,等.施磷和接种AM真菌对玉米耐盐性的影响[J].植物资源与环境学报,2000,9(2):22-26.
[4]中国科学院中国植物志编辑委员会.中国植物志:第十六卷第一分册[M].北京:科学出版社,1985.
[5]孟 林,张国芳,赵茂林.水保护坡观赏优良地被植物——马蔺[J].农业新技术,2003(3):38-39.
[6]徐飞鹏,岳俊芳.优良水保护坡观赏地被植物——马蔺的开发应用前景[J].内蒙古科技与经济,2003(12):54-55.
[7]刘德福,陈世璜,陈敬文,等.马蔺的繁殖特性及生态地理分布的研究[J].内蒙古农牧学院学报,1998,19(1):1-6.
[8]王鸿燕,黄苏珍.Pb胁迫对马蔺种子萌发及幼苗根尖细胞有丝分裂的影响[J].植物资源与环境学报,2009,18(2):53-56.
[9]沈伟其.测定水稻叶片叶绿素含量的混合液提取法[J].植物生理学通讯,1988(3):62-64.
[10]赵世杰,许长成,邹 琦,等.植物组织中丙二醛测定方法的改进[J].植物生理学通讯,1994(3):207-210.
[11]张殿忠,汪沛洪,赵会贤.测定小麦叶片游离脯氨酸含量的方法[J].植物生理学通讯,1990(4):62-65.
[12]杨鹏辉,李贵全,郭 丽,等.干旱胁迫对不同抗旱大豆品种花荚期质膜透性的影响[J].干旱地区农业研究,2003,21 (3):127-130.
[13]张宪政.作物生理研究法[M].北京:中国农业出版社,1992: 75-77.
[14]杨居荣,贺建群,张国祥,等.农作物对Cd毒害的耐性机理探讨[J].应用生态学报,1995,6(1):87-91.
[15]郭建华,李跃进,卢炜丽.3种盐胁迫对小麦苗期生长的影响[J].华北农学报,2007,22(3):148-150.
[16]Hamilton EW,Ⅲ,Heckathorn S A.Mitochondrial adaptations to NaCl.complexⅠ is protected by anti-oxidants and small heat shock proteins,whereas complexⅡ is protected by proline and betaine[J].Plant Physiology,2001,126:1266-1274.
[17]陈年来,马国军,张玉鑫,等.甜瓜种子萌发和幼苗生长对NaCl胁迫的响应[J].中国沙漠,2006,26(5):814-819.
[18]Levitt J.Reponses of Plants to Environmental Stress[M].2nd ed.New York:Academic Press,1980:365-434.
[19]绳仁立,佟海英,柴 翠,等.NaCl胁迫对甜菊不同品种幼苗生长的影响[J].植物资源与环境学报,2010,19(2):60-67.
[20]杨秀红,李建民,董学会,等.盐胁迫对甘草幼苗生长及其生理指标的影响[J].华北农学报,2006,21(4):39-42.
[21]任艳芳,何俊瑜.NaCl胁迫对莴苣幼苗生长和光合性能的影响[J].华北农学报,2008,23(4):149-153.
[22]尹增芳,何祯祥,王丽霞,等.NaCl胁迫下海滨锦葵种子萌发和幼苗生长过程的生理特性变化[J].植物资源与环境学报,2006,15(1):14-17.
[23]李合生.植物生理生化实验原理和技术[M].1版.北京:高等教育出版社,2000:134-137.
[24]刘爱荣,赵可夫.盐胁迫下盐芥渗透调节物质的积累及其渗透调节作用[J].植物生理与分子生物学学报,2005,31(4): 389-395.
[25]王增进,张玉先.大豆盐胁迫研究进展[J].黑龙江八一农垦大学学报,2005,17(6):26-29.
[26]李 明,王根轩.干旱胁迫对甘草幼苗保护酶活性及脂质过氧化作用的影响[J].生态学报,2002,22(4):503-507.
