高速逆流色谱分离制备白胡椒中单萜类化合物*
2011-12-18蒋志国陈文学刘四新
蒋志国,陈文学,刘四新
(海南大学食品学院,海南海口,570228)
高速逆流色谱分离制备白胡椒中单萜类化合物*
蒋志国,陈文学,刘四新
(海南大学食品学院,海南海口,570228)
应用高速逆流色谱法分离制备了白胡椒中 3种单萜类化合物。以 V(叔丁基甲基醚)∶V(甲醇)∶V(水)=2∶1∶1为两相溶剂系统,上相为固定相,下相为流动相,在主机转速 900 r/min、流动相流速 2.5 mL/min条件下,从 2.76 g样品中一步分离制备得到 3,7-二甲基-2-辛烯-1,6,7-三醇 35 mg,对薄荷烷-1,2,8-三醇-2-O-β-D葡萄糖苷 55mg,5-羟基龙脑-2-O-β-D葡萄糖苷 40mg,经高效液相蒸发光散射检测器 (HPLC-ELSD)检测纯度均达95.0%以上,各化合物结构经质谱和核磁共振氢谱、碳谱鉴定。研究结果表明,利用该方法可以对白胡椒中的单萜类化合物进行快速的分离和纯化,且制备量大,分离效率高。
白胡椒,高速逆流色谱,单萜
白胡椒 (Piper nigrumL.)为胡椒科植物胡椒的干燥成熟果实,又名白川。白胡椒是一种经济价值很高的热带香辛作物,是药食两用产品,也是世界著名的调味料。胡椒中含有多种化学成分,如胡椒碱、氮苯烷、松节油萜、水茴香萜、柠檬萜等[1]。研究表明,萜类化合物具有抗病毒、细菌、真菌,抗肿瘤,预防心血管疾病以及松弛平滑肌等多种生物活性[2]。萜类化合物的分离制备一般采用有机溶剂提取,再经过反复重结晶或硅胶柱层析纯化,可获得高纯度的产物[3-4]。由于多次重结晶以及硅胶柱层析会对目标产物造成较大的损失,使得收率大大降低,同时其过程繁琐冗长。
高速逆流色谱 (high-speed countercurrent chromatography,HSCCC)技术是一种无固体载体的连续液-液分配色谱技术,其固定相通过重力场和离心力场作用被保留在分离柱内,避免了固体载体与样品发生化学反应而变性及不可逆吸附,样品回收率高,可从粗制样品中在规模制备高纯度单体化合物,已广泛用于生化工程、医药、天然产物、食品等领域[6-9]。
本文以白胡椒为原料,运用制备型高速逆流色谱对白胡椒中的单萜类化合物进行了制备、纯化及结构鉴定。
1 实验材料与设备
1.1 实验材料
白胡椒 (市售),反相精细分离填料 MCI-GEL CHP20P(北京绿百草科技发展有限公司);20 cm×20 cm Sillca gel 60 F254薄层层析色谱板 (Merck德国);石油醚,甲醇,乙酸乙酯,叔丁基甲基醚 (分析纯试剂),华东医药股份有限公司;色谱纯甲醇 (Merck德国)。
1.2 主要仪器设备
HSCCC-D1200制备型高速逆流色谱仪 (浙江工商大学逆流色谱研究室),包括 K-1800 Wellchrom恒流泵 (Knauer德国)、B-684自动收集器 (Büchi,瑞士)和Model 8823A-UV紫外检测器 (北京新技术应用研究所),聚四氟乙烯管缠绕在 5个水平轴上形成螺旋管 (5 mm I.D.柱容积 1 200 mL),转速 0~1 000 r/min;玻璃色谱柱,Φ5 cm ×50 cm(杭州常盛科教器具厂);N-1000旋转蒸发仪 (上海爱朗仪器有限公司);FD-1冷冻干燥机 (北京博医康技术公司);LC-20A高效液相色谱仪 (Shimadzu,Japan),包括SEDEX75蒸发光散射检测器 (Sedex公司 法国);质谱采用 Bruker Esquire 3000 plus质谱仪 (Bruker美国)进行测定,离子源为 ESI;AVANCE DMX 500核磁共振仪 (Bruker德国)。
2 实验方法
2.1 样品的预处理
称取胡椒粉 5 kg用体积分数 95%乙醇于 50℃浸提 3次,每次乙醇用量 50 L,浸提 24 h,并不断搅拌。将 3次得到的浸提液混合,于 45℃下减压浓缩至无醇味后,将浓缩物分散于 5 L蒸馏水中,依次用等体积的石油醚、乙酸乙酯、正丁醇分别萃取 3次,萃取液减压浓缩后得正丁醇相粗提物 40 g。
2.2 正丁醇相粗提物分离
将 500 gMCI-GEL CHP20P填料装入半径为 2.5 cm,长为 50 cm的玻璃柱中,依次用蒸馏水、甲醇、蒸馏水各冲洗不少于 3倍柱体积,平衡 24h后上样。
正丁醇相提取物 40 g先用少量甲醇溶解,然后加入适量已处理好的MCI-GEL CHP20P填料,混合拌样,减压浓缩至干并上样。依次用蒸馏水、30%甲醇、60%甲醇、和 90%甲醇洗脱,每次 3个柱体积,洗脱至流出液没有颜色,旋转蒸发,冷冻干燥后得 60%甲醇洗脱部分 (Fr60)2.76 g,待用。
2.3 HSCCC分离
本实验所用溶剂系统为叔丁基甲基醚-甲醇-水(体积比 =2∶1∶1),4种溶剂按比例置于分液漏斗中,充分振荡后静置分层。上相作为固定相,下相作为流动相,超声脱气后备用。称取 2.5 g样品,用上下相各 40 mL溶解,超声脱气后备用。将固定相注满HSCCC-D1200螺旋管后开启直流电机,转速调至 900 r/min,并以 2.5 mL/min的流量从首端泵入流动相,在色谱柱尾端用量筒接收流出的固定相;待色谱柱尾端不再有固定相流出时,表明系统已动态平衡,量出流出的固定相体积,计算在此条件下的固定相保留率S,即 S=(V柱-V出)/V柱,式中 V柱为柱体积 (mL),V出为流动相推出的固定相体积 (mL);进样 80 mL,以 20 mL试管收集流出液,共收集 136管,并采用TLC点样检测分离情况。展开剂为三氯甲烷-甲醇-水 (体积比 65∶35∶10)静置后的下层溶液,显色剂为10%硫酸 -乙醇 (体积比 10∶90)溶液。
2.4 高效液相蒸发光散射(HPLC-ELSD)分析条件
色谱柱:Waters Symmetry Cl8色谱柱 (4.6 mm×150 mm,5μm);流动相 V(CH3CN)∶V(H2O)=(60∶40);流速:1.0 mL/min;柱温:25 ℃;进样量:10μL;ELSD检测器参数:漂移管温度 70℃,ELSD的增益值为 7,载气为空气,压力 0.35 MPa。
3 结果与分析
3.1 溶剂体系选择
一个稳定的两相溶剂体系是否适合于目标物质的分离,通常要看物质在该溶剂体系中的分配系数是否在一个合适的范围内。分配系数 K=cS/cM,其中cS指溶质在固定相中的浓度,cM指溶质在流动相中的浓度。一般而言,对 HSCCC最合适的 K值范围是0.5~2。当 K值≤0.5时,出峰时间太快,峰之间的分离度较差;当 K值≥2时,出峰时间太长,且峰形变宽。而在 0.5≤K≤2时,可以在合适的时间内,得到分离度较好的峰形。
溶剂系统的选择是逆流色谱分离中的首要环节,为了检查溶剂系统的适用性,需要对分配系数进行测定。测定方法包括高效液相色谱分析型逆流色谱和 TLC法等。TLC法的准确度较低,但方便、快速。选择溶剂系统的目的是分离样品,测定分配系数只是为了检查溶剂系统的适用性,对其准确度要求不高,因此 TLC法对各种样品,尤其是复杂天然产物分离的逆流色谱溶剂系统选择非常适用。在工作中发现,根据斑点色度可以观察样品中各组分的相对含量及其在两相溶剂中的分配情况,即估计分配系数的大小及差异,由此可以确定溶剂系统的适用性及各组分的流出顺序。
依据经验,按照溶剂系统选择的原则和过程,在实验过程中进行了大量的筛选,得到以下 2种溶剂系统。
(A)V(三氯甲烷 )∶V(甲醇 )∶V(水 )=5∶4∶3
(B)V(叔丁基甲基醚 ) ∶V(甲醇 ) ∶V(水 )=2∶1∶1
各溶剂系统的的 TLC分析结果如图 1所示。
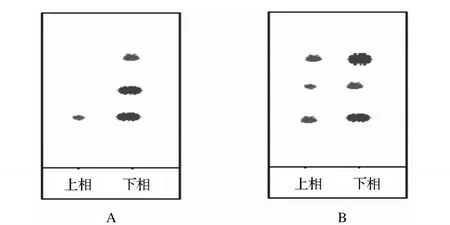
图 1 胡椒 60%甲醇洗脱部分在 2种溶剂系统中上下相的薄层色谱图
从图 1中可以看出,在溶剂系统 A中,样品中各组分主要集中在下相,上相很少或无,分配系数很不合理,不适合作为逆流色谱分离中的溶剂系统。在溶剂系统B中,样品中各组分在上下相中都有较好的分配,而且从斑点色度来看,系统 B中各组分之间的分配系数差异较为明显,且分层时间较短为 30 s。因此,最后选定选择溶剂系统 B作为高速逆流色谱分离的溶剂体系。
3.2 HSCCC-D1200分离参数的优化
3.2.1 流速对 HSCCC保留率的影响
流动相的流速不但显著影响分离时间,而且也会对分离度产生一的影响。以叔丁基甲基醚-甲醇-水为两相溶剂系统,上相为固定相,下相为流动相,在其它参数相同的条件下,流速越大,分离时间越短,但是固定相保留率越小,分离度就越小。因此,要在保证固定相保留率和分离度的前提下尽可能缩短分离时间。因此,综合实际分离情况,本试验最佳流速选为2.5mL/min。
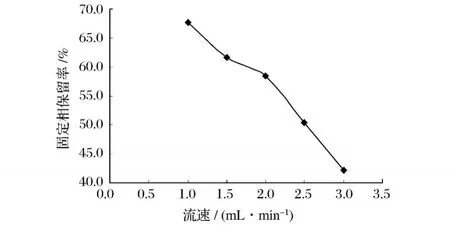
图 2 不同流速对 HSCCC-D1200固定相保留率的影响
3.2.2 转速对 HSCCC保留率的影响
以叔丁基甲基醚-甲醇-水为两相溶剂系统,上相为固定相,下相为流动相,流动相的流速为 2.5mL/min时高速逆流色谱仪转速的变化对固定相保留率的影响情况如图 3所示。研究表明,螺旋柱的旋转速度对两相溶剂系统在流体动力学平衡时的体积比影响很大,转速越大,固定相的保留值越大。一般来说,保留率越高对分离越有利,但考虑到仪器承受能力有限,另外转速过高,还容易造成乳化,因此,本试验最佳转速选为 900 r/min。

图 3 不同转速对 HSCCC-D1200固定相保留率的影响
3.3 HSCCC-D1200分离胡椒 60%甲醇洗脱部分结果
以上相为固定相,下相为流动相。溶剂系统为3.1中 (B),进样量 2.5 g,进样时流动相流速为 1.0 mL/min,进样后流动相流速为 2.5 mL/min,转速 900 r/min,收集 7 min/tube(20 mL试管),固定相保留率55%。TLC结果如图 4所示。
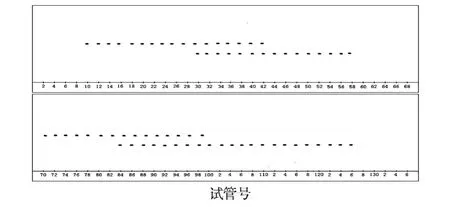
图 4 HSCCC-D1200分离胡椒 60%甲醇洗脱部分的薄层色谱图
根据 TLC结果可知,合并 12~26管,46~80管,102~126管,旋转蒸发和冷冻干燥,称量后分别得化合物 1(35 mg)、化合物 2(55 mg)和化合物 3(40 mg)。
3.4 纯度鉴定
用 HPLC-ELSD对分离制备得到的单体化合物1、2和 3进行纯度鉴定 (见图 5)。结果表明,3种化合物纯度分别达到了 95.8%、96.1%和 96.3%(面积归一法),具备了进行进一步的结构解析的要求。
3.5 结构解析
化合物 1 ESI-MS(m/z)∶211[M +Na]+.1H NMR(δin CD3OD):1.17(3H,s,H-8),1.20(3H,s,H-9),1.40(1H,m,H-5a),1.75(1H,m,H-5b),1.69(3H,s,H-10),2.07(1H,m,H-4a),2.29(1H,m,H-4b),3.25(1H,d,J=10.5Hz,H-6),4.10(1H,d,J=6.5 Hz,H-1),5.42(1H,m,H-2);13C NMR(δin CD3OD):14.9(C-10),23.4(C-8),24.4(C-9),29.1(C-5),36.4(C-4),58.1(C-1),72.3(C-7),77.5(C-6),123.6(C-2),138.3(C-3)。对照文献[9],判断该化合物为 (R)-3,7-dimethyloct-2E-en-1,6,7-triol,即 3,7-二 甲 基 -2-辛烯 -1,6,7-三醇。
化合物 2 ESI-MS(m/z):373[M +Na]+.1H NMR(δin CD3OD):3.89(1H,m,H-2),2.52(1H,m,H-3a),1.68(1H,dt,J=17.4,2.7 Hz,H-3b),1.52(1H,m,H-4),1.98(1H,m,H-5a),1.61(1H,m,H-5b),1.11(3H,s,H-7),1.20(3H,s,H-9),1.28(3H,s,H-10),4.34(1H,d,J=8.2 Hz,H-1 ’),3.15(1H,d,J=8.4 Hz,H-2 ’),3.38(1H,m,H-3 ’),3.36(1H,m,H-4 ’),3.26(1H,m,H-5 ’),3.87(1H,d,J=11.4 Hz,H-6 ’a),3.73(1H,dd,J=10.4,4.9 Hz,H-6’b);13C NMR(δi nC D3OD):73.5(C-1),76.4(C-2),34.6(C-3),35.3(C-4),23.0(C-5),26.8(C-6),25.0(C-7),75.3(C-8),29.4(C-9),29.1(C-10),106.2(C-1 ’),74.9(C-2 ’),78.1(C-3 ’),71.7(C-4’),77.6(C-5’),62.9(C-6’)。对照文献[10],判断该化合物为 p-menthane-1,2,8-triol-2-o-β-D-glucopyranoside,即对薄荷烷-1,2,8-三醇-2-O-(-D葡萄糖苷。
化合物 3 ESI-MS(m/z):355[M+Na]+.1H NMR(δin CD3OD):3.83(1H,m,H-2),1.10(1H,m,H-3a),2.26(1H,m,H-3b),1.66(1H,d,J=4.5 Hz,H-4),3.82(1H,m,H-5),1.33(1H,m,H-6a),2.50(1H,m,H-6b),0.86(3H,s,H-8),1.07(3H,s,H-9),0.97(3H,s,H-10),4.25(1H,d,J=7.5 Hz,H-1’),3.18(1H,m,H-2’),3.31(1H,m,H-3 ’),3.28(1H,m,H-4 ’),3.23(1H,m,H-5 ’),3.66(1H,m,H-6 ’a),3.84(1H,m,H-6 ’b);13C NMR(δ in CD3OD):50.1(C-1),84.6(C-2),34.6(C-3),52.3(C-4),76.7(C-5),70.2(C-6),46.8(C-7),18.9(C-8),19.9(C-9),12.3(C-10),104.5(C-1 ’),74.0(C-2 ’),76.7(C-3’),70.2(C-4’),76.4(C-5’),61.4(C-6’)。对照文献[11],判断该化合物为 5-hydroxy bornyl-2-O-β-D-glucopyranoside,即 5-羟基龙脑-2-O-β-D葡萄糖苷。
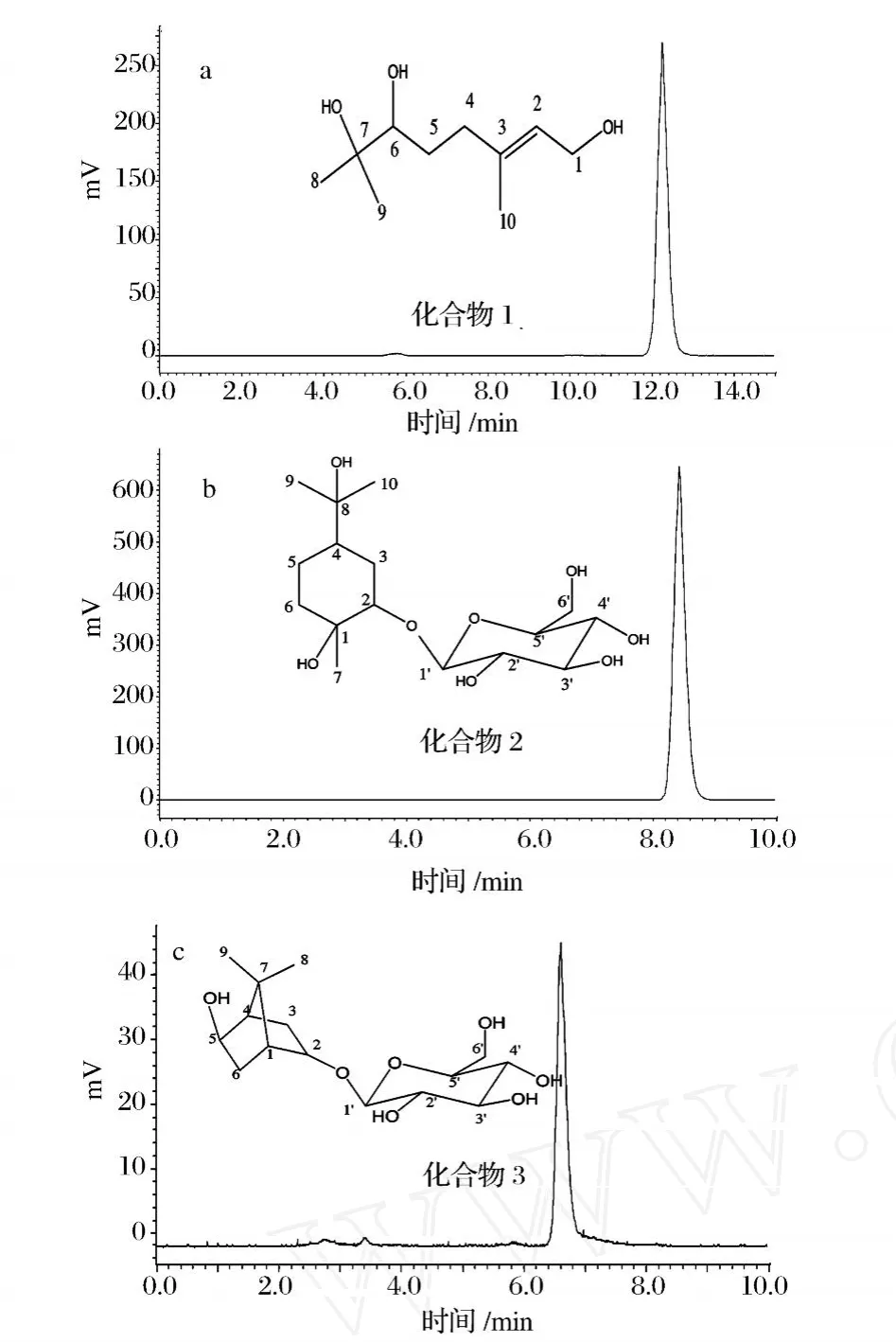
图 5 HSCCC分离得到的单萜化合物的HPLC-ELSD色谱图
4 结论
本次研究工作采用了制备型高速逆流色谱仪对热带香辛料白胡椒中的活性单萜类化合物进行了分离纯化。实验过程中系统地优化了溶剂体系和实验参数,在适宜的分离条件下,即 V(叔丁基甲基醚)∶V(甲醇 )∶V(水 )=2 ∶1∶1,为两相溶剂系统 ,上相为固定相,下相为流动相,主机转速 900 r/min,流动相流速 2.5 mL/min,通过一步分离得到了 3,7-二甲基-2-辛烯-1,6,7-三醇 (35 mg,95.8%)、对薄荷烷-1,2,8-三醇-2-O-β-D葡萄糖苷 (55 mg,96.1%),5-羟基龙脑-2-O-β-D葡萄糖苷 (40 mg,96.3%)。相比于传统的分离方法如硅胶柱色谱,高速逆流色谱具备一系列的独特优势如很高的样品回收率、较大的样品进样量、较低的溶剂消耗等,非常适用于分离制备天然植物中的生物活性成分。
[1] 陈文学,朱晓燕,胡月英等.胡椒油树脂对食用油脂抗氧化作用研究 [J].食品工业科技,2008,29(2):137-140.
[3] 赵利琴.山胡椒属萜类及其生物活性研究进展 [J].时珍国医国药,2006,17(2):171-174.
[3] Okasaka M,Kashi wada Y,Kodzhi matov O K,et al.Monoterpene glycosides from Paeonia hybrida[J].Phyto Chemistry,2008(69):1 767-1 772.
[4] Candida da SilvaV,SoaresMendes GianniniM J,Carbone V er al.New antifungal terpenoid glycosides fromA libertia edulis(Rubiaceae)[J].Helvetica Chimica Acta,91(7):1 355-1 362.
[5] Yoichiro Ito,Golden rules and pitfalls in selecting optimum conditions for high-speed counter-current chromatography[J].Journal of Chromatography A,2005,1 065:145-168.
[6] 杜琪珍,韩晓倩.水飞蓟黄酮的完全分离与结构鉴定[J].食品与发酵工业,2009,35(7):164-167.
[7] 王岱杰,刘建华,耿岩玲,等.夏天无生物碱的高速逆流色谱分离纯化[J].分析化学,2010,38(6):783-788.
[8] 韩忠明,王云贺,韩梅,等.高速逆流色谱分离纯化防风中升麻素苷和 5-O-甲基维斯阿米醇苷[J].分析化学,2009,37(11):1 679-1 682.
[9] Edegger K,Mayer S F,SteinreiberA,et al.Chemo-enzymatic enantio-convergent asymmetric synthesis of(R)-(+)-Marmin[J].Tetrahedron,2004,60:583-588.
[10] Ishikawa T,KudoM,Kitajima J.Water-soluble constituents of dill[J].Chem Pharm Bull,2002,50(4):501-507.
[11] Seki wa Y,Mizuno Y,Yamamoto Y,et al. Isolation of some glucosides as aroma precursors from ginger.Biosci[J].BiotechnolBiochem,1999,63(2):383-389.
Study on the Separation ofM onoterpenes fromPiper nigrum L.by High-speed Counter-current Chromatography
Jiang Zhi-guo,ChenWen-xue,Liu Si-xin
(College of Food Science,Hainan University,Haikou 570228,China)
Three monoterpeneswere prepared,isolated and purified fromPiper nigrumL..by high-speed counter-current chromatography(HSCCC).A two-phase solvent system composed of TBME-methanol-water(2∶1∶1,v/v/v)was used.The upper phase was stationary phase and lower phase was mobile phase.By one-step elution,under the conditions of a flow rate of 2.5 mL/min and 900 r/min,35 mg of 3,7-dimethyloct-2E-en-1,6,7-triol,55 mg of p-menthane-1,2,8-triol-2-O-β-D-glucopyranoside and 40 mg of 5-hydroxy bornyl-2-O-β-D-glucopyranoside was obtained from 2.76 mg of the butanol extract ofPiper nigrumL.,the puritieswas over 95.0%detected by high perfor mance liquid chromatographywith evaporative light scattering detection.The obtained fractions were analyzed by high performance liquid chromatography(HPLC),and identified bymass spectrometry(MS),1H-nuclearmagnetic resonance(NMR)and13C-NMR.The results indicated that HSCCC is a powerful technique for the purification ofmonoterpenes fromPiper nigrumL.with high productive capacity and high efficiency.
Piper nigrumL.,high-speed counter-current chromatography,monoterpene
博士,讲师 (陈文学为通讯作者)。
*海南省自然科学基金资助 (808102)和海南大学校基金(hd09xm90)资助
2010-09-15,改回日期:2011-01-12
