径向流色谱脱除灵芝多糖中蛋白质和色素的工艺优化*
2011-12-18姜慧燕孙培龙邵平
姜慧燕,孙培龙,邵平
1(杭州市农业科学研究院,浙江杭州,310024)2(浙江工业大学生物与环境工程学院,浙江杭州,310014)
径向流色谱脱除灵芝多糖中蛋白质和色素的工艺优化*
姜慧燕1,孙培龙2,邵平2
1(杭州市农业科学研究院,浙江杭州,310024)2(浙江工业大学生物与环境工程学院,浙江杭州,310014)
径向流色谱是一种新型色谱分离纯化技术,在生物工程领域具有很大的应用潜力。文中利用径向流色谱法对灵芝粗多糖进行纯化,以脱除其中的蛋白质和色素。通过单因素及响应面试验,确定了纯化过程的最优化条件:上样流速 2 mL/min,洗脱流速 40 mL/min,上样量 100 mL。在此条件下,蛋白脱除率、色素脱除率和多糖回收率分别达到 80.35%、88.52%、85.06%。径向流色谱法与 Sevag法、三氯乙酸法、活性炭法及双氧水法等传统化学方法比较的结果表明:径向流色谱脱蛋白、脱色及多糖保留效果均优于其他方法,且在处理过程中未使用有机试剂,突出了径向流色谱法高效、经济、安全、环保等优势。
径向流色谱,灵芝粗多糖,脱蛋白,脱色
径向流色谱 (radial flow chromatography,RFC)是一种新型色谱分离纯化技术,独特的径向流动设计,使其相对于传统轴向色谱,具有流速高、样品处理量大、操作压力低、线性放大容易等优势[1-5],在生物工程等诸多领域正发挥着越来越重要的作用,尤其是已被广泛用于蛋白质[6-11]及基因工程[12-13]产品的分离纯化方面。Gustavsson等[6]利用径向流色谱从牛心脏粗提物中分离制得乳酸脱氢酶。Hou等[7]采用离子交换径向流色谱对人血浆进行大规模分离制备,在数十分钟内成功分离得到纯度接近 100%的免疫球蛋白、纯度为 85%的转铁蛋白和纯度为 80%的白蛋白。Surinder等[11]利用径向流色谱高效分离纯化重组人类生长激素,处理时间较轴向色谱缩短 90%以上。Sun等[12]利用径向离子交换色谱分离纯化了Nitschmann组分Ⅲ中的凝血酶原复合物。张正光等[13]人用国产径向阳离子交换柱从 CL-CD1细胞培养上清中分离纯化尿激酶原,使尿激酶原比活性提高44.3倍,蛋白质含量下降 98%以上,回收率达87.7%。
通过热水浸提等方法所得灵芝粗多糖中往往混杂着色素、蛋白质、低聚糖等杂质,需进一步分离纯化,提高多糖纯度,以达到相关产品原料的标准。本文旨在利用径向流色谱纯化灵芝粗多糖,以达到同时脱除其中蛋白质及色素的效果,并与粗多糖传统的脱蛋白脱色方法进行系统地比较研究。
1 材料与方法
1.1 原料
灵芝粗多糖:纯龙泉灵芝多糖,由浙江益圣菌物发展有限公司提供。
离子交换剂:弱碱性阴离子交换剂 (A103S),购于德清漂莱特 (中国)有限公司;强碱性阴离子交换剂 QA60,由美国 Sepragen公司提供。
1.2 主要仪器与试剂
径向流色谱柱,SUPERFLO-250 COLUMN,美国Sepragen公司;752型紫外-可见分光光度计,上海光学仪器有限公司;紫外扫描仪,UV-2450PC,日本岛津公司;恒流泵,BT00-300M,保定兰格恒流泵有限公司;数控计滴自动部份收集器,SBS-100,上海康华生化仪器制造厂;Folin-酚试剂:北京鼎国生物技术有限责任公司;Sevag试剂:三氯甲烷与正丁醇按体积比 4∶1混合;三氯乙酸-正丁醇试剂,三氯乙酸与正丁醇按体积比 1∶10混合;三氯甲烷、正丁醇、硫酸、苯酚等试剂,均为国产分析纯。
1.3 实验方法
1.3.1 径向流色谱纯化灵芝粗多糖工艺流程
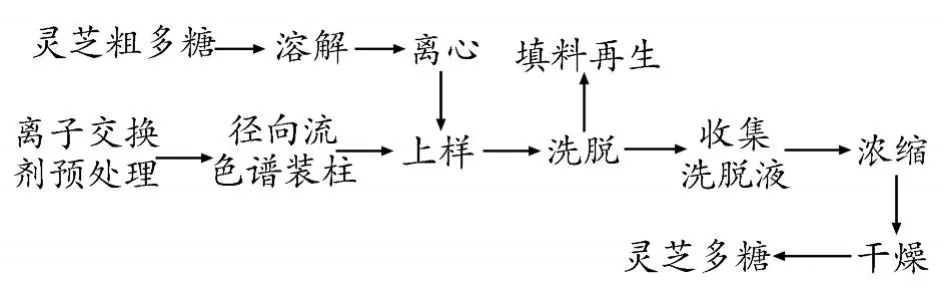
离子交换剂预处理:将离子交换剂 (A103S)置于2%NaOH溶液中浸泡 2~4 h,纯水洗涤至中性,然后置于 3%HCl溶液中浸泡 2~4 h,纯水洗涤至中性,最后再于 2%NaOH溶液浸泡 2~4 h,纯水洗涤至中性。
将灵芝粗多糖粉加纯净水充分溶解 (10 mg/mL),于 4 900 r/min下离心,得灵芝粗多糖水溶液。将预处理后的离子交换剂装填于径向流色谱柱中,以纯净水冲洗平衡柱子。将一定量的灵芝粗多糖溶液用恒流泵于一定流速下上样,然后用蒸馏水洗脱至苯酚-硫酸法[14-15]无多糖检出,收集洗脱液,真空浓缩,冷冻干燥得灵芝多糖。
填料再生:使用过的填料,用 2 mol/L NaCl溶液洗脱,至洗脱液无色透明,并用 Folin-酚法[16]基本无蛋白检出,再用蒸馏水洗脱至无 NaCl。
1.3.2 径向流色谱纯化灵芝粗多糖条件优化
通过单因素及响应面试验,以蛋白脱除率、色素脱除率及多糖回收率为指标,对径向流色谱纯化灵芝粗多糖的工艺条件进行优化。单因素水平如表 1所示。在单因素试验基础上,进行响应面试验,根据Box-Behnken中心设计原理,设计了 15个实验点,其中 12个为析因点,3个为零点,共进行 3次,用以估计试验误差。每个实验点重复 2次。试验因素与水平见表 2。

表1 径向流色谱纯化灵芝粗多糖单因素试验水平表
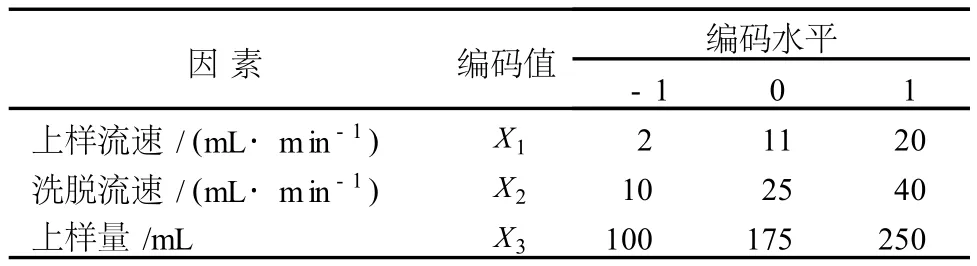
表2 响应面优化试验因素水平及编码
1.3.3 Sevag法脱蛋白
取 100 mL灵芝粗多糖液,按粗多糖液∶Sevag试剂体积比 3∶1加入 Sevag试剂,混合,分液漏斗中充分振摇 30 min,使蛋白质和 Sevag试剂生成凝胶物质分离,于 4 900 r/min下离心 10 min,弃去下层有机相及中间凝聚物,再向分离出的上层粗多糖溶液中加入Sevag试剂,重复操作数次,同时测定上清液中蛋白质及多糖含量。
1.3.4 三氯乙酸法 (TCA法)脱蛋白
取 100 mL灵芝粗多糖水溶液 (10 mg/mL),加入等体积的 20%三氯乙酸,搅拌 30 min,静置 12 h,4 900 r/min离心 10 min,分出上清液,用 1 mol/L NaOH溶液调 pH值至 7,测上清液中蛋白质和多糖含量。
1.3.5 三氯乙酸-正丁醇法脱蛋白
取 50 mL灵芝粗多糖水溶液 (10 mg/mL),加入50 mL三氯乙酸-正丁醇试剂,于分液漏斗中充分振荡 20 min后,静置 3 h,取下清液弃去上清液及中间层凝聚物,同时测定下清液及灵芝粗多糖原液中蛋白质及多糖含量。
1.3.6 活性炭脱色
取 100 mL灵芝粗多糖水溶液 (10 mg/mL),置于锥形瓶中,加入 2.0%活化后的活性炭,将 pH值调至3.0,磁力搅拌 20 min,抽滤,所得滤液再经微滤后,于450 nm下测定滤液及灵芝粗多糖原液光密度值。
1.3.7 双氧水脱色
取 100mL灵芝粗多糖水溶液 (10 mg/mL)于锥形瓶中,加入多糖液 1/3体积的 H2O2,50℃下静置 5h后,于 450 nm下测定脱色前后灵芝粗多糖溶液光密度值,计算脱色率。
1.3.8 径向流色谱与轴向色谱比较
分别测定流速为 5、10、20、30、40、50、100 mL/min时纯水流经径向流色谱和轴向色谱时的柱压,填料为 QA60和 A103S。
比较径向流色谱与轴向色谱对灵芝粗多糖的纯化效果。色谱条件:上样浓度 10 mg/mL,上样量 100 mL,上样流速 2 mL/min,洗脱流速 40 mL/min,自动部分收集器以 26 s/管的速度收集洗脱液。分别测定计算蛋白脱除率、色素脱除率和多糖回收率。
1.3.9 指标及分析检测方法
以蛋白质脱除率、色素脱除率及多糖回收率为指标,衡量径向流色谱法纯化灵芝粗多糖的效果。各指标计算公式如下:

多糖含量测定采用苯酚-硫酸法:吸取样品液 1 .0 mL,用水补至 2.0 mL,加入 1.0 mL 6%苯酚及 5.0 mL浓硫酸,振荡混匀,置沸水浴中加热 15 min,取出置冰水中迅速冷却后,于 490 nm测吸光度,计算多糖含量。
蛋白质含量测定采用 Folin-酚法:吸取样品液1.0 mL,加入 5 mL试剂甲,于漩涡混合器上迅速混匀,水浴 (30℃)10 min;再逐管加入 0.5 mL试剂乙,立即混匀,水浴 (30℃)30 min后,于 660 nm下测吸光度,计算蛋白质含量。
色素的测定采用分光光度计法测 450nm下多糖溶液脱色前后的吸光度。
2 结果与分析
2.1 上样量对径向流色谱纯化灵芝粗多糖的影响
上样量对径向流色谱纯化灵芝粗多糖的影响结果如图 1所示。随着上样量的增大,色素脱除率的变化较为显著,当上样量超过 100 mL时,色素脱除率急剧下降,上样量为 300 mL时,色素脱除率降至74.47%。蛋白脱除率随上样量增大的变化趋势先是较为平缓,当上样量超过 200 mL时,急剧下降。当上样量为 300 mL时,蛋白脱除率降低至 64.46%。多糖回收率则随上样量的增大,总体呈缓慢上升的趋势。当分离过程以蛋白质脱除为主要目的时,上样量取 200 mL较为适宜。
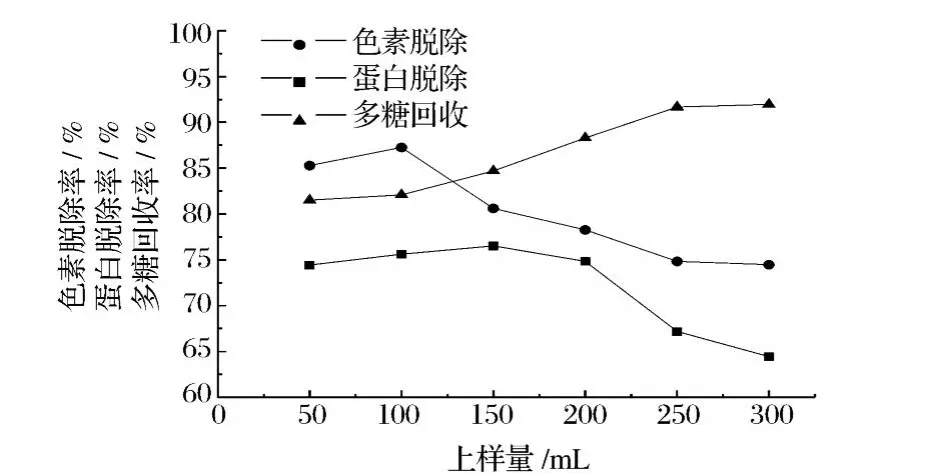
图 1 上样量对径向流色谱纯化灵芝粗多糖的影响
2.2 上样流速对径向流色谱纯化灵芝粗多糖的影响
上样流速对径向流色谱纯化效果的影响,主要是对样品组分交换吸附的影响。上样流速过快,样品溶质分子来不及扩散到离子交换剂表面,就随流动相流出柱外,不利于蛋白质、色素等物质的吸附。径向流色谱柱采用了径向流动技术,样品经流体分布器均匀分布后,从柱的外周流向柱圆心,使得样品在上样过程中能充分的与离子交换剂结合,即使在较高流速下,样品仍能在柱内较好的扩散,从而得以充分地吸附到填料上。因此,即使上样流速为 50 mL/min时,蛋白脱除率及色素脱除率仍分别可达 64.00%和68.32%(图 2)。
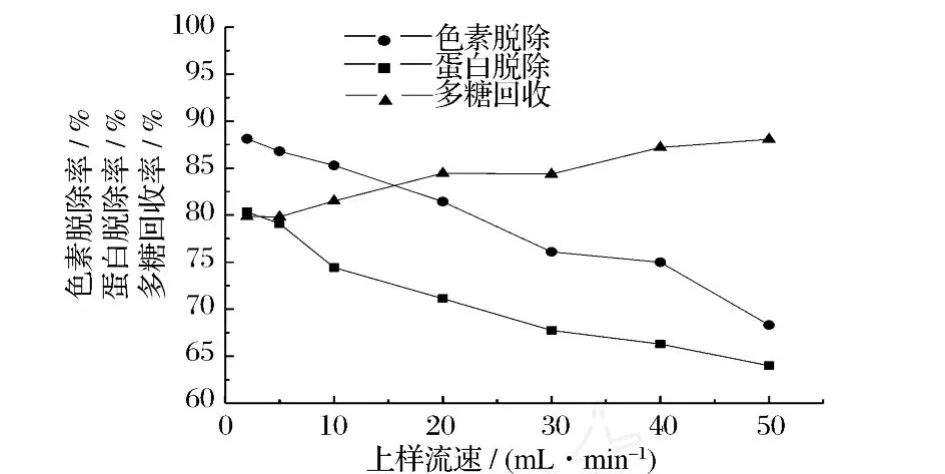
图 2 上样流速对径向流色谱纯化灵芝粗多糖的影响
2.3 洗脱流速对径向流色谱纯化灵芝粗多糖的影响
由于色谱柱的表面积一般都大于其横截面积,因此当径向流色谱柱流动相保持较高体积流速时,其线速度也并不高。从图 3可以看出,在洗脱流速较低时(<10 mL/min),蛋白脱除率和色素脱除率随洗脱流速的增加有所增加,随后趋于平缓;当洗脱流速大于30 mL/min时,蛋白脱除率和色素脱除率随洗脱流速的增加下降较快。但即使洗脱流速高达 50 mL/min时,蛋白脱除率和色素脱除率仍分别能达 67.42%和85.88%。多糖回收率则随洗脱流速的增加而呈缓慢上升趋势。
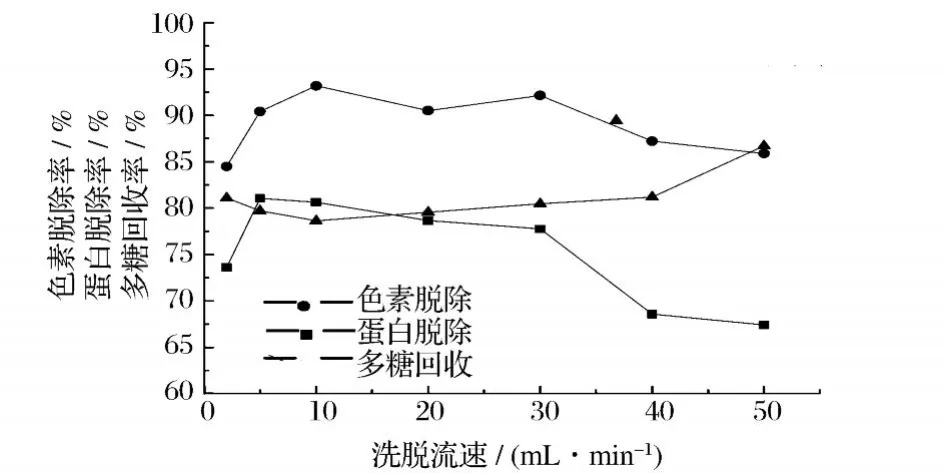
图 3 洗脱流速对径向流色谱纯化灵芝粗多糖的影响
2.4 径向流色谱纯化灵芝粗多糖响应面试验结果
响应面试验结果表明,色素脱除率变化趋势与蛋白脱除率基本一致,而多糖回收率则与蛋白脱除率呈相反趋势,因此只对其中蛋白脱除率进行分析。利用Matlab软件对蛋白脱除率实验数据进行回归分析,得二元回归方程:
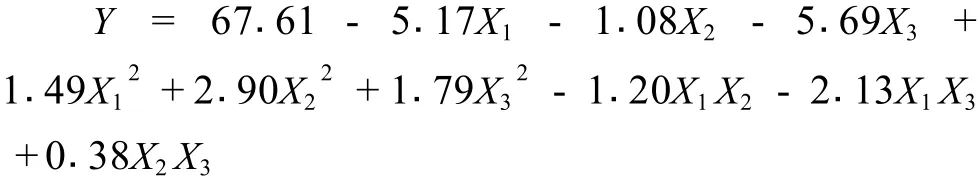
方差分析得,方程决定系数 R2为 0.992 1,修正相关系数平方和为 0 .978 0,此模型高度显著 ( P<0.0001),失拟项小,因而该模型拟合程度良好,表明试验设计可靠 (表 3)。
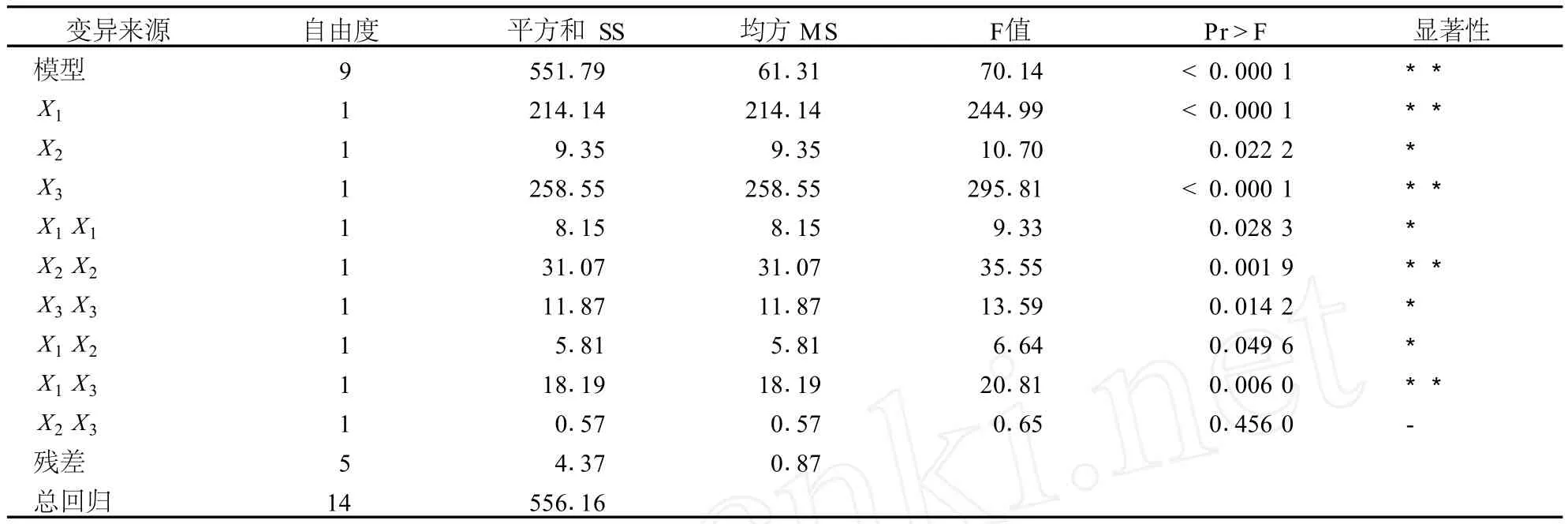
表3 响应面模型方差分析结果
由回归方程得出最高指标时各因素组合为:上样流速 2.00 mL/min,洗脱流速 10.04 mL/min,上样量100.00 mL/min,此时蛋白脱除率为 82.76%。而在实际生产中,考虑到生产效率的关系,宜选取较高的洗脱流速。且从洗脱流速及上样流速的响应面图分析可知,当上样流速保持在 2 mL/min时,蛋白脱除率随洗脱流速的增加先降低后有所增加。因此在实验过程中,考察了上样流速、洗脱流速、上样量分别为 2 mL/min、40 mL/min、100 mL时的多糖纯化效果。实验所得结果为:蛋白脱除率 80.35%,色素脱除率88.52%,多糖回收率 85.06%,与优化条件下所得结果相差不多,但分离效率大大提高。
2.5 径向流色谱法同各种化学方法脱蛋白脱色效果比较
径向流色谱法同各种化学方法脱蛋白脱色效果的比较结果如表 4所示。Sevag法对灵芝粗多糖重复处理 6次后,蛋白脱除率仅为 41.78%,多糖回收率为 69.31%;三氯乙酸法对灵芝粗多糖中的蛋白无脱除作用;TCA-正丁醇法的多糖回收率可达 88.00%,而蛋白脱除率仅为 40.41%。活性炭和双氧水对灵芝粗多糖均能起到较好的脱色效果,色素脱除率分别可达 87.45%和 84.37%,但多糖损失较多。径向流色谱法蛋白脱除率和色素脱除率分别为 80.35%和88.52%,多糖回收率为 85.06%。因此,径向流色谱法相对于传统化学方法,不仅可以同时高效脱除灵芝粗多糖中的蛋白质和色素,而且能保持较高的多糖回收率。

表4 径向流色谱法同各种化学方法脱蛋白脱色效果比较
2.6 径向流色谱与轴向色谱比较
径向流色谱柱的优势之一就是在较高流速下反压降较低。表 5所示为分别以 QA60、A103S为填料时不同流速下径向流色谱柱与轴向色谱柱的压降。试验结果表明,以QA60为填料时,随着流速从 5 mL/min增至 100 mL/min,轴向色谱的柱压急剧增加;而径向流色谱柱柱压较低且上升较缓。以A103S为填料时,随着流速的增加,轴向色谱柱和径向流色谱柱的柱压上升都比较缓慢,且两者主要大小相差很小。分析其原因,可能是由于填料 QA60的粒径较小 (平均粒径为 60μm),而填料 A103S粒径较大 (平均粒径为 0.7 mm),填料粒径越小床层空隙率越小,当流速增加时,柱压上升也越快。因此,径向流色谱柱压较低的优势相对于粒径小、质地软的填料更为显著。

表5 径向流色谱与轴向色谱柱压比较
表6所示为在上样浓度 10 mg/mL,上样量 100 mL,上样流速 2 mL/min,洗脱流速 40 mL/min条件下,径向流色谱与轴向色谱对灵芝粗多糖的纯化效果比较。结果表明,在相同床层体积 (250 mL)下,径向流色谱柱以 3.15 cm的有效床层高度,取得与轴向色谱柱 46.00 cm有效床层高度基本一致的纯化效果。
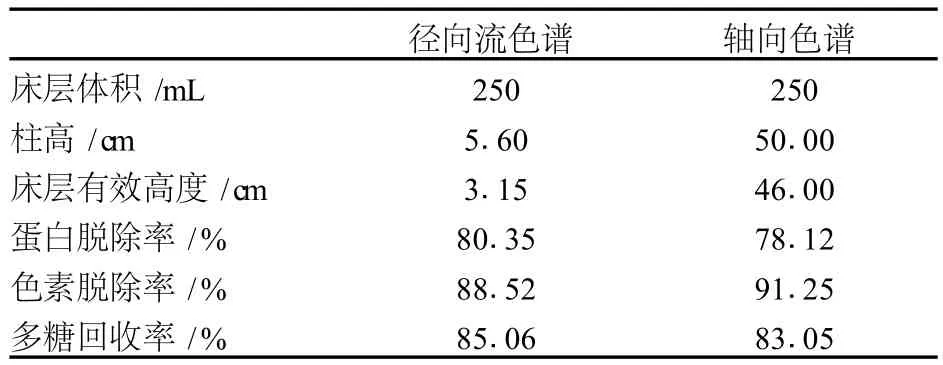
表6 径向流色谱与轴向色谱纯化灵芝粗多糖效果比较
3 结论
灵芝粗多糖分离纯化过程中,蛋白质及色素的脱除是非常重要的一步。本文通过单因素及响应面试验,并结合实际生产需要的基础上,优化得出径向流色谱脱除灵芝粗多糖中蛋白质及色素的最优工艺条件:上样流速 2 mL/min,洗脱流速 40 mL/min,上样量100 mL。在此条件下,蛋白脱除率为 80.35%,色素脱除率 88.52%,多糖回收率 85.06%。径向流色谱与轴向色谱对比结果表明,径向流色谱柱压较低的优势相对于粒径小、质地相对较软的填料更为显著。
径向流色谱法与各种化学方法比较结果表明:径向流色谱脱蛋白、脱色及多糖保留效果都优于其它方法,且在处理过程中未使用有机试剂,突出了径向流色谱法高效、经济、安全、环保等优势。
[1] Charlotte C,MarcelR,Emil Z,et al.Evaluation of radial chromatography versus axial chromatography,practical approach[J].JournalofChromatographyB,2007,845:191-199.
[2] Peter R L.Large-scale ion-exchange column chromatography of proteinsComparison of different formats[J].Journal of ChromatographyB,2003,790:17-33.
[3] Gu T Y,Tsai G J,Tsao G T.A theoretical study ofmulticomponent radial flow chromatography[J].Chemical Engineer Science,1991,46(5/6):1 279-1 288.
[4] Kim Y H,Lee E K.Comparison of axial and radial flow chromatography on protein separation speed and resolution[J].Korean Journal of Chemical Engineering,1996,13(5):466-472.
[5] 姜慧燕,邵平,孙培龙.径向流色谱分离技术原理及应用分析[J].核农学报,2009,23(1):118-122.
[6] Gustavsson P E,Larsson P O.Continuous superporous agarose beds in radial flow columns[J].Journal of ChromatographyA,2001,925:69-78.
[7] Hou K C,Zaniewski R.Purification of urokinase by combined cation exchanger and affinity chromatographic cartridges[J].Journal of ChromatographyB:Biomedical Sciences and Applications.1990,525:297-306.
[8] Ahmed,Salah H,Saxena,et a1.Sequential separation of whey proteinsand formulations thereof [P]. US,5756680,1998.
[9] Church F C,Whinna H C.Rapid sulfopropyl-disk chromatographic purification of bovine and human thrombin[J].Analytical biochemistry,1986,157(1):77-83.
[10] Per-Erik G,Per-Olof L.Continuous superporous agarose beds in radial flow columns[J].Journal of ChromatographyA,2001,925:69-78.
[11] Surinder M Singh,Aparna Sharma,Amulya K Panda.High throughput purification of recombinant human growth hormone using radial flow chromatography[J]. Protein Expression and Purification,2009,68:54-59.
[12] Sun T,Chen G,Liu Y,et al.Purification of human prothrombin from Nitschmann fraction III:usingDEAE membrane radial flow chromatography[J].Journal of Chroma-tographyB,2000,742:109-114.
[13] 张正光,肖成祖,郭志霞,等.用国产径向色谱柱和羟基磷灰石纯化细胞工程尿激酶原[J].军事医学科学院院刊,1997,2,21(1):47-50.
[14] Gabriela C,Norma S,Maria IB,et al.Quantitative determination of pneumococcal capsular polysaccharide serotype 14 using a modification of phenol-sulfuric acid method[J].J MicrobiolMeth,2003,52:69-73.
[15] Miller GL.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Anal Chem,1954,31,426-428.
[16] Bradford M M.A rapid and sensitive method for the quantization ofmicrogram quantitiesof protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72,248-254.
Optim ization of Deprotein ization and Decoloration of Polysaccharide fromGanoderm a lucidumby Radial Flow Chromatography
Jiang Hui-yan1,Sun Pei-long2,Shao Ping2
1(Hangzhou Academy ofAgricultural Sciences,Hangzhou,310024,China)2(College ofBiological and Environmental Engineering,ZhejiangUniversity of Technology,Hangzhou 310014,China)
Radial flow chromatography(RFC)was a new technique of chromatography purification,and has a great potential in biotechnology.The deproteinization and decoloration of polysaccharide fromGanoder m a lucidiumby radial flow chromatographywere studied.The optimal conditionswere determined by single factor experiments and response surface experiments:sample concentration 10 mg/mL,sample volume 100 mL,sample flow-rate 2 mL/min and elution flow-rate 40 mL/min.The deproteinization rate,decoloration rate and polysaccharide recovery rate under the optional chromatography condition were 80.35%,88.52%and 85.06%,respectively.The purification efficiency of RFC was compared with sevagmethod,trichloroacetic acid method,activated carbon method and hydrogen perioxide method.The comparative results indicated that the purification by RFC were superior to other methods.None organic reagent in RFC treatment shows its advantages of high-efficiency,more economic,safe,and environmental friendly.
radial flow chromatography,Ganoder m a lucidiumcrude polysaccharides,deproteinization,decoloration
硕士,助理工程师 (邵平副教授为通讯作者)。
*杭州市科技局项目 (20091932B48);国家高技术 863项目(2007AA10Z337);浙江省食用菌科技创新团队项目(2009R50029);浙江工业大学重点基金项目(20100240)
2010-08-05,改回日期:2010-11-29
