根结线虫侵染对番茄叶片保护酶活性及膜脂过氧化的影响*
2011-12-12李媛媛鲁丽鑫王冰林
李媛媛,鲁丽鑫,王冰林
(1.潍坊学院,山东 潍坊 261061;2.潍坊市农业科学院,山东 潍坊 261071)
根结线虫侵染对番茄叶片保护酶活性及膜脂过氧化的影响*
李媛媛1,鲁丽鑫1,王冰林2
(1.潍坊学院,山东 潍坊 261061;2.潍坊市农业科学院,山东 潍坊 261071)
以番茄品种雄风158为试材,研究了根结线虫侵染对其保护酶活性和膜脂过氧化的影响。结果显示,线虫侵染后,番茄叶片的过氧化物酶(POD)、过氧化氢酶(CAT)活性和丙二醛(MDA)含量均远高于未接种番茄。POD活性在接种后1-15d呈上升趋势,然后开始下降,15d时出现峰值;CAT活性在接种后5-15d呈下降趋势,5d时出现峰值;MDA含量持续上升至20d时为最大值;超氧化物歧化酶(SOD)的活性接种1-15d高于未接种番茄,15-20d略低于未接种番茄,10d时出现峰值。研究结果表明,MDA含量可以作为早期判断番茄是否感染根结线虫的一项生理指标。
番茄;根结线虫;保护酶活性;膜脂过氧化
番茄(Solanum Lycopersicum)是我国设施栽培的主要蔬菜之一,连年种植造成连作障碍严重,病害达40多种[1],其中根结线虫病是番茄的主要病害之一,在许多菜区呈逐年上升趋势[2],严重影响了设施番茄的产量与质量。
根结线虫侵染后,植株会产生一定的生理生化变化。目前,对该方面的研究相对比较多,但是不同的研究者,其研究结论却不一致。郭衍银等[4]研究发现接种南方根结线虫后,生姜体内各种生理生化指标主要在初次侵染前期和二次侵染前期表现出一定的反应,其余时间则基本丧失这种反应。金国良等[5]在黑籽南瓜中研究发现,接种线虫后过氧化物酶(POD)、超氧化物歧化酶(SOD)及多酚氧化酶(PPO)活性在侵染前期显著升高,而后下降,在侵染后期POD稍有升高,SOD和PPO则呈现下降趋势;过氧化氢酶(CAT)活性在侵染前期显著下降,而后呈升高趋势。杨宇虹等[6]研究却表明受南方根结线虫侵染后,感病烟草品种POD活性仅比其不受线虫侵染的根系增加4个酶活性单位。Molinari等[7]则研究表明番茄接种线虫后,大部分材料中SOD活性下降。
为了进一步明确根结线虫侵染所引起的植株生理生化反应规律,本试验以潍坊主栽番茄品种雄风158为试材,测定了根结线虫侵染后对番茄叶片中SOD、POD、CAT活性以及丙二醛(MDA)含量的动态变化,以期探讨番茄对根结线虫侵染的生理生化机制,为抗根结线虫番茄筛选提供一定的技术依据。
1 材料与方法
1.1 试验材料
1.1.1 供试根结线虫
试验根结线虫采自潍坊市农科院茄子试验地,经鉴定后,接种在感病番茄品种上进行扩繁备用。
1.1.2 供试番茄品种
试验所用番茄品种为雄风158,河南省商丘市傲雪种业有限公司生产。
1.2 试验方法
1.2.1 根结线虫接种
选择长势相当的四叶期雄风158番茄植株,用打孔器在根围打孔(5孔/盆),按2000条/盆注入二龄幼虫,以清水注入作为对照,然后用土掩埋。各处理为10株,重复3次。
1.2.2 酶活性测定
分别于接种后1、5、10、15和20d采取接种线虫和未接种线虫的番茄叶片,在室内测定叶片的各项酶活性指标。SOD活性测定采用NBT光化还原法[8];POD活性测定采用愈创木酚氧化法[9];CAT活性参照汪宗立[10]介绍的方法测定;MDA含量测定采用硫代巴比妥酸显色法[11]。
2 结果与分析
2.1 番茄叶片中POD活性变化
番茄叶片POD活性测定结果如图1所示。从整个调查期看,接种后l-20d,接种材料POD活性均高于对照。在接种后,番茄材料叶片POD活性即开始迅速上升,在接种15d出现最高峰,为1.434U。对照材料叶片POD活性也有变化,峰值在10d出现,为1.157U。

图1 番茄叶片POD活性变化
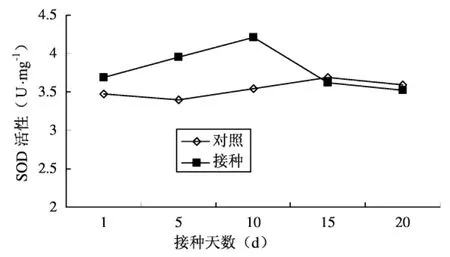
图2 番茄叶片SOD活性变化
2.2 番茄叶片中SOD活性变化
番茄叶片SOD活性测定结果如图2所示。从整个调查期看,接种后l-15d,接种材料SOD活性均远高于对照;15-20d均略低于对照。接种后,番茄叶片SOD活性开始迅速上升,在接种10d时到达峰值,为4.205U,随后SOD活性迅速下降,并低于对照。
2.3 番茄叶片中CAT活性变化
番茄叶片CAT活性变化如图3所示。从该图中可以看出,未接种的对照材料CAT活性变化不大。接种线虫的番茄叶片CAT活性变化比较明显。在接种1-5d迅速上升至峰值,为0.114U,然后酶活性有明显下降,接种15d出现低谷。从整个调查期看,接种处理的番茄叶片CAT活性均高于对照,接种后5d时,番茄叶片CAT活性与对照相差最大,是对照的2.72倍。
2.4 番茄叶片中MDA含量变化
番茄叶片中MDA含量变化如图4所示。从图4可以看出,未接种的对照材料中MDA在10d时出现峰值,为0.065μmol,然后开始下降至20d,达最小值0.056μmol。接种后番茄材料叶片MDA含量开始增加,接种20d至最大值为0.075μmol。从整个调查期看,接种处理的番茄叶片MDA含量均高于对照,接种后20d,番茄叶片MDA含量与对照相差最大,比对照增加了33.93%。表明南方根结线虫可以对番茄细胞膜造成伤害,降低番茄对逆境的适应能力,促使植株早衰。
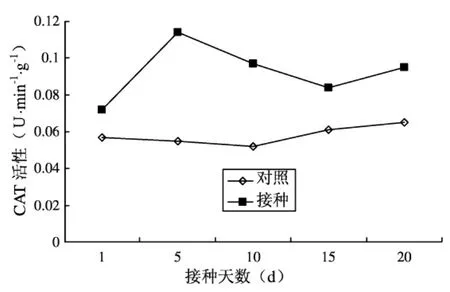
图3 番茄叶片CAT活性变化
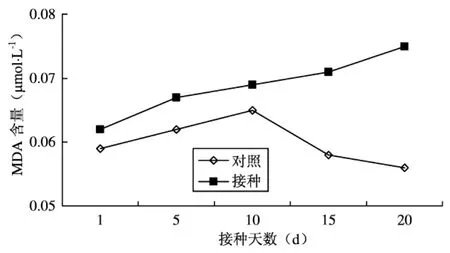
图4 番茄叶片MDA含量变化
3 讨论
SOD是植物体内清除自由基的最关键酶之一,它能催化植物体内分子氧活化的第一个中间产物O2-发生歧化反应,生成O2和H2O2(2O2-+2H+=H2O2+O2)。已有研究证明,在感病反应中SOD活性升高,抗病反应中活性下降或无多大变化。本实验感病材料接种后1-15d中的SOD活性升高,且远高于未接种的材料,高浓度的SOD清除了细胞内的H2O2。H2O2是木质素合成的前体物质,细胞内由于缺乏H2O2,木质素合成减少,细胞壁变薄,线虫侵入增多,造成细胞膜和细胞器的大量损伤,从而表现感病。但16d后SOD的活性又开始下降且低于未接种的材料,具体原因有待于进一步试验研究。
POD是细胞内一种重要的防御酶,不仅植物细胞内产生的O2-经SOD催化反应形成的H2O2,可再由POD催化分解成H2O和O2。同时,POD可催化许多化合物如脂肪酸、芳香胺和酚类物质的氧化;催化木质素前体如松伯醇的形成以及细胞壁碳水化合物与蛋白质之间形成共价键[12]。关于POD在植物抗病中的作用尚存在不同观点,有些研究表明,POD活性上升对细胞壁木质化起到一定的作用,而细胞壁木质化有助于阻止线虫的侵入[13]。本实验虽然感病材料中POD峰值活性较高,但接种后15d才出现峰值,此时大量线虫已经侵入感病材料根部,POD的高活性并不能阻止线虫的侵染。
CAT是一种重要的内源活性氧清除剂,对H2O2和·OH有清除作用,虽然该反应速度快,但由于CAT对H2O2和·OH的亲和性低,因此在清除病原物与植物相互作用过程中产生的H2O2时作用可能有限。不过,某些POD对H2O2的亲和性要比CAT高得多。二者协调作用,以维持植物体内H2O2和·OH的正常代谢水平。本次试验中,未接种线虫的处理的CAT活性比接种线虫的处理普遍要低,这说明未接虫处理的植株体内较低的CAT活性水平不能清除非亲和性互作产生的过量H2O2,植株表现对病害较强的抵抗能力。但CAT活性升降的无规律与植株抗病性无显著性相关,还有待于进一步试验证实。
MDA是细胞膜脂过氧化的终产物,它可强烈地与细胞内许多成分发生反应,使多种酶和膜系统遭受严重损伤,其含量高低反映了植物膜受伤害程度[14],所以研究者常以MDA作为判断细胞膜脂过氧化作用的主要指标[15]。在本次试验所研究的接虫量范围内,MDA的含量呈持续上升的趋势,表明随着线虫侵染进程,细胞膜损伤逐渐加大。
综上所述,本试验中在根结线虫侵染番茄的不同调查时期,叶片SOD、POD、CAT等保护酶类呈现低-高-低的变化趋势,因此,这些保护酶的活性高低不能作为番茄是否被线虫侵染的有效生理指标。但是,MDA含量却持续上升,与线虫侵染时间呈正相关,可以作为早期判断番茄是否感染根结线虫的一项生理指标。
[1]杜永臣,严准,王孝宣,等.番茄育种研究主要进展[J].园艺学报,1999,26(3):161-169.
[2]王全华,葛晨辉,尹国香,等.番茄根结线虫病抗病育种研究进展[J].莱阳农学院学报,2001,18(3):216-220.
[3]刘纪霜,刘志明,黄金玲,等.植物抗根结线虫机制研究进展[J].植物保护,2007,33(1):21-23.
[4]郭衍银,王秀峰,徐坤,等.生姜对南方根结线虫侵染的生理生化反应[J].植物病理学报,2005,35(1):49-54.
[5]金国良,王富,纪文磊,等.南方根结线虫侵染对黑籽南瓜生物学性状及根系酶活性的影响[J].中国果菜,2009,(9):14-16.
[6]杨宇虹,秦西云,刘敬业.过氧化物酶与烟草南方根结线虫病的抗性研究[J].烟草科技,1997,(3):46.
[7]Molinari S.Changes of catalase and SOD activities in the early response of tomato to Meloidogyne incognita attack[J].Nematologia Mediterranea,1999,27(1):167-172.
[8]李合生.植物生理生化实验原理与技术[M].北京:高等教育出版社,2000:167-169.
[9]赵世杰,李德全.现代植物生理学实验指南[M].北京:科学出版社,1999:305-306.
[10]汪宗立.水稻耐盐性的生理研究[J].江苏农业学报,1990,6(2):1-6.
[11]华东师范大学.植物生理学实验指导[M].北京:人民教育出版社,1983:143-144.
[12]余叔之.植物生理与分子生物学[M].北京:科学出版社,1992.
[13]章元寿.植物病理生理学[M].南京:江苏科学技术出版社,1996:254-265.
[14]毛培利,曹帮华,张明如.干旱胁迫下刺槐保护酶活性的研究[J].内蒙古农业大学学报,2004,25(1):106-108.
[15]韩蕊莲,李丽霞,梁宗锁,等.干旱胁迫下沙棘膜脂过氧化保护体系研究[J].西北林学院学报,2002,17(4):1-5.
(责任编辑:肖恩忠)
Effects of Meloidogyne Incognita on the Activities of Protective Enzymes and Superoxidation of Membrane Lipid in Solanum Lycopersicum
LI Yuan-yuan1,LU Li-xin1,WANG Bing-lin2
(1.Weifang University,Weifang 261061,China;2.Weifang Academy of Agricultural Sciences,Weifang 261071,China)
Under the infection by Meloidogyne incognita,continuous changes of several physiological and chemical indexes in tomato were studied.Results showed that after Meloidogyne incognita infecting,the activities of peroxidase(POD)and catalase(CAT)and the content of MDA were much higher than non-inoculated.POD activity of plants inoculated by nematode rose in the 1-15d and then declined,and the peak appeared in the 15d.CAT activity of plants inoculated by nematode declined in the 5-15d after inoculation and the peak appeared in the 5d.MDA content was the highest in the 20d.SOD activity of plants inoculated by nematode was higher than the non-inoculated in the 1-15d after inoculated,while it was slightly lower than the non-inoculated in the 15-20d.These results suggested that the content of MDA may be as an early physiological index indicating whether the tomato infected by nematode.
tomato,meloidogyne incognita,activities of protective enzymes,superoxidation of membrane lipid
2011-07-19
山东省星火计划项目(2009XH060)
李媛媛(1979-),女,山东淄博人,潍坊学院生物工程学院讲师,博士。研究方向:蔬菜遗传育种。
S963.21+1 文献标识码:A 文章编号:1671-4288(2011)06-0073-04
