pH-stat控制流加培养红发夫酵母产虾青素
2011-12-05朱晓立梁世中邓毛程朱明军
朱晓立,梁世中,邓毛程,朱明军
(1.广东轻工职业技术学院食品与生物工程系,广东 广州 510300;2.华南理工大学生物科学与工程学院,广东 广州 510640)
pH-stat控制流加培养红发夫酵母产虾青素
朱晓立1,梁世中2,邓毛程1,朱明军2
(1.广东轻工职业技术学院食品与生物工程系,广东 广州 510300;2.华南理工大学生物科学与工程学院,广东 广州 510640)
通过酸碱流加培养、混合碳源-氨水流加培养、混合碳源-尿素流加培养等pH-stat控制流加培养红发夫酵母产虾青素。pH-stat控制流加培养与分批培养相比较,生物量及虾青素产量都有不同程度地提高。从提高虾青素产量和降低生产成本综合考虑,混合碳源-氨水流加培养是最理想的方法,培养96 h虾青素产量最高达到19.94 mg/L。
红发夫酵母;虾青素;pH-stat;流加培养
色素与食品的关系密不可分,色素赋予食品诱人的色泽,从而给消费者带来良好的感官质量和强烈的购买欲。食用色素按来源可分为天然和人造色素两大类。近年来发现人工化学合成色素有的存在致癌和致突变作用,故天然色素日益受到人们重视,而开发具有一定营养价值或药理作用的功能性天然色素,是色素工业发展的重中之重。
虾青素是一种广泛存在于生物体的红色素,尽管“虾青素”一词在日常生活中不常使用,但虾青素存在于许多种人类食物之中。大多甲壳类动物如虾、龙虾、螃蟹等呈现的红色均因虾青素积累所致,一些鱼肉如鲑鱼的肉色也是虾青素积累的结果。在实际生产中,虾青素常用作鱼虾等水产养殖动物的饲料添加剂,以便弥补人类膳食中虾青素的缺乏,同时改善水产养殖产品的质量[1-2]。动物实验表明虾青素有抑制肿瘤发生[3]、增强免疫功能、延缓衰老[4]等多方面的生物学功能,因此在功能食品、饲料、化妆品和医药等方面有着广阔的应用前景[5]。
红发夫酵母所产虾青素是胞内色素,菌体的高密度生长使虾青素产量增加,通过营养物的流加分批培养能够达到高密度菌体培养的目的。在摇瓶培养基成分优化组合研究的基础上[6],对红发夫酵母的5 L反应器进行了发酵规律的研究。
1 材料与方法
1.1 菌株
红发夫酵母菌株Phaffia rhodozyma由华南理工大学生化工程研究所驯化保存。
1.2 培养基
1.2.1 斜面培养基(g/L)
葡萄糖 20,酵母粉 3,蛋白胨 5,麦芽汁 3,琼脂20,pH5。
1.2.2 液体种子培养基(g/L)
葡萄糖20,酵母粉3,蛋白胨5,麦芽汁3,pH 5。
1.2.3 发酵培养基(g/L)
混合碳源(糖蜜40%、淀粉塘60%)30,混合氮源(玉米浆 40%、硫酸铵 60%)7,MgSO4·7H2O 1.5,(NH4)3C6H5O72,Na2HPO42.0,pH 5。
1.3 主要仪器与设备
高效液相色谱仪:美国安捷伦公司(型号:DG-2);紫外分光光度计:澳大利亚GBC科仪公司(型号:CINTRA20);电子分析天平:瑞士制造(型号:AG204);生化培养箱:澳大利亚Thermoline(型号:WEST6100);低温摇床:美国BRUNSWICK科学有限公司(型号:Innova4330);超净工作台:苏净集团安泰公司;冷冻离心机:日本日立公司(型号:CF7D2);pH计:美国Sartorius公司;电热鼓风恒温干燥箱:上海实验仪器厂;立式电热压力蒸汽消毒器:浙江绍兴医疗器械厂(型号:YXQ.L31.400);手提式压力蒸汽消毒器:江阴滨江医疗设备厂(型号:YX-280);发酵罐:德国BBrau公司生产的5 L反应器;光学显微镜:无锡照相器材厂(型号:L-1000);恒温水浴锅:深圳天南地北实业有限公司。
1.4 培养方法
1.4.1 菌种保藏
1)菌株接入斜面培养基,20℃培养48 h,4℃保藏,每月传代1次;
2)20℃培养48 h,离心后加无菌新鲜培养基和甘油,甘油浓度10%~20%,-70℃~-80℃低温冷冻保藏。
1.4.2 种子培养
将一环菌苔(20℃培养3 d~4 d的斜面种)接种于250mL的锥形瓶,20℃、150r/min的恒温摇床培养48h。
1.4.3 摇瓶培养
250 mL锥形瓶中装30 mL培养基,灭菌后以8%(体积分数)的接种量接入培养48 h的种子液,20℃、150 r/min摇床培养。
1.4.4 生物反应器培养
反应器和培养基灭菌后以8%(体积分数)的接种量接入培养48 h的种子液,控制通气和搅拌,按照一定的方式补料,并定时取样测定数据。培养过程中维持温度为20℃,培养液pH为5.0。
1.5 测定方法
1.5.1 酵母生物量的测定
取10 mL培养液,3000 r/min离心10 min,倒掉上清液,用蒸馏水离心洗涤2次后再用蒸馏水将菌体移入预先干燥至恒重M0的称量瓶中,置于105℃电热恒温干燥箱中干燥至恒重,用精密电子天平称量称量瓶和菌体总重M,则生物量可用下式计算:

1.5.2 培养液中残糖的测定
采用菲林试剂快速滴定法测定总糖。
1.5.3 虾青素的提取[7]
取5 mL培养液,离心分离洗涤3次,加3 mL 3 mol/L HCl,沸水浴3 min,迅速冷却,离心分离洗涤2次,添加5 mL甲醇振荡提取1 min,离心取上清液。如果提取不完全,再加甲醇提取,直至菌体无色。提取液置冰箱冷藏至测定。
1.5.4 虾青素测定[8]
采用 HPLC 测定。流动相为 φ甲醇:φ乙腈=9:1,流动相流速为1.0 mL/min,柱温为30℃,PDA检测器在474 nm处进行虾青素分析。以Sigma公司的虾青素作为标准样。
2 结果与讨论
2.1 分批培养
将经活化培养48 h的种子液按8%(体积分数)接种量接入含3.5 L培养基的5 L反应器中,培养温度20℃,初期控制溶氧50%,后期由于耗氧增加,控制在40%。不补料也不控制pH,每12 h测定生物量、降糖曲线、pH变化曲线、虾青素含量和虾青素产量变化曲线。5 L反应器分批培养红发夫酵母生长曲线如图1所示。
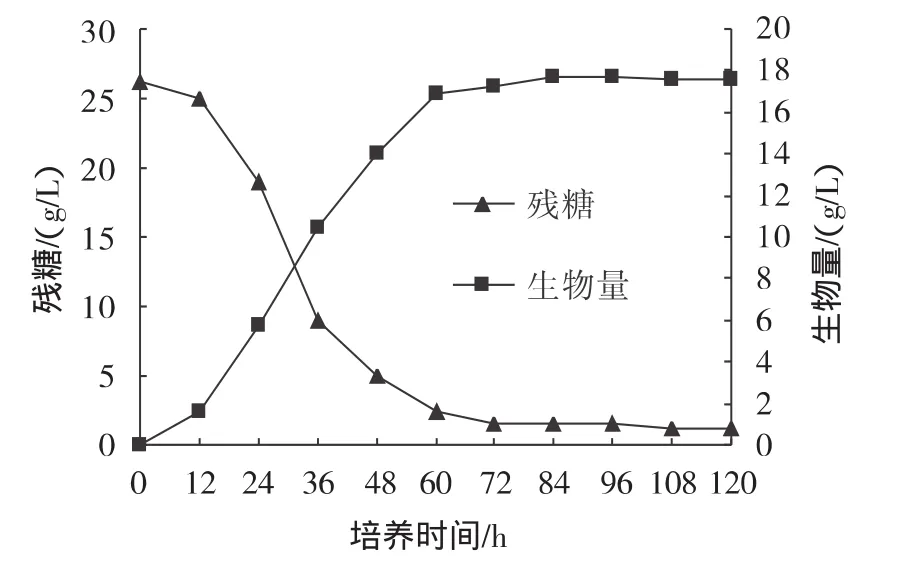
图1 5 L反应器分批培养红发夫酵母生长曲线Fig.1 Growth curves of batch culture of P.rhodozyma in 5 L bioreactor
从图1可知,0 h~12 h为延迟期,红发夫酵母生物量增加不明显,耗糖速率较慢;12 h~36 h为指数生长期,生物量增加明显,耗糖速率很快,12h生物量1.61g/L,而36 h的生物量10.46 g/L;36 h~84 h为减速期,生物量增加和耗糖速率减慢,60 h生物量16.91 g/L,残糖仅剩2.5 g/L;84 h~120 h为静止期,生物量和残糖变化不大,84 h生物量最高17.68 g/L,120 h生物量17.61 g/L。5 L反应器分批培养红发夫酵母虾青素变化曲线如图2所示。

图2 5 L反应器分批培养红发夫酵母虾青素变化曲线Fig.2 Astaxanthin curves of batch culture of P.rhodozyma in 5 L bioreactor
从图2可知,在指数生长期内,虾青素合成速率较快。12 h虾青素含量仅为50 μg/g;此后平滑上升,36 h虾青素含量283 μg/g;36 h~48 h,虾青素大量合成,虾青素含量和产量突增,48 h虾青素含量591 μg/g,产量8.28 mg/L。此后,虾青素合成速率减慢,108 h虾青素含量最高768 μg/g,虾青素产量也最高13.54 mg/L。5 L反应器分批培养pH变化曲线如图3所示。
从图3可知,分批培养pH的变化过程。0 h~24 h pH 下降,24 h pH4.44;24 h~36 h 上升,36 h pH6.74;48 h pH下降后,逐渐回升至6.50左右,并基本维持在这个水平。这说明在培养初期随着糖分的消耗,产生较多的酸性物质,导致pH值下降,糖分消耗完后,碱性物质增多,pH再度上升。

图3 5 L反应器分批培养pH值变化曲线Fig.3 pH curve of batch culture of P.rhodozyma in 5 L bioreactor
2.2 pH-stat控制流加培养
pH-stat控制流加培养是补料分批培养的一种,即通过流加控制pH基本恒定在最佳值。补料分批培养是一种介于分批培养和连续培养之间的操作方式,在进行分批培养的时候,向反应器加入培养基的一种或多种成分,以达到延长生产期和控制培养过程的目的。
2.2.1 酸碱流加培养
将经活化培养48 h的种子液按8%(体积分数)接种量接入含3.5 L培养基的5 L反应器中,培养温度20℃,初期控制溶氧50%,后期由于耗氧增加,控制在40%。pH用浓氨水和10%的硫酸控制在5.0左右,每12 h测定生物量、降糖曲线、pH变化曲线、虾青素含量和虾青素产量变化曲线。5 L反应器pH-stat流加培养红发夫酵母生长曲线如图4所示。

图4 5 L反应器pH-stat流加培养红发夫酵母生长曲线Fig.4 Growth curves of pH-stat fed-batch culture of P.rhodozyma in 5 L bioreactor
从图4可知,酸碱流加培养很好的控制pH在5.00左右,因此酵母细胞生长比没有控制pH值的分批培养要好。12 h细胞生物量4.68 g/L;24 h~48 h为指数生长期,耗糖速率较快;48 h生物量16.97 g/L,高于同期分批培养生物量,提高了21.13%;此后减速,84 h到108 h为静止期,84 h生物量最高18.65 g/L,相对于分批培养生物量最高值提高了5.5%。5 L反应器pH-stat流加培养红发夫酵母虾青素变化曲线如图5所示。

图5 5 L反应器pH-stat流加培养红发夫酵母虾青素变化曲线Fig.5 Astaxanthin curves of pH-stat fed-batch of P.rhodozyma in 5 L bioreactor
从图5可知,在指数生长期内,虾青素合成速率较快,相对于分批培养上升比较平稳。12 h虾青素含量仅为140 μg/g;此后逐渐上升,36 h虾青素含量285 μg/g;36 h~48 h,虾青素大量合成,虾青素含量和产量突增,48 h虾青素含量535 μg/g,产量9.05 mg/L;此后,虾青素积累继续增加,96 h虾青素含量最高851 μg/g,虾青素产量也最高15.82 mg/L,相对于分批培养要早12 h,也提高了10.8%和16.8%。
2.2.2 混合碳源-氨水流加培养
将经活化培养48 h的种子液按8%(体积分数)接种量接入含3.5 L培养基的5 L反应器中,培养温度20℃,初期控制溶氧50%,后期由于耗氧增加,控制在40%。以混合碳源(糖蜜和淀粉糖)代替硫酸,用氨水代替氢氧化钠来响应发酵pH变化的一种偶联补料培养模式,10%氨水控制pH在5.00,当pH超过5.00时,由反应器系统自动泵启动流加碳源,从而达到流加碳源和氮源的目的。每12 h测定生物量、降糖曲线、pH变化曲线、虾青素含量和虾青素产量变化曲线。5 L反应器pH-stat混合碳源流加培养红发夫酵母生长曲线如图6所示。
从图6可知,由于24 h到36 h,培养液pH值上升很快,超过5.00,反应器系统自动流加混合碳源,残糖从24 h14.8 g/L增加到36 h的22.1 g/L,此后基本控制pH在5.00左右,12 h细胞生物量2.9 g/L,由于流加了混合碳源,延长了细胞生长期;从24 h~96 h生物量一直在显著增长,96 h生物量27.51 g/L,高于同期酸碱流加培养生物量,提高了47.8%;此后减速,96 h到120 h为平稳期,120 h生物量最高28.12 g/L,相对于酸碱流加培养生物量最高值提高了50.7%。5 L反应器pH-stat混合碳源流加培养红发夫酵母虾青素变化曲线如图7所示。

图6 5 L反应器pH-stat混合碳源流加培养红发夫酵母生长曲线Fig.6 Growth curves of P.rhodozyma in 5 L bioreactor by pH-stat feeding with mixture carbon sources
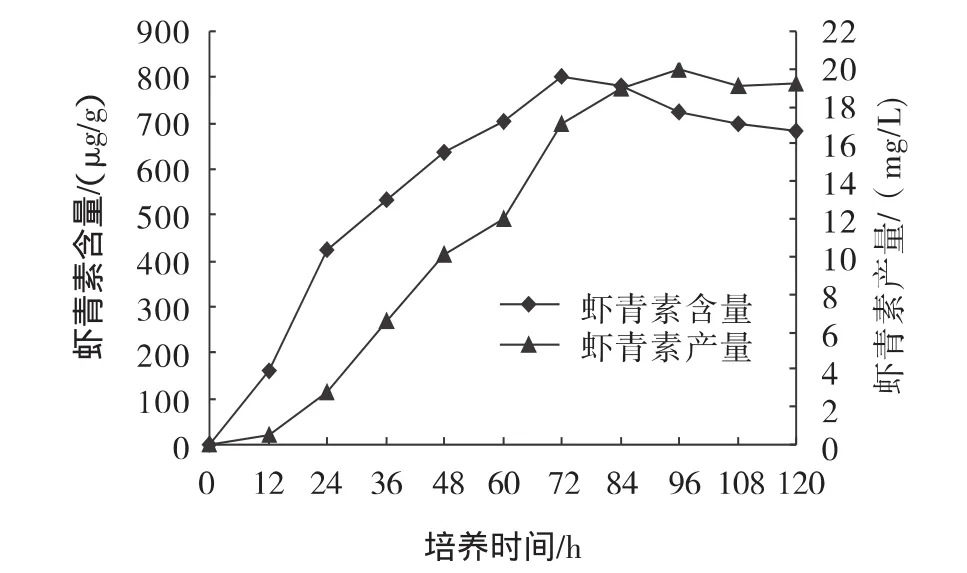
图7 5 L反应器pH-stat混合碳源流加培养红发夫酵母虾青素变化曲线Fig.7 Astaxanthin curves of P.rhodozyma in 5 L bioreactor by pH-stat feeding with mixture carbon sources
从图7可知,在指数生长期中前期,虾青素合成速率较快,相对于酸碱流加培养上升更明显。12 h虾青素含量仅为162 μg/g,此后虾青素大量合成,虾青素含量和产量突增,36 h虾青素含量531 μg/g,到72 h虾青素含量最高802 μg/g,相对于酸碱流加培养虾青素含量最高值下降了,这是由于生物量大大增加引起的。96 h虾青素产量达到最高19.94 mg/L,相对于酸碱流加培养虾青素产量最高值提高了26%。
2.2.3 混合碳源-尿素流加培养
将经活化培养48 h的种子液按8%(体积分数)接种量接入含3.5 L培养基的5 L反应器中,培养温度20℃,初期控制溶氧50%,后期由于耗氧增加,控制在40%。以混合碳源(糖蜜和淀粉糖)代替硫酸,以尿素代替氨水来响应发酵pH变化的一种偶联补料培养模式,其中尿素和硫酸铵以4:1混合,相当于10 g/L的硫酸铵,当pH超过5.00时,由反应器系统自动泵启动流加碳源,从而达到流加碳源和氮源的目的。每8小时测定生物量、降糖曲线、虾青素含量和虾青素产量变化曲线。5 L反应器流加混合碳源-尿素培养红发夫酵母生长曲线如图8所示。

图8 5 L反应器流加混合碳源-尿素培养红发夫酵母生长曲线Fig.8 Growth curves of P.rhodozyma in 5 L bioreactor by feeding carbamide and mixture carbon sources
由图8可知,在对数生长期细胞生长较快,比生长速率为3.70×10-2h-1。在64 h开始流加尿素后,细胞生长减缓。培养到144 h,生物量达到30.81 g/L。由图8还可以看到,继续培养生物量开始下降,说明细胞开始老化死亡。
本次试验共流加约298 g糖分;初始培养液体积为3.5 L,糖浓度为35.22 g/L,含糖量为123.3 g;最终培养液体积4.5 L,残糖浓度9.52 g/L,含糖量为42.8 g,故整个培养过程中实际耗糖量为378.5 g;生物量最终达到30.20 g/L,共计135.9 g,故糖分转化为酵母细胞的转化率为0.359。5 L反应器流加混合碳源-尿素培养红发夫酵母虾青素变化曲线如图9所示。

图9 5 L反应器流加混合碳源-尿素培养红发夫酵母虾青素变化曲线Fig.9 Astaxanthin curves of P.rhodozyma in 5 L bioreactor by feeding carbamide and mixture carbon sources
由图9可知,在136 h前,虾青素产量呈持续增长状态,并于136 h达到最大产量28 mg/L。136 h以后继续培养,发现虾青素产量和含量同步迅速下降,估计是酵母细胞进入衰亡期的原因。虾青素含量在对数期增长较快,在加入尿素后,虾青素含量稳步增大,并于136 h 达到最大值 923 μg/g。
3 结论
pH-stat控制流加培养相对于不控制pH-stat的分批培养,红发夫酵母的生物量、虾青素含量和产量都有显著提高。但是,不同方式进行pH-stat控制流加培养的结果也有差异,以混合碳源(糖蜜和淀粉糖)代替硫酸,用氨水代替氢氧化钠来响应发酵pH变化的偶联补料培养模式,不仅能维持最适pH值,同时也流加了混合碳源,延长了细胞生长期,但各项指标最高值出现的时间并没有推迟,相对于酸碱流加培养生物量最高值提高了50.7%,虾青素产量最高值提高了26%。以混合碳源(糖蜜和淀粉糖)代替硫酸,以尿素代替氨水来响应发酵pH变化的偶联补料培养模式,能同时达到流加碳源和氮源的目的,生物量、虾青素产量及含量均达到了较高水平,但是流加尿素虾青素合成积累较慢,培养时间过长,影响其实际生产操作的可行性。因此,以混合碳源代替硫酸,用氨水代替氢氧化钠来响应发酵pH变化的偶联补料培养模式是比较理想的方式。
[1]Torrissen O J,Christiansen R.Requirements for carotenoids in fish diets[J].J Appl Ichthyol,1995,11:225-230
[2]Torrissen O J,Hardy R W,Shearer K D.Pigmentation of salmonidscarotenoid deposition and metabolism[J].CRC,Crit Rev Aquat Sci,1989(1):209-225
[3]Gradelet S,Astirg P,Bon A L,et al.Modlation of aflatoxin B1 carcinogenicity,genotoxicity and metabolism in rat liver by dietary carotenoids:evidence for a protective affect of CYP1A inducers[J].Cancer Lett,1997,114:221-223
[4]Schroeder W A,Johnson E A.Antioxidant role of carotenoids in Phaffia rhodozyma.J Gen[J].Microbiol,1993,139:907-912
[5]刘子贻,沈奇桂.虾青素的生物活性及开发应用前景[J].中国海洋药物,1997,8(2):46-49
[6]朱晓立,梁世中.红发夫酵母生产虾青素的培养基优化[J].食品与发酵工业,2008,34(2):61-64
[7]杨文,吉春明.一种简单的胞壁破碎方法[J].微生物学通报,1995,22(1):58-59
[8]Meyer P S,Du-Preez J C.Effect of acetic acid on astaxanthin production by Phaffia rhodozyma[J].Biotechnol lett,1993,15(9):919-924
Study on Astaxanthin Production of Phaffia rhodozyma in pH-stat Fed-batch Cultures
ZHU Xiao-li1,LIANG Shi-zhong2,DENG Mao-cheng1,ZHU Ming-jun2
(1.Department of Food and Biology Engineering,Guangdong Industry Technical College,Guangzhou 510300,Guangdong,China;2 College of Bioscience and Bioengineering,South China University of Technology,Guangzhou 510640,Guangdong,China)
The growth and astaxanthin production of Phaffia rhodozyma in pH-stat fed-batch cultures with different feeding methods and grown at specific growth rates similar to the batch culture was compared.The results described that fed-batch culture was better than the batch culture.The different feeding methods included acid-alkali,compound carbon sources and ammonia,compound carbon sources and urea fed-batch culture.To the end of achieving and the cost efficiency of astaxanthin production,compound carbon sources and ammonia fed-batch culture was the best method,the highest astaxanthin production was 19.94 mg/L at 96 h culture time.
Phaffia rhodozyma;astaxanthin;pH-stat;fed-batch culture
广东省科技攻关项目(2002C1040101);广州市科技计划项目(2003Z2-E0131)
朱晓立(1980—),男(汉),工程师,讲师,硕士,研究方向:食品生物技术。
2010-08-27
