溶氧调控策略对Alcaligenes sp.NX-3产威兰胶发酵过程的影响*
2011-11-28万萍李会徐浩陈飞徐虹
万萍,李会,徐浩,陈飞,徐虹
1(成都大学生物产业学院,四川 成都,610106)2(南京工业大学食品与轻工学院,材料化学工程国家重点实验室,江苏南京,210009)
溶氧调控策略对Alcaligenes sp.NX-3产威兰胶发酵过程的影响*
万萍1,李会2,徐浩2,陈飞2,徐虹2
1(成都大学生物产业学院,四川 成都,610106)2(南京工业大学食品与轻工学院,材料化学工程国家重点实验室,江苏南京,210009)
主要研究了发酵过程中溶氧调控策略对Alcaligenes sp.NX-3产威兰胶的影响。在7.5 L发酵罐中,首先考察了不同通气量对菌体生长、威兰胶浓度、葡萄糖消耗、威兰胶黏度等的影响。结果表明,通气量为1 vvm时,有利于威兰胶浓度的提高。通过研究不同供氧水平对威兰胶发酵的影响,发现较高的溶氧水平有利于威兰胶的合成,但是不利于威兰胶黏度的提高。因此提出了低供氧-中供氧-高供氧、高供氧-中供氧-低供氧2种不同溶氧调控策略。实验结果表明:采用高供氧-中供氧-低供氧策略,能够使威兰胶浓度达到25.4 g/L,葡萄糖对威兰胶的转化率提高到0.51 g/g,威兰胶黏度达到2.700 Pa·s。
威兰胶,Alcaligenes sp.NX-3,溶氧调控策略
威兰胶(welan gum)是一种分子量高达数百万的原核生物杂多糖[1],它的主链结构骨架由D-葡萄糖、D-葡糖醛酸、D-葡萄糖和L-鼠李糖重复单元组成,侧链由单一的L-鼠李糖或L-甘露糖构成[2]。威兰胶具有稠化、悬浮、热稳定、絮凝和耐酸碱等性能,在石油、混凝土、食品、油墨、医药等行业中有着广泛的应用前景[3-6]。
威兰胶可由产碱杆菌好氧发酵生产,属于高黏度发酵类型。随着发酵的进行,威兰胶的积累,发酵液粘度迅速增大,高达几千甚至上万厘泊,严重影响发酵液中营养物质、溶氧的传递和吸收利用,抑制菌体生长代谢,严重阻碍产物的累积。溶氧一直以来都是高粘度发酵体系中一个重要的研究因素,溶氧对好氧发酵的影响主要分为两方面:一是溶氧浓度影响与呼吸链有关的能量代谢,影响微生物生长代谢;二是氧直接参与产物合成[7]。虽然国内外对威兰胶生产工艺有着诸多的研究[8-10],但溶氧对威兰胶发酵的影响鲜有报道,而同是微生物多糖的黄原胶在这方面却被深入研究。林剑[11]等研究了搅拌与溶氧对黄原胶发酵的影响,发现溶氧浓度对黄原胶产生菌的生长速率、黄原胶的生成率以及其质量都有明显的影响。花璟薇[12]在6 L的生物反应器上研究了溶氧对黄原胶发酵的影响。结果表明发酵液中的溶氧浓度对菌体生长速率影响不大,但对发酵过程稳定期的长短有显著影响;溶氧越高,黄原胶持续合成的时间越长。Fernado等[13]研究发现,发酵液中的溶氧水平对黄原胶平均分子质量的大小有着重要影响。黄原胶的分子量随发酵液中的溶解氧的浓度增加而增大。黄原胶同威兰胶一样都属于微生物胞外多糖,它由D-葡萄糖、D-甘露糖、D-葡萄糖醛酸、乙酸和丙酮酸聚合而成,分子量达到百万[14]。发酵过程中随着发酵时间的增长,发酵液变黏稠,发酵体系都为高黏发酵,因此借鉴黄原胶此方面的研究将为开展溶氧水平对威兰胶发酵的影响研究提供很好的借鉴意义。
1 材料和方法
1.1 菌株
本实验室自主筛选的产碱杆菌Alcaligenes sp.NX-3,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为 CGMCC2428[9]。经分析鉴定,多糖产物为威兰胶[15]。
1.2 培养基与培养方法
1.2.1 种子液培养基与培养方法
种子培养基(g/L):葡萄糖 20,酵母膏 1,K2HPO42,MgSO40.1,pH 值 7.2~7.4,121 ℃ 灭菌15 min。
培养方法:挑取接种活化后的斜面菌苔2环于种子培养基中,装液量200 mL/1 000 mL,30℃,200 r/min摇瓶培养16 h。
1.2.2 发酵液培养基与培养方法
从西王的创业路径可以看出,这是一家在传统产业色彩颇为浓厚的企业。像大多数的鲁企一样,他们在不知不觉中成为行业巨头,他们将更多的精力放在深耕产业链条上,很少轻易涉足陌生行业。他们更愿低调潜行,不像互联网英雄那样拥有极高的曝光度,其产品的知名度要远远大于创始人的知名度。
发酵培养基(g/L):葡萄糖 50,蛋白胨 4,K2HPO43,MgSO40.1,pH 值 7.2~7.4,121 ℃ 灭菌15 min。
7.5 L发酵罐培养(BioFlo110,美国NBS公司):温度30℃,装液量4.5 L,接种量5%。当研究不同通气量的影响时,将搅拌转速固定在600 r/min,通气量分别控制在:0.5 vvm、1.0 vvm、1.5 vvm。当研究不同搅拌转速的影响时,将通气控制在最佳,转速分别控制为400、600、800 r/min。发酵过程中流加3 mmol/L的NaOH,将pH值控制在7.0。
1.2.3 不同供氧的控制
在7.5 L发酵罐中,将通气控制在最佳,调控搅拌转速400、600、800 r/min,分别定义为低供氧、中供氧和高供氧。
1.3 分析方法
1.3.1 葡萄糖含量的测定
生物传感分析仪(SBA-40C,山东省科学院生物研究所)。
1.3.2 威兰胶含量测定
威兰胶含量测定:称取适量体积的发酵液,蒸馏水稀释,12 000 r/min离心30 min,去除菌体细胞沉淀。上清液加入1/5体积的V(三氯甲烷)∶V(异戊醇)=24∶1混合液,12 00 r/min 离心30 min,去除蛋白质,反复去除2次。上清液用乙醇沉淀威兰胶,60℃烘干,称重[16]。
1.3.3 菌体干重的测定
取5 mL发酵液并适当稀释,于已预先称重的干燥离心管中,8 000 r/min离心20 min,弃上清,用去离子水洗涤2次,105℃烘箱内烘至恒重,称量即可。
1.3.4 威兰胶粘度的测定
威兰胶1% 水溶液,NDJ-1型旋转黏度计(上海恒平科学仪器有限公司),4号转子,60 r/min,25℃测得。
1.3.5 相对溶氧水平(D℃)(%)的测定
由溶氧探头在线测定。
以上实验平行重复3次,误差范围在±4%之间。
2 结果与讨论
2.1 7.5 L发酵罐中,不同通气量对威兰胶发酵的影响

图1 不同通气量对威兰胶发酵的影响
在7.5 L发酵罐中,根据威兰胶发酵的实际情 况,选取了一个比较适中的转速600 r/min,分别研究了0.5 vvm、1.0 vvm、1.5 vvm不同通气量对威兰胶发酵的影响。由图1可以看出,当通气量为0.5 vvm时,发酵液中的溶氧水平较低,一直持续在5%左右,相应的菌体干重,威兰胶浓度和黏度都较低。随着通气量的增加,发酵液中的溶氧水平也有明显的增加,当通气量为1 vvm时,溶氧水平明显提高到10% 以上,菌体生长最快,威兰胶的浓度也最高,达20.6 g/L;葡萄糖的消耗量较通气量0.5 vvm、1.5 vvm高,葡萄糖对威兰胶的转化率提高到0.41 g/g,威兰胶黏度达到2.540 Pa·s(表1)。但当通气量增加到1.5 vvm时,溶氧水平继续增高,但菌体干重、威兰胶浓度和黏度都略有所降低,可能是过高的通气量对菌体的生长产生了不利影响。综上所述,在发酵过程中溶氧水平对威兰胶的发酵有较明显的影响,该过程对氧气的要求是适中的,过低或过高的通气量都会对发酵产生消极的影响。

表1 不同通气量下的葡萄糖转化率、威兰胶黏度比较
2.2 5 L发酵罐中,不同供氧水平对威兰胶发酵的影响
在7.5 L发酵罐中,选定最优通气量1 vvm,分别研究了搅拌转速为400、600、800 r/min 3种供氧水平对威兰胶发酵的影响,实验结果如图2所示。结果显示,当搅拌转速为400 r/min时,菌体生长明显受到低溶氧水平的影响,生物量较低,威兰胶的合成速率也较慢,浓度为 17.5 g/L,威兰胶黏度仅有1.510 Pa·s(表2)。随着搅拌转速的提高(600 r/min),发酵过程中的溶氧水平明显提高,菌体生长速率增大,威兰胶的浓度提高到20.6 g/L,威兰胶黏度也明显增大到2.540 Pa·s。其可能的原因是:搅拌转速高时,发酵液传质、溶氧及氧传递性能得到改善,有利于菌体生长和产物的合成。进一步提高搅拌转速到800 r/min,威兰胶浓度继续增加到22.8 g/L,葡萄糖转化率进一步提高到0.46 g/g,但发酵中后期的菌体浓度有所降低,威兰胶黏度较600 r/min低,降到了2.100 Pa·s。可能是过高的搅拌转速产生了过高的剪切力,对菌体细胞产生了损伤;并且可能把威兰胶延伸链打断,使分子量降低,从而导致发酵液黏度降低。

图2 不同搅拌转速对威兰胶发酵的影响

表2 不同搅拌转速条件下葡萄糖转化率、威兰胶黏度情况
2.3 7.5 L发酵罐中,不同溶氧调控策略对威兰胶发酵的影响
基于以上实验可以发现,在威兰胶发酵过程中溶氧水平对威兰胶的合成有着十分重要的影响,在发酵前期(0~24 h),较高的供氧(800 r/min)有利于菌体的生长和威兰胶的合成。而在发酵中期(24~48 h),供氧(600 r/min)有利于高黏发酵液的形成。在发酵后期(48~72 h),由于发酵液变的更加黏稠,低的转速能够防止高转速对威兰胶分子链的破坏。因此为了同时提高威兰胶的浓度和黏度,比较了2种不同的溶氧调控策略对威兰胶发酵的影响。策略1(前24 h低供氧,24~48 h采用中供氧,48 h至发酵结束采用高供氧);策略2(前24 h高供氧,24~48 h采用中供氧,48 h至发酵结束采用低供氧)。
结果表明,策略1随着发酵时间的增长,菌体浓度增大,溶氧水平急剧下降。当发酵时间为12 h时,溶氧的水平降到最低2.9%,之后溶氧水平一直在5%以下,虽然24 h和48 h提高转速来提高发酵液中的溶氧水平,但菌体的生长速率还是受到明显影响,威兰胶浓度为22 g/L,黏度为2.300 Pa·s(表3)。采用溶氧策略2后,菌体的对数生长期(6~48 h)溶氧水平较策略1有明显的提高,整个发酵过程的溶氧水平一直持续在10%以上,菌体成长速率明显提高,威兰胶的浓度提高到25.4 g/L,葡萄糖残留量为5.5 g/L(图3b),葡萄糖对威兰胶的转化率提高到0.51 g/g,威兰胶黏度明显提高为2.700 Pa·s(表3)。该结果较之前的分批发酵研究水平有所提高[16-17]。
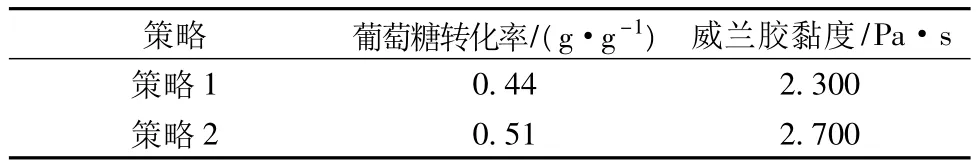
表3 不同溶氧策略下葡萄糖转化率、威兰胶黏度情况
分析可能原因是:先高溶氧,为细胞的生长提供了充足的氧气,这时菌体能量供应充足,菌体生长较快且代谢旺盛,细胞内各种初级代谢物质和次级代谢产物得以充分累积,有利于威兰胶的合成;后期主要以威兰胶的累积为主,对氧气的需求量减少,在不影响威兰胶累积的基础上,后期降低搅拌速度,避免了威兰胶延伸链被过高的搅拌速率产生的过大剪切力打断,有利于威兰胶分子量的提高,提高产品的黏度。

◆菌体干重;●葡萄糖浓度;▲威兰胶浓度;○溶氧水平图3 不同溶氧策略对威兰胶发酵的影响
分析以上结果发现,对数生长期初期(6~24 h)的溶氧水平对威兰胶的发酵有着重要的影响。此时期菌体大量增长,菌体代谢比较旺盛,对溶氧的需求急剧增加,致使发酵液中溶氧水平迅速降低;但是如果此时溶氧水平过低,会严重限制菌体的增殖,并造成不可逆的不利影响。可能是过低的溶氧严重影响了菌体的能量代谢和正常生理代谢,进一步影响了威兰胶合成途径中部分关键酶的合成,从而对威兰胶的累积造成了不可逆的影响。
3 结论
(1)通气量1 vvm有利于威兰胶浓度的提高,过低或过高的通气量都会对发酵产生消极影响。
(2)提高搅拌转速可以提高威兰胶的浓度,搅拌转速800 r/min时,威兰胶浓度达到22.8 g/L,但是此时的威兰胶黏度较 600 r/min时低,仅为2.100 Pa·s。
(3)在Alcaligenes sp.NX-3发酵生产威兰胶中,溶氧水平对其有着重要的影响,尤其是对数生长期尤为重要;采用高供氧-中供氧-低供氧调控方法,使威兰胶的浓度和黏度都有了明显的提高:浓度提高到25.4 g/L,葡萄糖对威兰胶的转化率提高到0.51 g/g,威兰胶黏度提高到2.700 Pa·s。
溶氧对威兰胶合成的影响的深层机理还不清楚,但该研究为下一步借助于代谢工程和酶工程的方法,深入研究溶氧水平对威兰胶合成代谢途径及威兰胶分子量的影响奠定了基础。
[1] Kang K S,Veeder G T,Cottrell I W.Some novel bacterial polysaccharides of recent development[J].Porg Ind Microbial,1983,18:231 -253.
[2] Chandrasekaran R,Radha A,Lee E J.Structural roles of calcium ions and side chains in welan:an xray study[J].Carbohydr Res,1994,252:183 -207.
[3] Pollock T J.Gellan related polysaccharides and the genus Sphingomonas[J].Gen Microbiol,1993,139:1939 -1945.
[4] Floyd L,Allen,Glen H.Welan gum in cement compositions[P].US,4963668,1990.
[5] Takahashi,Kozo,Sugiura,et al.Oil absorption retarder[P].US,6497910,2002.
[6] Hoskin D H,Mitchell T O,Shu P.Oil reservoir permeability profile control with crosslinked welan gum biopolymers[P].US:4991652,1991.
[7] 赵东峰,梁春艳,任翔,等.溶氧对生物转化泰乐菌素为其酰化物的影响[J].中国医药工业杂志,2006,37(3):162-164.
[8] 徐虹,李莎,郭朝江,等.一种产碱杆菌及其在制备威兰胶中的应用[P].CN,1888054,2007.
[9] 郭朝江.低能N+注入威兰胶生产菌诱变选育及发酵工艺优化[D].南京:南京工业大学,2007.
[10] 李会,李莎,徐虹,等.Alcaligenes sp.NX-3产威兰胶的补料分批发酵工艺研究[J].食品与发酵工业,2009,35(1):1 -4.
[11] 林剑,郑舒文,徐世艾.搅拌与溶氧对黄原胶发酵的影响[J].中国食品添加剂,2003(2):63-65.
[12] 花璟薇.黄原胶发酵条件的研究[J].浙江食品工业,2000,2(2):16 -221.
[13] Flores F,Tores L G,Galindo E.Effect of the dissolved oxygen tension during cultivation of X.Campestris on the production and quality of xanthan gum [J].J Biotechnol,1994,34(2):165 -173.
[14] Rosalam S,England R.Review of xanthan gum production from unmodified starches by Xanthomonas comprestris sp.[J].Enzyme Microb Techno,2006,39(2):197 -207
[15] 李莎,徐虹,姜岷.产碱杆菌NX-3胞外多糖的结构与性能[J].微生物学通报,2005,32(6):37 -41.
[16] 李会,李莎,冯小海,等.Alcaligenes sp.NX-3产威兰胶的补料分批发酵工艺研究[J].食品与发酵工业,2009,35(1):1-4.
[17] 郭建军,李建科,陈琳,等.韦兰胶生产菌的选育[J].食品工业科技,2009,30(2):126-128.
Effect of Dissolved Oxygen Control Strategies on Welan Gum Fermentation by Alcaligenes sp.NX-3
Wan Ping1,Li Hui2,Xu Hao2,Chen Fei2,Xu Hong2
1(Faculty of Biotechnology Industry,Chengdu University,Chengdu 610106,China)2(State Key Laboratory of Materials-oriented Chemical Engineering,Nanjing University of Technology,Nanjing 210009,China)
The dissolved oxygen control in the production of welan gum by Alcaligenes sp.NX-3 was investigated.Firstly,based on the analysis of the effect of various aeration rate on cell growth,welan gum concentration,glucose consumption,dissolved oxygen level,and welan gum viscosity,we confirmed that in a 7.5 L bioreactor 1 vvm aeration rate was beneficial for welan gum production.After that,the effect of different oxygen supply levels on the welan gum fermentation was studied.The results indicated that high oxygen supply level could improve the welan gum production,but it was not helpful for welan gum viscosity.Therefore,the two oxygen supply strategies:low-moderatehigh oxygen supply level and high-moderate-low oxygen supply level were proposed.The results showed that the latter was better for the welan gum fermentation.Finally,the maximum concentration of welan gum reached 25.4 g/L with a yield of 0.51 g/g and the welan gum viscosity of 2.700 Pa·s .
welan gum,Alcaligenes sp.NX -3,dissolved oxygen control strategy
副教授(徐虹教授为通讯作者)。
*江苏省普通高校研究生科技创新计划(CX10B_183Z);江苏省农业科技自主创新基金(CX(10)226);国家科技支撑项目“十二五”农村领域(2011BAD23B00)。
2010-07-07,改回日期:2011-03-01
