一株嗜热菌的分离、鉴定及海藻糖合成酶基因的克隆
2011-11-24王慧荣韦宇拓黄日波
王慧荣 韦宇拓,黄日波
(1.浙江省环境保护科学设计研究院,中国 杭州 310007;2. 广西大学生命科学与技术学院,中国 南宁 530005;3.广西科学院,中国 南宁 530003)
自从在水生栖热菌里发现了DNA聚合酶,促进了生物学发展和嗜热酶的商业开发和应用以后,人们不断寻找新的嗜热菌,不仅为了研究嗜热菌的嗜热机理,更多的是寻找有应用价值的嗜热酶.由于嗜热酶有热稳定性和在高温下有最佳活力的特点,在造纸工业、环护、能源利用、烟草业、石油开采、液体燃料的生产、生物转化及抗生素生产等领域都有广泛的应用[1-2].嗜热酶的广泛应用促使人们不断寻找新的嗜热菌.海藻糖(trehalose)是细胞在不良环境中所产生的一种重要的抗逆应激物,在环境胁迫条件下对生命体和生物活性物质具有保护功能,在食品工业、农业、医药工业、分子生物学等领域有广泛的应用前景[3].虽然目前,已从ThermusaquaticusATCC33923、ThermusthermophilusHB8等多种嗜热菌中克隆了海藻糖合成酶编码基因(treS),并且进行了异源表达[4-5].但是嗜热菌来源的海藻糖合成酶分子量一般较大,表达量不高,需要解决密码子偏爱性等问题以提高在大肠杆菌中的表达量.由于海藻糖合成酶三维晶体结构的研究还未见报道,缺乏足够的数据详细阐述它的催化机理,通过空间分子结构的改造来改善酶学性质的研究有一定的困难,目前亟需大量的关于海藻糖合成酶的序列、结构和生物学特性等相关数据.
本文从广西热泉中分离到一株嗜热菌,初步鉴定它为Thermusthermophilus,对该菌的海藻糖合成酶基因进行了初步探索,为构建高产海藻糖合成酶的工程菌提供理论基础及重要的实验依据;另一方面,也进一步丰富不同微生物中该酶基因序列和结构方面的信息.
1 材料和方法
1.1 样品采集与处理
从广西贺州市西鸡镇80 ℃,pH为6.7,含盐量2 g/L的热泉中采集水样和泥样.水样以12 000 r/min离心10 min,收集菌体;泥样用泉水彻底悬浮后,以500 r/min离心2 min,去除大颗粒的杂质,然后再用处理水样的方式处理上清液富集菌体.
1.2 菌株、载体及试剂
大肠杆菌JM109由本实验室保存,PCR产物纯化试剂盒和胶回收试剂盒购自上海华舜生物工程有限公司,限制性内切酶,T4DNA连接酶,pMD 18-T vector购自宝生物工程(大连)有限公司,其他试剂均为国产分析纯.
1.3 培养基
分离培养基[6]:NaCl 1 g,MgCl2·6H2O 1 g,MgSO4·7H2O 0.15 g,CaCl20.23 g,KCl 0.5 g,KH2PO40.42 g,(NH4)2SO40.1 g,NaBr 0.05 g,SrCl2·6H2O 0.02 g,NaHCO31 g,Yeast extract 1 g,Tryptone 1 g,肉汁胨0.5 g,FeCl3(100 g/L) 10 mL,1 000×Vitamin Solution 10 mL,Trace element solution 1 mL,NaOH调pH值至7.0,1×105Pa 灭菌30 min.Vitamin Solution用0.45 μm滤膜过滤,固体培养基加20 g琼脂.
1.4 嗜热菌的分离与培养
取处理好的样品直接涂布于固体培养基上,分别置于75 ℃和80 ℃培养箱中培养,待菌落长出后,挑取单个菌落进行划线培养,分别置于85 ℃,86 ℃,87 ℃下培养24~48 h.筛选能在最高温度下生长的菌,从而实现菌株的分离与纯化.为防止温度过高在培养过程中平板脱水干裂,在培养时将平板倒置放在一个10 L的玻璃器皿中,里面放置1杯水,每天定期打开玻璃器皿通氧.
1.5 形态观察和培养条件
1.5.1 形态观察 固体培养基上培养了24~48 h的单菌落,用电子显微镜观察细胞形态,革兰氏染色光学显微镜观察.
1.5.2 培养温度 接种一个单菌落到10 mL液体培养基中,培养使其OD600达到0.6~0.8时,以2%的接种量接种到100 mL,pH为7.0的液体培养基中,在220 r/min条件下,分别置于55、60、65、70、75、80、85 ℃下,每隔2 h取1.5 mL菌液测定OD600.
1.5.3 培养pH值 同样以2%的接种量接种到100 mL, pH值分别为5.5,6.0,6.5,7.0,7.5,8.0,8.5,9.0的液体培养基中,70 ℃,220 r/min条件下,每隔2 h取1.5 mL菌液测定OD600.
1.5.4 NaCl浓度的测定 以2%的接种量接种到100 mL NaCl质量浓度分别为0,4,8,10,12 g/L,pH值为7.0的液体培养基中,在75 ℃,220 r/min条件下培养.每隔2 h取1.5 mL菌液测定OD600.
1.6 G+C 物质的量浓度和抗生素敏感性的测定
用溶解温度(Tm)法[7],参照文献[8] 的浓度进行测定.
1.7 16S rRNA基因的PCR扩增、序列测定和系统发育分析
取对数期的菌液,离心后收集菌体,CTAB法提取总DNA.依照细菌16S rRNA基因扩增的通用引物:F27(5-AGAGTTTGATCCTGGCTCAG-3),R1522(5-AAGGAGGTGATCCAGCCGCA-3),以TTH总DNA为模板,PCR反应条件:94 ℃变性4 min,94 ℃ 1 min,60 ℃ 1 min,72 ℃ 1.5 min,共25个循环,72 ℃延伸6 min.PCR产物纯化后连接到 pMD 18-T vector,经过抽提质粒和酶切验证酶连接产物正确,委托上海基康生物技术有限公司进行测序.将得到的16S rRNA序列与GenBank中的核酸数据进行BLAST比对,选取与其同源性达到98%的相关序列.采用软件ClustalX对所获得的核苷酸序列进行序列比对,用软件MEGA4.1计算出序列的系统进化距离,采用邻位相连法构建系统进化树.
1.8 treS基因的扩增
根据GenBank中已公布的模式菌株ThermusthermophilusHB8的treS基因序列设计引物,引物1:5′- TGGTAAACCCGCTCCCACAG -3′,引物2:5′- TGCCTGGGCACGGAAAAGAA-3′.以TTH总DNA为模板,PCR条件为94 ℃ 5 min; 94 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 2 min, 30个循环后72 ℃延伸10 min.PCR产物经琼脂糖凝胶电泳验证后进行胶回收,与pMD 18-T vector 4℃过夜连接,将连接产物转化E.coliJM109,蓝白斑筛选,筛选阳性克隆,菌落PCR检测目的条带,提取阳性菌的质粒.酶切鉴定,测序由上海基康生物技术有限公司完成.

图1 菌株TTH的电镜照片(×10 000)
2 结果
2.1 形态和培养特征
菌株TTH为革兰氏阴性的杆状细胞,大小为(0.4~0.6)μm×(3.0~4.5)μm,无鞭毛、芽孢.培养48 h的菌落呈圆形,中间稍有凸起,边缘整齐,表面光滑,有光泽,浅黄色,不透明.电镜照片见图1.
2.2 温度对TTH生长的影响
菌株TTH的生长温度范围是55 ℃~85 ℃,低于55 ℃,高于85 ℃都不生长,在55 ℃,85 ℃下生长极度贫乏,最适生长温度是70 ℃左右,培养约12 h进入稳定期.结果见图2.
2.3 pH对TTH生长的影响
菌株TTH生长pH值的范围是5.0~9.0,在5.0,5.5和9.0下生长十分缓慢,低于5.0,高于9.0条件下不生长.最适的生长pH值为6.5~7.5,结果见图3.

图2 温度对菌株TTH生长的影响
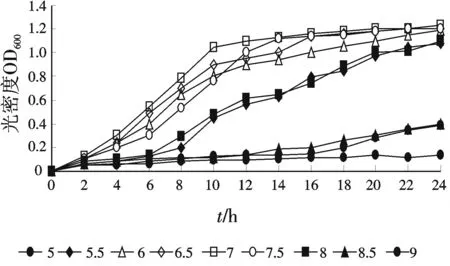
图3 pH对菌株TTH生长的影响

图4 NaCl质量浓度对菌株TTH生长的影响
2.4 NaCl对TTH生长的影响
TTH菌株生长的NaCl质量浓度范围是0~12 g/L,在12 g/L NaCl浓度下生长贫乏,大于12 g/L NaCl不生长,最适的NaCl浓度是0~4 g/L.结果见图4.
2.5 G+C物质的量分数和抗生素敏感性
菌株TTH的G+C物质的量分数为67.6%.参照文献[9],加氨苄青霉素、氯霉素到液体培养基中,使其终浓度为10 mg/L,70 ℃,24 h未见生长.在加了链霉素、卡那霉素的培养基中,链霉素、卡那霉素的终浓度在50 mg/L时,菌株都可以生长.四环素10 mg/L时不抑制生长,100 mg/L时可完全抑制生长.
2.6 以16S rRNA序列为基础的系统发育分析
菌株TTH 16S rRNA全序列总共1 478个碱基,在GenBank登录号为EU616794.1.将其序列在GenBank中进行BLAST比较,发现菌株TTH与多株栖热菌属(Thermus)的16S rRNA序列同源性高达98%,依据此结果,菌株可归属于栖热菌属(Thermus).选择BLAST比对结果中相似度最高的5条16S rRNA,利用ClustalX 1.8和 MEGA4.1软件,采用邻位相连法构建系统发育树.图5表明菌株TTH与Thermusthermophilus的3株菌在同一族上,其中与ThermusthermophilusXM、Thermusthermophilusit-1、Thermusthermophilus这3株菌的同源性高达98%,结合形态学观察、生理生化特征指标测定及16S rRNA序列分析结果,确定菌株TTH是栖热菌属中的Thermusthemophilus.

图5 菌株TTH的系统发育进化树

1: treS gene; M: DL2000 Marker图6 PCR产物琼脂糖凝胶电泳
2.7 treS基因的扩增
以TTH的总DNA为模板,采用引物1和引物2进行PCR扩增treS基因,对PCR产物进行琼脂糖凝胶电泳分析,结果如图6所示.
从图6中可以看出PCR扩增出了约1 200 bp的片段,将PCR产物与pMD 18-T vector连接后,转化E.coliJM109,蓝白斑筛选,菌落PCR和酶切验证正确后,对treS基因进行测序,其结构基因全长为1 250 bp,GenBank accession:GQ175175,测序结果在GenBank中Blast进行比对,发现它与菌株ThermusthermophilusRQ-1,Thermuscaldophilus,ThermusthermophilusHB8,Thermusthermophilus的treS基因的同源性最高可达87%,作者克隆的该菌的treS基因有可能是海藻糖合成酶的同源基因,treS基因的获得为TTH菌株完整的treS基因的克隆奠定了基础.
3 讨论
早在1971年日本人就从当地55 ℃~85 ℃的热泉中分离到了Thermusthemophilus,从此对该菌进行了大量的研究,但是已知的Thermusthemophilus大多从海洋热泉中分离得到,能够耐盐[10].本文从陆地热泉中分离的TTH菌株生长的NaCl质量浓度范围是0~12 g/L,在12 g/L NaCl浓度下生长贫乏,NaCl浓度大于12 g/L时不生长,最适的NaCl浓度是0~4 g/L.在Thermusthemophilus里有好氧菌和厌氧菌,菌株TTH是好氧菌,文献中HB27只能在好氧条件下生长,HB8不仅可在好氧条件下生长,还能在硝酸盐存在的条件下厌氧生长.与TTH硝酸盐还原反应阴性相一致,可见在自然界中存在多种不同的Thermusthemophilus菌株[11].由此可以看出嗜热微生物资源相当丰富,还有很大的探索空间,筛选出更多的嗜热菌不仅可以丰富嗜热微生物资源,还为研究嗜热菌机理提供了实验素材.
本实验室通过DNA Shuffling技术寻求新的耐高温海藻糖合成酶基因的研究已经多年,从已报道的Thermusthermophilus不同菌株中克隆了海藻糖合成酶基因[12],但是从嗜热菌TTH中克隆的treS基因与这些菌中存在的海藻糖合成酶基因还是有差异的,且测定的序列与已报道的ThermusthermophilusRQ-1,Thermuscaldophilus,ThermusthermophilusHB8,Thermusthermophilus的treS基因的同源性最高达87%,由此作者认为Thermusthermophilus的treS基因序列既有保守性,又有在不同环境条件胁迫下产生的进化差异性.对菌株TTH的treS基因序列进行进一步的分析,将会为理解该酶的作用机制,以及该酶在不同细菌中的进化演变情况提供有价值的参考.
参考文献:
[1] LI J B, XU L M, YANG F. Expression and characterization of recombinant thermostable alkaline phosphatase from a novel thermophilic bacteriumThermusthermophilusXM[J].Acta Bioch Bioph Sin, 2007,39(11):844-850.
[2] MITSUNORI I, SATOSHI K, ATSUSHI K,etal. Purification and characterization of the recombinantthermussp. strain T2α-galactosidase expressed inEscherichiacoli[J]. Appl Environ Microb, 2001,67(4):1601-1606.
[3] EIBEIN A D, PAN Y T, PASTUSZAK I,etal. New insights on trehalose: a multifuntional molecule[J].Glycobiol,2003, 60(13):17-27.
[4] TSUSAKI K, NISHIMOTO T, NAKADA T,etal. Cloning and sequencing of trehalose synthase gene fromthermusaquaticusATCC33923[J].Acta Bioch Bioph Sin, 1997,1334(45):28-32.
[5] ZDZIEBLO A, SYNOWIECKI J. Production of trehalose by intramolecular transglucosylation of maltose catalysed by a new enzyme fromThermusthermophilusHB-8[J]. Food Chem, 2006,96(6):8-13.
[6] WOESE C R, KANDLER O, WHEELIS M L. Towards a natural system of organisms: Proposal for the domains Archaea, Bacteria, and Eucarya[J]. Proc Natl Acad Sci USA,1990, 87:4576-4579.
[7] 阮继生,刘志恒,梁丽糯,等. 放线菌研究及应用[M]. 北京: 科学出版社, 1990.
[8] J.萨姆布鲁克,E.F.弗里奇.分子克隆实验指南[M].金冬雁,黎孟枫,译.2版.北京:科学出版社,2001:548.
[9] 王慧荣,韦宇拓,黄日波.一个新型嗜热菌质粒的测序鉴定及抗生素抗性研究[J].湖南师范大学自然科学学报,2010,33(2):102-106.
[10] SANDRA T M, FRENANDA N, FRED A R,etal.Thermonemarossianumsp. Nov., a new thermophilic and slightly halophilic species from saline hot springs in Naples, Italy[J]. Int J Syst Bacterilol, 1997,47(1):122-126.
[11] FELIPE C, OLGA Z, AXEL M,etal. A new type of NADH dehydrogenase specific for nitrate respiration in the extreme thermophilethermusthermophilus[J]. J Biol Chem, 2004, 29(24):45369-45378.
[12] 韦传东.海藻糖合成酶基因的融合表达、纯化以及酶学性质研究[D]. 南宁:广西大学,2006.
