醋酸泼尼松龙醇质体的制备及其药剂学性质考察
2011-11-23吕青志刘德胜李珂珂陈向明杜雨蒙滨州医学院药学院烟台市264003
吕青志,刘德胜,李珂珂,陈向明,杜雨蒙(滨州医学院药学院,烟台市 264003)
醋酸泼尼松龙醇质体的制备及其药剂学性质考察
吕青志*,刘德胜,李珂珂,陈向明,杜雨蒙(滨州医学院药学院,烟台市 264003)
目的:制备醋酸泼尼松龙醇质体并考察其药剂学性质。方法:采用乙醇注入法制备醇质体。以包封率为指标,以处方中药物与大豆磷脂质量比(A)、胆固醇与大豆磷脂质量比(B)、无水乙醇占处方总量的百分比(C)为考察因素进行正交设计优化处方;考察优化后处方所制醇质体的形态、粒径、Zeta电位、包封率、稳定性等,差示量热分析法考察其热力学特性。结果:最佳处方为A 1∶20,B 1∶6、C 30%;以此处方制备的醇质体外形圆整光滑,平均粒径为(278.5±46.7)nm,Zeta电位为(-31.6±0.04)mV,平均包封率为(76.79±0.29)%,贮藏30d稳定性较好。差示量热分析法结果表明,醋酸泼尼松龙以无定形状态包封于醇质体中。结论:醋酸泼尼松龙醇质体制备工艺简单,优化处方所制制剂药剂学性质符合要求。
醋酸泼尼松龙;醇质体;制备;药剂学性质;包封率;差示量热分析
在透皮给药系统中,致密的角质层结构是药物透过皮肤的最大屏障[1]。为了突破角质层的屏障,有学者通过研究[2,3]发现了一种新型的柔性脂质体——醇质体(Ethosome),其是一种由磷脂、乙醇、水组成的,具有脂质双分子层结构的新型囊泡给药载体,能够增加药物的透皮速率和皮肤滞留药物量。醋酸泼尼松龙(Prednisolone acetate,PA)为肾上腺皮质激素类药物,具有抗炎、抗过敏和抑制免疫等多种药理作用,临床主要用于活动性风湿、类风湿性关节炎的治疗。目前国内该药的制剂有注射液、片剂和滴眼液。但长期全身给药可引起库欣综合征及并发感染等不良反应,因此,患者对其顺应性较差[4]。笔者将PA制备成醇质体透皮给药制剂,通过提高其透皮渗透速率和透皮渗透量,维持病变部位较高的药物浓度,以期减少全身治疗引起的不良反应,提高患者的顺应性。本次制备的PA醇质体混悬液药物含量为1mg·mL-1,拟进一步浓缩制备成凝胶剂以满足临床用药需要及提高给药的便利性。
1 仪器与试药
Waters 600-2489高效液相色谱(HPLC)仪(美国Waters公司);EL204高精度电子分析天平、TGA/DSC1同步热分析仪(瑞士梅特勒-托利多公司);旋转蒸发仪(上海亚荣生化仪器设备有限公司);SH23-2恒温磁力搅拌器(上海梅颖浦仪器仪表制造有限公司);KQ5200DB型数控超声波清洗器(江苏昆山市超声仪器有限公司);TU-1901紫外-可见分光光度计(北京普析通用仪器有限公司);超滤管(美国Millipore公司);LD4-2A低速离心机(北京医用离心机厂);JEM-1400电子透射显微镜(日本电子株式会社);激光粒度分析仪(美国Sarta Barbara公司)。
PA原料药及对照品(河南利华制药有限公司,批号:K07A20091003,含量:99.4%);大豆磷脂(上海太伟药业有限公司,批号:081012);胆固醇(上海化学试剂采购供应站分装厂,批号:20070112);PA醇质体(自制,规格:1mg·mL-1);甲醇为色谱纯,其余试剂均为分析纯。
2 方法与结果
2.1 PA醇质体混悬液的制备
参照文献[5,6],采用乙醇注入法制备PA醇质体。称取PA 10mg、大豆磷脂250mg、胆固醇50mg溶于3.0mL的无水乙醇中,置于磁力搅拌器上,在35℃、700r·min-1的密闭条件下,边搅拌边缓慢细流注入6.8mL磷酸盐缓冲液(pH6.8)中,注完后继续搅拌30min,经0.45µm微孔滤膜整粒,即得混悬液。
2.2 正交设计法优化处方
参照文献[7,8],选取对包封率影响较大的3个因素,即药物与大豆磷脂质量比(即药脂比,A)、胆固醇与大豆磷脂质量比(B)、无水乙醇占处方总量(10mL)的百分比(C)作为考察因素,每个因素取3个水平,见表1;以包封率为优化指标,采用L9(34)设计表进行处方筛选,结果见表2,方差分析结果见表3。

表1 因素水平表Tab 1 Factors and levels
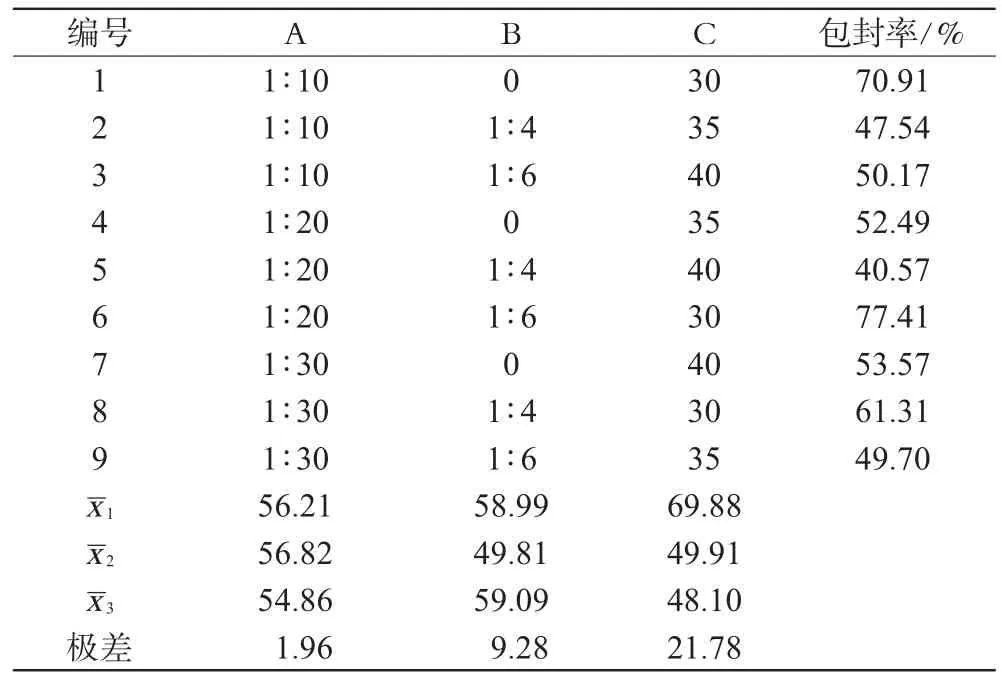
表2 正交试验设计结果Tab 2 Results of orthogonal design

表3 方差分析结果Tab 3 Results of analysis of variance
由表2直观分析结果表明,影响PA醇质体包封率的各因素的主次关系依次为:C>B>A,确定PA醇质体的较优处方为A2B3C1。
方差分析与直观分析结果基本相符,因此,筛选得PA醇质体的最优处方为:药脂比为1∶20,胆固醇与大豆磷脂比为1∶6、无水乙醇百分含量为30%。按照最优处方制备PA醇质体3批,进行以下药剂学性质评价。
2.3 外观形态
取PA醇质体混悬液加适量蒸馏水稀释,滴至铜网上,用1%磷钨酸溶液负染,自然干燥后在透射电镜下观察其微观形态。结果,PA醇质体为近球状小囊泡,外形圆整光滑,详见图1。
2.4 粒径及Zeta电位
取PA醇质体混悬液以适量蒸馏水稀释,采用激光粒度分析仪测定醇质体的粒径及粒径分布,测得平均粒径为(278.5±46.7)nm,粒径分布见图2。

图1 PA醇质体的透射电镜照片(×20000)Fig 1 Transmission electron microphotography of PA-ethosomes(×20000)
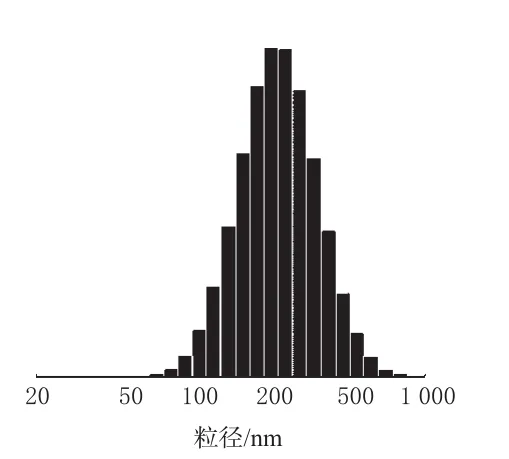
图2 PA醇质体的粒径分布图Fig 2 Particle size distribution of PA-ethosomes
测定PA醇质体Zeta电位,结果为(-31.6±0.04)mV。
2.5 包封率的测定
2.5.1 色谱条件。色谱柱:Hypersil ODS-2C18(250mm×4.6mm,5μm);流动相:甲醇-水(55∶45);检测波长:243nm;流速:1.0mL·min-1;进样量:20μL;柱温:室温。
2.5.2 标准曲线的建立。制备浓度为100µg·mL-1的PA甲醇贮备液,用流动相稀释至0.5、1.0、2.0、3.0、4.0、5.0、10.0µg·mL-1的对照品溶液,经0.22μm微孔滤膜滤过,进样,以PA的峰面积(Y)与浓度(c)作图,用最小二乘法回归,得线性方程:Y=45851c+3037.3(r=0.9996),表明PA检测浓度线性范围为0.5~10.0µg·mL-1。另制备高、中、低浓度的样品液,测定其日内RSD分别为0.85%、0.57%、0.94%,日间RSD分别为0.63%、1.10%、1.40%;平均回收率为97.3%。
2.5.3 包封率(EE)的测定。采用超滤管法分离游离药物后,HPLC法测定。取适当稀释后的PA醇质体混悬液2mL置于超滤管(10kDa)中,4000r·min-1离心1h,测定下层水相中PA浓度,得游离药物量(Wfree);取PA醇质体混悬液0.1mL,置于10mL容量瓶中,加入甲醇至刻度,超声15min破乳,测得总药量(Wtotal)。按公式(1)计算包封率[9,10]:

测得3批PA醇质体的包封率分别为76.94%、76.43%、77.01%,平均包封率为(76.79±0.29)%。
2.6 稳定性考察[4]
将制备的PA醇质体混悬液灌封于安瓿中,分别于室温(25℃)、冷藏条件(4℃)放置,于0、10、20、30d取样,测定放置前、后的游离药物量,按公式(2)计算渗漏率(TR),结果见表4:

式中,Wfree1为贮存后测得的游离药物量,Wfree为贮存前测得的游离药物量,Wtotal为PA醇质体混悬液中的总药量。

表4 稳定性试验结果Tab 4 Results of stability experiments
表4结果表明,在冷藏条件下,PA醇质体渗漏率未见显著变化,稳定性较好。
2.7 差示量热分析(DSC)
分别取PA原料药、胆固醇、蔗糖(冻干保护剂)、大豆磷脂、PA醇质体(冻干)及除PA醇质体外的前述4种成分的物理混合物各约10mg,精密称定,置于铝盘中,扫描。扫描区间:30~400℃,扫描速率:10℃·min-1。扫描图谱见图3。
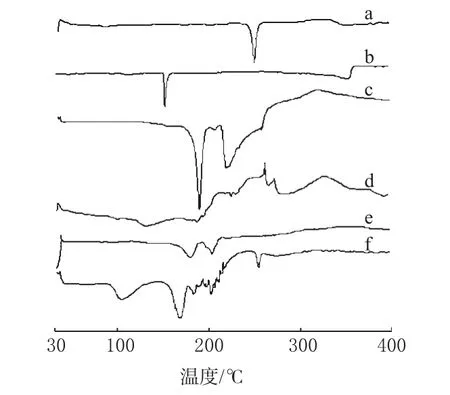
图3 DSC图谱a.PA原料药;b.胆固醇;c.蔗糖;d.大豆磷脂;e.PA醇质体;f.物理混合物Fig 3 DSC thermogramsa.PA crude drug;b.cholesterol;c.sucrose;d.soybean lecithin;e.PA-ethosome;f.physical mixture
由图3可见,PA原料药在248.6℃有吸热峰,制成物理混合物后,其吸热峰减弱且峰强度变小;而在PA醇质体中,其吸热峰完全消失。DSC未检测到结晶型的PA,表明PA以无定形的状态而非结晶状态包封于醇质体中,这可能是由于在制剂过程中大豆磷脂抑制了PA结晶形成所致[11,12]。
3 讨论
本试验采用乙醇注入法制备醇质体,所用设备简单,易于操作,重现性好,便于推广使用。制备的脂质体粒径小而均匀,包封率高,稳定性好。
醇质体包封率的测定方法主要有超滤管法、凝胶过滤法、透析法、超速离心法。采用超滤管法分离游离药物与醇质体,HPLC法测定药物含量及包封率,该法操作简便、快捷可靠。选用渗漏率为指标考察了PA醇质体的稳定性,结果表明,醇质体在室温下贮存渗漏率较高,稳定性较差,这主要是由于较高的温度加速了磷脂的氧化水解,使脂质膜流动性增加,易于发生聚集和黏连所致。随着粒子的聚集,脂质材料沉淀,药物泄露到分散介质中,因此渗漏率增大,化学稳定性降低。
本试验醇质体中乙醇含量为30%,高浓度的乙醇可增加药物在角质层的溶解度,增强角质层的流动性,还能增强醇质体膜的柔性,使其在透皮传递过程中发生变形,更易透过紊乱的角质层。研究[3]认为醇质体(乙醇含量为30%~45%)对家兔没有急性及长期刺激性。醇质体作为一种新的透皮给药载体,具有高变形性、高包封率,能够显著提高药物的透皮速率和透皮量[13]。但关于PA醇质体的透皮渗透性有待后续的实验考察。
[1] López-Pinto JM,González-Rodríguez ML,Rabasco AM.Effect of cholesterol and ethanol on dermal delivery from DPPC liposome[J].Int J Pharm,2005,298(1):1.
[2] Godin B,Touitou E.Mechanism of bacitracin permeation enhancement through the skin and cellular membranes from an ethosomal carrier[J].J Control Release,2004,94(2-3):365.
[3] Nava D,Touitou E.Carriers for skin delivery of trihexyphenidyl HCl:ethosomes vs.liposomes[J].Biomaterials,2000,21(18):1879.
[4] 王 馨,黄 华.醋酸泼尼松龙固体脂质纳米粒的试制[J].中国医药工业杂志,2007,38(7):499.
[5] Touitou E,Dayan N,Bergelson L,et al.Ethosomes-novel vesicular carriers for enhanced delivery:Characterization and skin penetration properties[J].J Control Release,2000,65(3):403.
[6] 刘凤涛,贺 蓉,赵远党,等.5-氟尿嘧啶乙醇脂质体的改性及其透皮吸收研究[J].中国药房,2008,19(25):1938.
[7] 杨 飞,李 芳,焦海胜,等.秋水仙碱醇质体的制备及体外经皮渗透研究[J].中国药学杂志,2009,44(5):349.
[8] 刘朋飞,孙业欣,彭 伟,等.脱氧氟尿苷脂质体的制备及其质量评价[J].中国药房,2009,20(31):2349.
[9] Teeranachaideekul V,Souto EB,Junyaprasert VB,et al.Cetyl palmitate-based NLC for topical delivery of coenzyme Q10---Development,physicochemical characterization and in vitro release studies[J].Eur J Pharm Biopharm,2007,67(1):141.
[10] Lü Q,Yu A,Xi Y,et al.Development and evaluation of penciclovir-loaded solid lipid nanoparticles for topical delivery[J].Int J Pharm,2009,372(1-2):191.
[11] Sun W,Zhang N,Li A,et al.Preparation and evaluation ofN3-O-toluyl-fluorouracil-loaded liposomes[J].IntJ Pharm,2008,353(1-2):243.
[12] Morissettea SL,Almarsson O,Peterson ML,et al.Highthroughput crystallization:polymorphs,salts,co-crystals and solvates of pharmaceutical solids[J].Adv Drug Deliv Rev,2004,56(3):275.
[13] Godin B,Touitou E,Rubinstein E,et al.A new approach for treatment of deep skin infections by an ethosomal antibiotic preparation:an in vivo study[J].J Antimicrob Chemother,2005,55(6):989.
Preparation and Pharmaceutical Property of Prednisolone Acetate Ethosomes
OBJECTIVE:To prepare Prednisolone acetate ethosomes,and to evaluate their pharmaceutical property.METHODS:Prednisolone acetate loaded ethosomes were prepared with ethanol injection method.The formulation of ethosomes was optimized by orthogonal experiment with weight ratio of drug to soybean lecithin(A),weight ratio of cholesterol to soybean lecithin(B),ethanol concentration(C)as factors and using encapsulation efficiency as index.The morphology,particle size,Zeta potential,entrapment efficiency and stability of prepared ethosomes were determined.The thermal behaviors were investigated by differential scanning calorimetry(DSC).RESULTS:The optimal formulation was as follows:A was 1∶20,B was 1∶6,and C was 30%.The obtained ethosomes were spherical,the mean size and Zeta potential were(278.5±46.7)nm and(-31.6±0.04)mV,respectively.The entrapment efficiency of prednisolone acetate in ethosomes was(76.79±0.29)%.The ethosomes were stable within 30days.DSC study showed that the prednisolone acetate encapsulated in ethosomes was in the amorphous form.CONCLUSION:The preparation technology is simple and convenient,and optimal formulation is up to the requirements of pharmaceutical property.
Prednisolone acetate;Ethosome;Preparation;Pharmaceutical property;Entrapment efficiency;Differential scanning calorimetry
R943;R977.1+1
A
1001-0408(2011)33-3123-03
*助教,硕士。研究方向:药物新剂型与新技术。电话:0535-6913409。E-mail:tidyno1@126.com
2010-12-15
2011-02-12)