(Ca1-x-y Lu y)M oO4∶x Eu3+红色荧光粉的化学共沉淀合成与光致发光
2011-11-13杨玉玲黎学明冯文林李武林陶传义
杨玉玲 黎学明*,, 冯文林 李武林 陶传义
(1重庆大学化学化工学院,重庆 400044) (2重庆大学光电工程学院,光电技术及系统教育部重点实验室,重庆 400044) (3重庆理工大学应用物理学院,重庆 400044)
(Ca1-x-yLuy)M oO4∶x Eu3+红色荧光粉的化学共沉淀合成与光致发光
杨玉玲1黎学明*,1,2冯文林3李武林2陶传义2
(1重庆大学化学化工学院,重庆 400044) (2重庆大学光电工程学院,光电技术及系统教育部重点实验室,重庆 400044) (3重庆理工大学应用物理学院,重庆 400044)
使用NH4HCO3-NH3·H2O混合沉淀剂,采用化学共沉淀法合成(Ca1-x-yLuy)MoO4∶x Eu3+红色荧光粉,通过XRD、EDS、荧光光谱和CIE色度图研究该荧光粉的晶体结构、成分组成及发光性能。结果表明,实验按照理论化学计量比成功合成了(Ca1-x-yLuy)MoO4∶x Eu3+红色荧光粉,该荧光粉为CaMoO4白钨矿结构;(Ca1-x-yLuy)MoO4∶x Eu3+具有7F0→5L6(394 nm)和7F0→5D2(465 nm)的强电子吸收,且在613 nm处可发射高强度红光,其色坐标为(0.666 5,0.332 9),明显优于传统的Y2O2S∶Eu3+红色荧光粉;此外,当Lu含量为30mol%时,荧光粉发光强度最佳。
(Ca1-x-yLuy)MoO4∶x Eu3+;化学共沉淀;发光;红色荧光粉
荧光转换型白光发射二极管(W-LED)具有高效节能、无污染、寿命长等优点,正逐渐取代传统的白炽灯、荧光灯,将成为 21世纪的主要照明光源[1-3]。在白光LED的实现过程中,红色荧光粉具有重要作用,它不仅可克服黄色荧光粉YAG∶Ce3+与蓝光LED形成的白光因缺少红光成分显色性差的缺点,也是三基色荧光粉的重要组成。但是,目前广泛应用于W-LED的红色荧光粉(如Y2O2S∶Eu3+)发光效率低且化学性质不稳定[4],严重影响W-LED的应用性能。因此,研究出一种在近紫外光和蓝光激发下具有高光输出率、半峰宽小且低光衰的红色荧光粉,对于改善W-LED的性能十分重要。
大量研究表明,化学性质稳定的白钨矿钼酸盐体系是一种性能优异的基质材料[5-8]。Hu[9]等采用高温固相法制备CaMoO4∶Eu3+红色荧光粉。研究表明,该荧光粉在近紫外(394 nm)和蓝光(464 nm)激发下可发射高纯度红光,发光强度为传统红色荧光粉Y2O2S∶Eu3+的5倍。与黄、绿、蓝色荧光粉相比,该CaMoO4∶Eu3+红色荧光粉的发光效率仍然较低。元素Y、La、Gd和Lu处于全充满、半充满或全空的稳定状态,属于光学惰性元素,因此特别适宜用作基质材料。高飞[10]通过对 Li3Ba2Ln3-xEux(MoO4)8(Ln=La,Gd,Y)的研究表明,该红色荧光粉不仅具有很强的基质吸收带,并且在616 nm处有强红光发射;Haque[11]等也发现,光学惰性元素Y的引入,使NaCaY(MoO4)3∶Eu的发光强度为CaMoO4∶Eu,Na的1.6倍。但是,目前荧光粉主要采用传统高温固相法制备,合成的产品颗粒较大需进行后处理,严重影响荧光粉的发光性能。而化学共沉淀法由于操作简单、合成的产品组分均匀且颗粒较小等优点而广泛应用于无机材料的制备[12]。因此,实验拟以NH4HCO3-NH3为沉淀剂,采用化学共沉淀法合成(Ca1-x-yLuy)MoO4∶x Eu3+红色荧光粉,并讨论Lu的引入对晶体结构及发光性能的影响。
1 实验部分
1.1 (Ca0.85-x Lu x)M oO4∶0.15Eu3+的合成
按(Ca0.85-xLux)MoO4∶0.15Eu3+化学式物质的量比分别称取Eu2O3(99.99%)、Ca(NO3)2·4H2O(A.R.)、Lu(NO3)3·4H2O(A.R.),用适量稀硝酸(HNO3∶H2O=1∶1,V/V)加热溶解Eu2O3,用去离子水分别溶解Ca(NO3)2·4H2O、Lu(NO3)3·4H2O和(NH4)6Mo7O24·4H2O,将上述溶液混合均匀即为母液。配置一定浓度比的NH4HCO3-混合沉淀剂。在不断剧烈搅拌下,使用蠕动泵(流量5 mL·min-1)将母液滴加到沉淀剂中,结束后继续搅拌30 min,停止搅拌,陈化、抽滤后在110~120℃干燥12 h即得前驱体。将前驱体在500℃预烧,900℃煅烧后随炉冷却,得到分散均匀的荧光粉样品。
1.2 实验表征
使用XRD-6000型X射线衍射仪分析荧光粉的晶体结构,工作电压和电流分别为40 kV和30 mA,扫描速度8°·min-1,步长0.02°,扫描范围10°~70°;使用INCA-350型X射线能谱仪分析荧光粉的化学元素组成;利用RF-5301型分子荧光光度计测试荧光粉的激发与发射光谱,光源为氙灯,激发和发射狭缝均为3 nm;使用PMS-50(增强型)紫外-可见-近红外光谱分析系统测定荧光粉的色度学参数,仪器扫描范围300~800 nm,扫描间隔5 nm。
2 结果与讨论
2.1 Lu掺杂对晶体结构的影响
图1为使用混合沉淀剂制备的(Ca0.85-xLux)MoO4∶0.15Eu3+荧光粉的XRD图,煅烧时间4 h。由图可知,当元素Lu的掺杂量较少,即低于50mol%时,样品的所有衍射峰均与CaMoO4标准卡JCPDS 29-0351一致,为单一的四方晶系白钨矿结构,无任何杂质峰出现,表明适量Lu元素的引入不会破坏荧光粉的晶体结构。但当Lu元素掺杂量超过50mol%后,样品XRD图出现少量杂峰,且衍射峰强度明显下降。在(Ca0.85-xLux)MoO4∶0.15Eu3+体系中,Eu3+和Lu3+分别取代CaMoO4晶体中的Ca2+而非Mo6+。这是因为Eu3+(0.094 7 nm)和Lu3+(0.084 8 nm)与Ca2+(0.099 nm)的离子半径相差较小,而与Mo6+(0.065 nm)相差太大,如果取代Mo6+格位会使晶体体积发生较大的变化,从而将改变样品的晶体结构,这与XRD的实验结果不一致。但是,若Lu元素的掺杂量过多,大量Ca2+的取代导致晶体结构畸变程度加大[13],甚至破坏原有的钼酸钙白钨矿结构,因而在XRD图中出现了少量的杂峰。
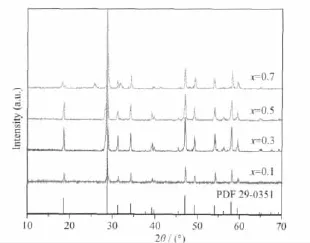
图1 (Ca0.85-x Lu x)MoO4∶0.15Eu3+的XRD图Fig.1 XRD patterns of(Ca0.85-x Lu x)MoO4∶0.15Eu3+ phosphors
在本实验中,Ca2+存在两种取代方式:2M3+(M= Eu或Lu)取代3Ca2+后,在晶格中形成一个Ca2+空位,或者1M3+取代1Ca2+后产生1个剩余电荷。虽然大量研究表明[14-15],使用碱金属离子M+(M=Li,Na,K)等电荷补偿剂可以有效改善在取代过程中的电荷不平衡情况。但王贵喜等[16]的研究表明,本实验存在的两种取代方式导致的缺陷有助于加强该荧光粉的发光强度并进一步改善其性能。
2.2 (Ca0.85-x Lu x)M oO4∶0.15Eu3+的元素分析
图 2给出(Ca0.45Lu0.4)MoO4∶0.15Eu3+红色荧光粉的EDS谱图。由图可知,(Ca0.45Lu0.4)MoO4∶0.15Eu3+中含有Ca、O、Mo、Eu和Lu元素。通过EDS表面组成分析可知,(Ca0.45Lu0.4)MoO4∶0.15Eu3+中 Ca、O、Mo、Eu和 Lu的重量百分比分别为 6.90%、23.11%、35.63%、9.11%和25.25%,与理论比6.66%、23.64%、35.43%、8.4%和25.85%相接近,表明实验通过化学共沉淀法且按理论百分比成功合成了(Ca0.45Lu0.4) MoO4∶0.15Eu3+红色荧光粉。
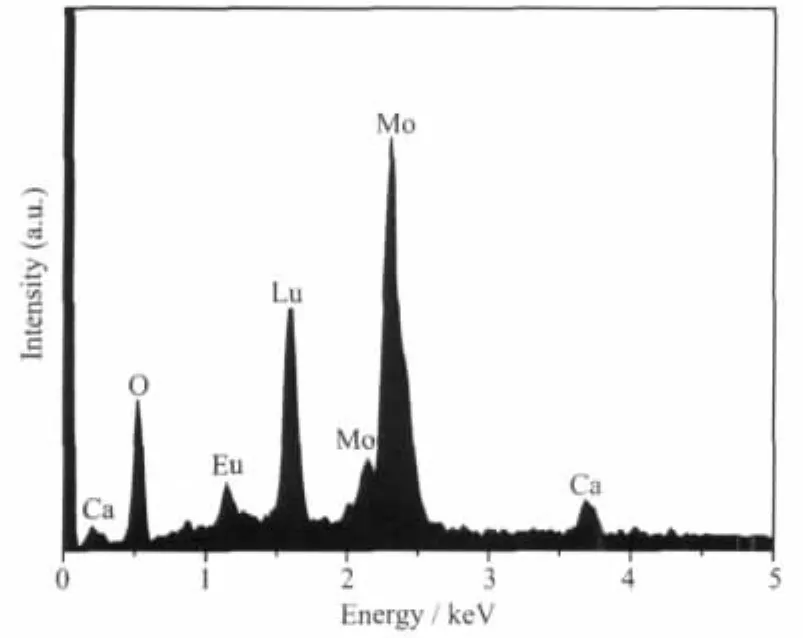
图2 (Ca0.45Lu0.4)MoO4∶0.15Eu3+的EDS谱图Fig.2 EDSof(Ca0.45Lu0.4)MoO4∶0.15Eu3+phosphors
2.3 (Ca0.85-x Lu x)MoO4∶0.15Eu3+发光性能
图 3为 900℃下煅烧 4 h的 (Ca0.55Lu0.3)MoO4∶0.15Eu3+和CaMoO4∶0.15Eu3+的激发光谱图,监测波长为613 nm。由图可知,Lu元素的引入对荧光粉的激发光谱峰的位置和形状没有影响,(Ca0.55,Lu0.3) MoO4∶0.15Eu3+和CaMoO4∶0.15Eu3+的激发光谱均有一个300~350 nm宽电荷迁移带,为电荷密度从配体O2-的2p轨道向金属离子Mo6+和Eu3+的4d和4f分子轨道重新分配的结果[17]。该电荷迁移带很弱,这是因为Eu3+、Lu3+取代了晶体中部分Ca2+的格位,从而使晶体结构产生微小的缺陷所致[16],但该缺陷可使MoO42-吸收的能量更有效传递给Eu3+,明显增强了465 nm的7F0→5D2电子跃迁。此外,位于362、383、394、425、465和475 nm的窄峰均为Eu3+的4f7基态向激发态跃迁,分别对应于7F0→5D4、7F0→5L7、7F0→5L6、7F0→5D3、7F0→5D2和7F0→5D1跃迁。其中,7F0→5L6和7F0→5D2吸收远强于其它峰,这有利于提高红色荧光粉与紫外光和蓝光LED芯片的匹性配,从而改善商业W-LED的显色性能。
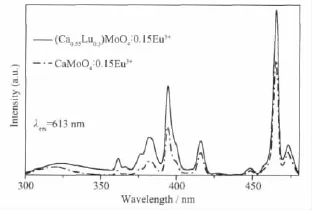
图3 (Ca0.55Lu0.3)MoO4∶0.15Eu3+和CaMoO4∶0.15Eu3+的激发光谱图Fig.3 Excitaion spectra of(Ca0.55Lu0.3)MoO4∶0.15Eu3+and CaMoO4∶0.15Eu3+phosphors
图 4为 (Ca0.55Lu0.3)MoO4∶0.15Eu3+和 CaMoO4∶0.15Eu3+的发射光谱,激发波长为394 nm。由图可知,(Ca0.55Lu0.3)MoO4∶0.15Eu3+和CaMoO4∶0.15Eu3+的峰形和峰位置均相同,主要由614 nm的5D0→7F2电偶极跃迁和590 nm的5D0→7F1磁偶极跃迁组成。但(Ca0.55Lu0.3)MoO4∶0.15Eu3+红色荧光粉的发光强度明显高于CaMoO4∶0.15Eu3+红色荧光粉。这是因为Eu3+的f-f跃迁是f6组态内的跃迁,始态和终态的宇称相同,因而电偶极跃迁是禁阻的。但在(Ca0.55Lu0.3) MoO4∶0.15Eu3+晶格中,Lu3+的引入使Eu3+周围环境的对称中心移动,宇称相反的5d和5g组态与4f组态混合,从而使宇称禁阻能更好的解除而产生5D0→7F2的电偶极跃迁[18],因而发射高强度红光。此外,Hu[9]通过对比 CaMoO4∶Eu3+和传统红色荧光粉Y2O2S∶Eu3+的荧光光谱发现,在394和464 nm激发下,Y2O2S∶Eu3+的发射光谱均为一个600~700 nm宽带,最大峰位于650 nm处,且其发光强度分别为CaMoO4∶Eu3+发光强度的 20%和 15%。因此,(Ca0.55Lu0.3)MoO4∶0.15Eu3+红色荧光粉的发光性能不仅明显优于传统的红色荧光粉,还改善了CaMoO4∶Eu3+红色荧光粉的发光强度。
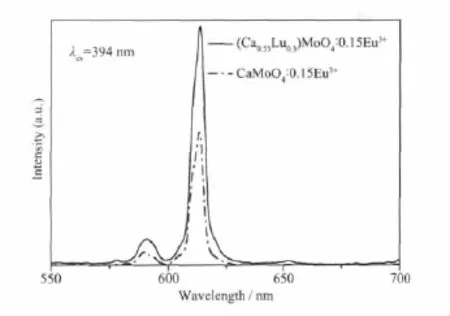
图4 (Ca0.55Lu0.3)MoO4∶0.15Eu3+和CaMoO4∶0.15Eu3+的发射光谱Fig.4 Emission spectra of(Ca0.55Lu0.3)MoO4∶0.15Eu3+and CaMoO4∶0.15Eu3+phosphors
发光色度是表征发光材料特性的一个基本参数[19-20]。图5为(Ca0.55Lu0.3)MoO4∶0.15Eu3+在近紫外光激发下的CIE色度图。测量结果表明,样品的色坐标值为(0.666 5,0.332 9),与传统的红色荧光粉Y2O2S∶Eu3+(0.631,0.350)相比,(Ca0.55Lu0.3)MoO4∶0.15Eu3+荧光粉的色坐标更接近规定的红色色度坐标(0.67,0.33),具有高纯度的红光。因此,该红色荧光粉有可能取代传统商业红色荧光粉并应用于WLED中,从而改善W-LED的显色性和使用性能。
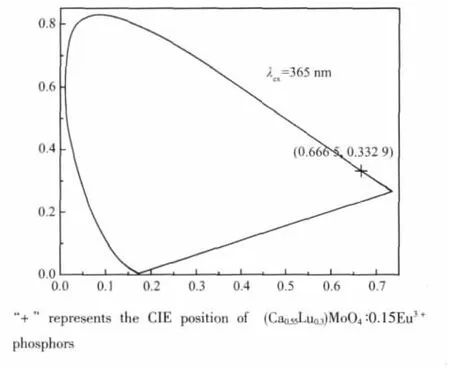
图5 (Ca0.55Lu0.3)MoO4∶0.15Eu3+的CIE色度图Fig.5 CIE of(Ca0.55Lu0.3)MoO4∶0.15Eu3+phosphors
2.4 Lu掺杂量对发光性能的影响
图6给出在394 nm激发的不同Lu掺杂量对荧光粉发光性能的影响图。由图可知,随Lu掺杂量的增加,荧光粉的发光强度明显增强,但当Lu含量达到30mol%后,掺杂离子的再增加使发光强度下降。在CaMoO4∶Eu3+晶体中,Lu3+的引入主要取代Ca2+格位,少量掺杂可一定程度上破坏晶体完整性并在杂质格点上造成电荷失衡,使Eu3+受周围晶格产生的晶体场作用更大,因此宇称选律定则放宽,发光强度更高。但若掺杂量过高,会改变CaMoO4的白钨矿晶体结构,引起发光性质突变[21],因而发光强度下降。
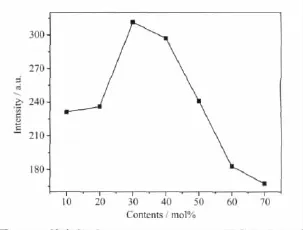
图6 Lu掺杂量对(Ca1-x Lu x)MoO4∶0.15Eu3+的发光强度的影响Fig.6 Effectof concentration of Lu on the luminescent intensity of(Ca1-x Lu x)MoO4∶0.15Eu3+phosphors
3 结 论
采用NH4HCO3-NH3·H2O混合沉淀剂,通过化学共沉淀法且按理论百分比成功合成了 (Ca1-x-yLuy) MoO4∶x Eu3+红色荧光粉。Lu的引入不会破坏钼酸钙的白钨矿晶相结构,却可有效提高7F0→5L6(394 nm)和7F0→5D2(465 nm)的电子吸收效率,增加与紫外光和蓝光LED芯片的匹配性。与CaMoO4∶Eu3+红色荧光粉相比,(Ca1-x-yLuy)MoO4∶x Eu3+的发光强度明显提高,其色坐标为(0.666 5,0.332 9),优于传统的红色荧光粉Y2O2S∶Eu3+(0.631,0.350)。当Lu的掺杂量为30mol%时,荧光粉发光强度最佳。因此,使用化学共沉淀法制备的(Ca1-x-yLuy)MoO4∶x Eu3+荧光粉,有望取代传统的红色荧光粉并应用于白光LED中,从而改善W-LED的使用性能。
[1]Dong T T,Li ZH,Ding ZG,et al.Mater.Res.Bull.,2008, 43(7):1694-1701
[2]GAO Fei(高飞),LIANG Li-Fang(梁利芳),GUO Chong-Feng (郭崇峰).Chin.Rare Earths.(Xitu Xuebao),2010,31(1):7-10
[3]Yang Y L,Li X M,Feng W L.et al.J.Alloys Compd., 2010,505(1):239-242
[4]Wang Y G,Ma JF,Tao JT,et al.Ceram.Int.,2007,133(4): 693-695
[5]Nassau K,Levinstein H J,Loiaconon G M.J.Phys.Chem., 1965,26(12):1805-1806
[6]Hwang K S,Seung H,Kim J T.Ceram.Int.,2009,35(6): 2517-2519
[7]ZHOU Li-Ya(周立亚),WANG Lei(王雷),WEIJian-She(魏建设),et al.Chin.Chem.Res.Appl.(Huaxue Yanjiu Yu Yingyong),2008,20(8):952-956
[8]Chiu C H,Wang M F,Lee C S,et al.J.Solid State Chem., 2007,180(2):619-627
[9]Hu Y S,Zhuang W D,Ye H Q,et al.J.Alloys Compd., 2005,390(1/2):226-229
[10]GAO Fei(高飞),LIANG Li-Fang(梁利芳),GUO Chong-Feng (郭崇峰).Chin.J.Lumin.(Faguang Xuebao),2009,30(5):611 -615
[11]Haque M M,Lee H L,Kim D K.J.Alloys Compd.,2009, 481(1/2):792-796
[12]Yang P,Yao G Q,Lin JH.Inorg.Chem.Commun.,2004,7 (3):389-391
[13]XIE An(谢安),YUAN Xi-Ming(袁曦明),WANG Juan-Juan (王娟娟),et al.Chin.Sci.E(Zhongguo Kexue),2009,39(6): 1063-1068
[14]Liu J,Lian H Z,Shi C S.Opt.Mater.,2007,29(12):1591-1594
[15]Li X,Yang Z P,Guan L,et al.J.Alloys Compd.,2009,478 (1/2):684-686
[16]WANG Gui-Xi(王贵喜),BO Su-Ling(薄素玲),QIXia(齐霞), et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2009, 25(2):350-353
[17]Zhang Z J,Chen H H,Yang X X,etal.Mater.Sci.Eng.,B, 2007,145(1/2/3):34-40
[18]Yan B,Wu JH.Mater.Chem.Phys.,2009,116:67-71
[19]LIXue-Ming(黎学明),KONG Ling-Feng(孔令峰),LIWu-Lin(李武林),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2009,25(5):865-868
[20]ZHANGMei(张梅),HE Xin(何鑫),DINGWei-Jia(丁唯嘉), etal.Prog.Chem.(Huaxue Jinzhan),2010,22(2/3):376-382
[21]YAO Guang-Qing(姚光庆),FENG Yan-E(冯艳娥),DUAN Jie-Fei(段洁菲),et al.Acta Phys.-Chim.Sin.(Wuli Huaxue Xuebao),2003,19(3):226-229
Co-precipitation Synthesis and Photolum inescence of (Ca1-x-yLuy)M oO4∶x Eu3+Red Phosphors
YANG Yu-Ling1LIXue-Ming*,1,2FENGWen-Lin3LIWu-Lin2TAO Chuan-Yi2
(1College of Chemistry and Chemical Engineering,Chongqing University,Chongqing 400044,China) (2The Key Lab for Optoelectronic Technology&System of the Ministry of Education, College of Optoelectronic Engineering,Chongqing University,Chongqing 400044,China) (3Department of Applied Physics,Chongqing University of Technology,Chongqing 400044,China)
Using NH4HCO3-2O asmixed precipitator,(Ca1-x-yLuy)MoO4∶x Eu3+red phosphorswere synthesized by co-precipitationmethod.The phase formation,composition and luminescence propertiesof(Ca1-x-yLuy)MoO4∶x Eu3+were analyzed by XRD,EDS,PL and CIE.The results show that(Ca1-x-yLuy)MoO4∶x Eu3+red phosphors have been successfully prepared by co-precipitationmethod according to theoretic ratio,and the synthesized (Ca1-x-yLuy)MoO4∶x Eu3+have scheelite structure with pure phase.The phosphors have strong electron absorbability of7F0→5L6and7F0→5D2at394 nm and 465 nm and can emit red lightingwith high intensity.The CIE of(Ca1-x-yLuy)MoO4∶x Eu3+red phosphors is(0.666 5,0.3329),which isbetter than thatof traditional Y2O2S∶Eu3+red phosphors.In addition,when the concentration of Lu is30mol%,the luminescent intensity of(Ca0.55Lu0.3)MoO4∶0.15Eu3+ishighest.
(Ca1-x-yLuy)MoO4∶x Eu3+;co-precipitation;photoluminescence;red phosphors
O611.4
A
1001-4861(2011)02-0276-05
2010-07-27。收修改稿日期:2010-09-16。
重庆大学211工程三期创新人才培养计划建设项目(No.S-09013),重庆市自然科学基金(No.2005BA4016),中国博士后基金(No.20100470810)项目资助。
*通讯联系人。E-mail:xuemingli@cqu.edu.cn;会员登记号:S06N5027M1006。
