响应曲面法优化鼠李糖乳杆菌L7-13增菌因子
2011-10-19胡博梁金钟
胡博,梁金钟
(哈尔滨商业大学食品工程学院,哈尔滨150076)
响应曲面法优化鼠李糖乳杆菌L7-13增菌因子
胡博,梁金钟
(哈尔滨商业大学食品工程学院,哈尔滨150076)
采用响应面方法对鼠李糖乳杆菌L7-13的增菌因子进行了优化。以MRS培养基作为基础培养基,在此基础上添加增菌因子;采用单因素实验设计法,对几种乳酸菌生长促进因子对鼠李糖乳杆菌L7-13的增菌影响进行评价;筛选出对鼠李糖乳杆菌L7-13增菌效果显著的3种物质以其最佳添加量;然后用旋转中心组合设计及响应面分析法确定了3种显著增菌因子的最佳配比。在优化后的培养基中,鼠李糖乳杆菌L7-13的菌体浓度达到8.1×1010mL-1,比优化前的活菌数7.9×108mL-1提高了近百倍。表明此增殖优化培养基适于鼠李糖乳杆菌L7-13菌株的生长繁殖。
鼠李糖乳杆菌;响应曲面;增菌因子
0 引言
益生菌鼠李糖乳杆菌(Lactobacillus rhamnosus GG,简称LGG)从健康人的肠道中分离得到[1-3],因其具有的益生特性和自身特点而被深入研究和广泛应用[5]。
随着益生菌研究不断深入,也出现了一些问题,比如市售的益生菌产品不但所用的菌种不同,而且在活菌含量、产品中的稳定性、耐酸性、耐胆汁性及有无肠溶性等方面的差别,也会明显影响有效性[6]。
响应面法(Response surface methodology,RSM)是一种优化过程的综合技术,它可快速有效地确定多因子系统的最佳条件,该法己经广泛地应用于各类培养基以及发酵条件的优化实践中[10,11]。
因此,本实验基于以上因素,选取鼠李糖乳杆菌L7-13菌株,在MRS培养基的基础上,利用Design Expert软件(Version 6.0)响应面设计法,对培养基的增菌因子进行优化,最终达到增菌的目的。
1 实验
1.1 材料与设备
菌种为鼠李糖乳杆菌L7-13(Lactobacillus rhamnosus GG L7-13)株。
牛肉粉,蛋白胨,酵母粉,琼脂粉,无水乙酸钠,葡萄糖,磷酸氢二钾(生化试剂),蜂蜜(市售),豆浆,红枣汁(自制),低聚果糖,乳清粉,酪蛋白水解物(食品添加剂)。
1.2 仪器设备
721型分光光度计,LDZX-50KB立式压力蒸汽灭菌器,超净工作台,DHG-9203型电热恒温鼓风干燥箱,PHS-3C型pH计,DHP-9162型电热恒温培养箱。
1.3 培养基
活化和计数培养基(MRS基础培养基):蛋白胨1.00 g,牛肉粉1.00 g,酵母粉0.50 g,葡萄糖2.00 g,吐温80 1.00 mL,乙酸钠0.50 g,柠檬酸二铵0.20 g,MgSO4·7H2O 0.058 g,MnSO4·4H2O 0.025 g,K2HPO40.20 g,蒸馏水100 mL,pH值为6.2~6.4,121℃灭菌15 min后备用。
1.4 方法
1.4.1 菌种的活化与传代培养
将斜面保藏菌种接种于MRS固体培养基中,37℃恒温培养48 h,得到纯菌种后,按质量分数2%的接种量传代培养于MRS液体培养基中,37℃恒温培养48 h,作为种子液备用[7-9]。
1.4.2 显著增菌因子的筛选
采用单因素实验,以MRS培养基作为基础培养基,选取添加一定量的豆浆、红枣汁、乳清粉、蜂蜜、酪蛋白水解物、低聚果糖等可能促进乳酸菌的生长的增菌因子作为考察对象,37℃恒温培养48 h,分别测其活菌数,以MRS培养基+0(g)mL/100 mL各生长因子为空白对比实验,对数据进行单因素方差分析,从而筛选出显著增菌因子。
其中各组分的质量浓度分别为:豆浆、红枣汁5.0~15.0 mL/100 mL,乳清粉0.5~4.0 g/100m L,蜂蜜1.0~4.0 g/100 mL,酪蛋白水解物的添加量0.3~4.0 g/100 mL、低聚果糖0.5~3 g/100 mL。
1.4.3 优化混合增菌因子的配比
筛选出影响鼠李糖乳杆菌L7-13株的几种显著增菌因子后,采用旋转中心组合设计(Central Composite Rotatable Design,CCRD)法,对其混合增菌因子进行进一步优化配比,以获得该菌体的混合增菌因子的配方。
中心组合设计的总实验总数为2K+2K+n0,其中K为自变量总数,n0为中心点实验数。自变量Xi按下式进行编码变换:

式中:Xi为自变量Xi的编码值,X0为自变量Xi在中心点的值,△xi为自变量变化步长。
用标准多项式回归方法,对实验数据进行拟合,便得到一个二次多项式,该方程为描述响应量(应变量)和自变量关系的经验模型。对于2因子系统,模型可描述为:

式中:Y为预测响应值;β0为截距;βi为线性系数;βij为平方系数;βij为交互作用系数。
本阶段实验辅助软件为Design Expert软件(Version 6.0)。实际考察的变量及其实验水平编码如表1所示;采用多元回归技术,拟合二次多项模型的CCRD设计结果如表2所示。
1.4.4 活菌数测定
采用稀释平板计数法,将菌液10倍递增稀释到合适浓度后,取3个适当稀释度,各抽取0.1 mL菌液于灭好菌的培养皿中,倒入融化好的MRS固体培养基,混合均匀,每个稀释度做3个重复实验,待凝固后,放入恒温箱,37℃培养48 h,计菌落数(菌落数在30~300个内有效)[9]。
活菌数=稀释度×平均活菌数/个平皿×0.1 mL。
2 结果与分析
2.1 显著增菌因子的筛选及其最佳浓度的确定
MRS培养基的基础上分别添加一定量的豆浆、红枣汁、乳清粉、蜂蜜、酪蛋白水解物、低聚果糖,按质量分数为2%的接种量接入100 mL三角瓶中,37℃恒温培养48 h,测其活菌数,与不加增菌因子接种在MRS培养基的鼠李糖乳杆菌L7-13进行比较,并对所得数据进行分析。实验数据直方图如图1-图6所示。

图1 红枣汁的添加量对L7-13的影响

图2 豆浆的添加量对L7-13的影响

图3 酪蛋白水解物添加量对L7-13的影响

图4 乳清粉添加量对L7-13的影响

图5 低聚果糖添加量对L7-13的影响

图6 蜂蜜添加量对L7-13的影响
进行单因素方差分析可知:豆浆(P=0.12068)、红枣汁(P=0.115275)、乳清粉(P=0.000668)、蜂蜜(P=0.123862)、酪蛋白水解物(P=2.64×10-5)、低聚果糖(P=1.59×10-5)所以,乳清粉、酪蛋白水解物和低聚果糖是影响鼠李糖乳杆菌L7-13增殖的显著增菌因子。因此,选择乳清粉、酪蛋白水解物和低聚果糖作为L7-13的显著生长因子,进一步考察它对L7-13生长的影响。其他可信度较小的因素对L7-13的增殖无明显影响,在下一步的培养基优化中可不考虑。
2.2 响应曲面法(RSM)优化混合增菌因子的配比
2.2.1 L7-13菌体浓度多元二次模型方程的建立及检验
从以上单因素实验可知,乳清粉、酪蛋白水解物和低聚果糖是L7-13的显著生长因子。因此以MRS培养基为基础培养基,选择以上3个因子为研究对象,以L7-13菌体浓度即活菌数为响应值,设计旋转中心组合实验如表1。根据实验设计表进行了20组实验,其结果如表2所示。

表1 旋转中心组合设计实验因素水平及其编码g/100mL
X1=(x1-2)/0.5;X2=(x2-2)/0.5;X3=(x3-1)/0.5。
通过Design expert软件对表2实验数据进行二次多项回归拟合,获得L7-13菌体浓度对乳清粉、酪蛋白水解物和低聚果糖的二次多项式回归方程为

表2 旋转中心组合设计及其实验结果
Y=80.66-5.60X1-5.44X2-2.71X3-17.19X12-15.42X22-15.17X32+0.050X1X2-0.30X1X3+0.33X2X3(3)
式中:Y为L7-13菌体浓度的预测值;X1,X2,X3分别为乳清粉、酪蛋白水解物和低聚果糖的编码值。由以上方程得出的L7-13菌体浓度预测值如表2所示。该二次回归方程及其各项的方差分析结果如表3所示。
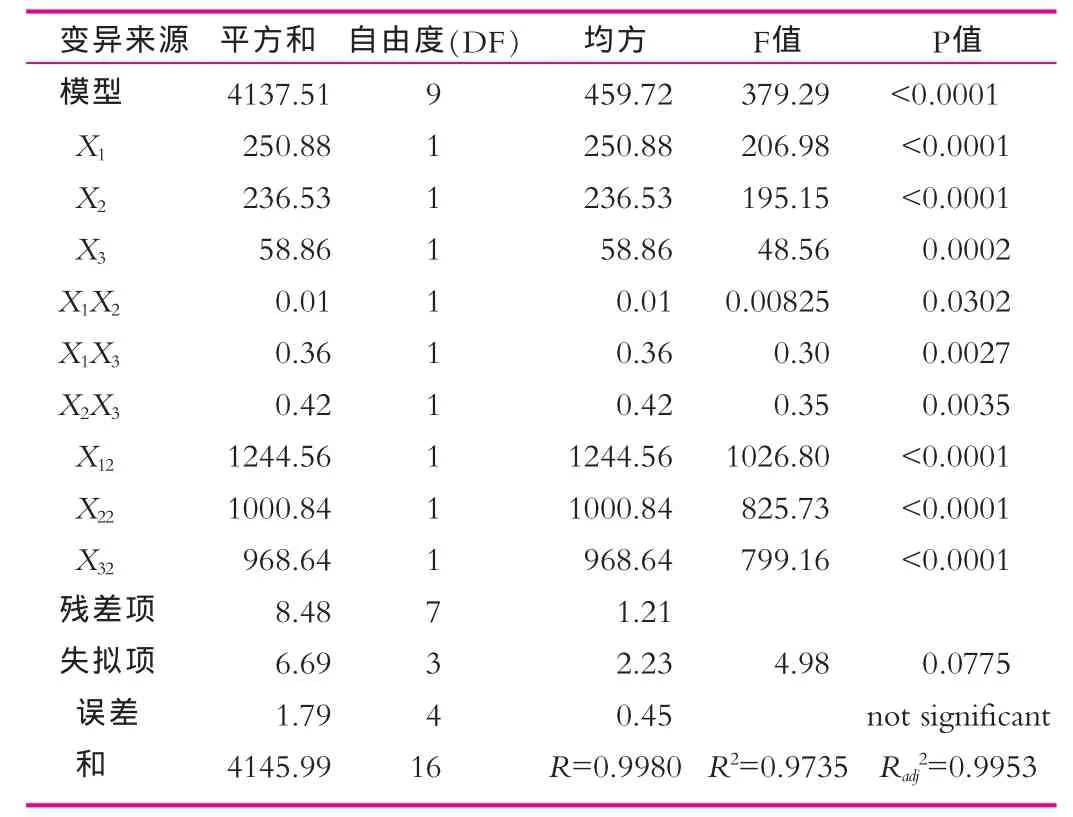
表3 L7-13菌体浓度二次多项模型及其各项的方差分析
由表3可以看出,该模型极显著(P<0.0001),失拟项在α=0.1水平上不显著(P=0.0775>0.05),而且经分析计算,该模型的确定系数R2=0.9735,表明模型与实际情况拟合很好,因此该模型可用于预测L7-13的实际生长增殖情况。由表3回归方程各项的方差分析表明,各因素对L7-13菌体浓度的线性效应皆显著;且各因素对L7-13菌体浓度的曲面效应也显著;X1X3,X2X3,X1X2的交互影响显著。
2.2.2 L7-13菌体浓度响应面交互作用与优化
由方程(3)所作的响应曲面图及其等高线图如图7~图9所示。各因素及其交互作用对响应值的影响结果可通过该组图直观反映出来。

由图7可以看出,在本研究水平范围内,随着培养基中乳清粉含量的增大,L7-13的菌体浓度增加,但其浓度超出一定量时,反而抑制了L7-13的增殖。即当乳清粉质量浓度处于1.64~2.21 g/100mL范围内,当低聚果糖质量浓度在1.79~2.07 g/100mL范围内时,才可获得7.85×1010mL-1的较高的菌体浓度。
乳清粉中含有大量的乳糖和乳蛋白素,能够为植物乳杆菌提供丰富的营养物质,可刺激乳酸菌的生长繁殖。因此,它们是乳酸菌的天然促生长因子。
图8显示了乳清粉与酪蛋白水解物对L7-13增殖的交互影响效应。由图8可以看出,当酪蛋白水解物在0.70~1.19 g/100 mL范围内时,当乳清粉在1.70~2.15 g/100 mL范围内时,才可获得7.76×1010mL-1的较高的菌体浓度。
由图9可见,当乳清粉质量浓度为2.00 g/100mL,酪蛋白水解物范围在1.17~0.83 g/100 mL内时,低聚果糖的质量浓度只需1.64~2.21 g/100 mL,就能达到L7-13菌体浓度的较大值7.47×1010mL-1,而继续增加酪蛋白水解物和低聚果糖的质量浓度对L7-13增殖均无益。
由此可见,乳酸菌的酶系比较单纯,不能合成多种氨基酸、维生素和生长因子。因此,为使这些菌正常生长和大量增殖,除供给碳水化合物外,还必须补充其所不能合成的各种营养物质。
通过对L7-13菌体浓度模型进行求导和解逆矩阵,可以得到模型的极值点,乳清粉的添加量为1.92 g/100 mL,低聚果1.91g/100 mL,酪蛋白水解物0.95 g/100 mL,此时模型预测的最大响应值为7.8×1010mL-1。为了证实预测结果,在上述优化条件下和原始的菌体生长条件下分别进行重复实验,得出实际菌体浓度为8.1×1010mL-1,可见该模型能较好地预测L7-13的菌体生长情况。
3 结论
本研究通过单因素实验设计从几种常见乳酸菌促生长因子中筛选出对鼠李糖乳杆菌增菌效果显著的物质及其最佳添加量,通过响应曲面实验设计优化其混合增菌因子的配方:乳清粉的添加量为1.92 g/100 mL,低聚果糖1.91 g/100 mL,酪蛋白水解物0.95 g/100 mL培养28 h后,测其活菌数从优化前7.9×108mL-1提高到8.1×1010mL-1,提高了近百倍。表明此增殖优化培养基适于鼠李糖乳杆菌L7-13菌株的生长繁殖,为后续研究以及产业化提供了依据。
4 展望
培养基优化仅仅是益生菌鼠李糖乳杆菌L7-13株研究的一个方面,还有许多方面的问题有待我们继续研究和探索,比如它的基因测序、耐受性、培养条件以及微胶囊化方面的问题都需要我们更加深入的探索。我国对于鼠李糖乳杆菌的研究和含鼠李糖乳杆菌产品的开发起步较晚,而且鲜有产品问世,还需广大从事功能性保健食品开发和药品研究的科研工作者共同努力。
[1] MICHAEL de VRESE J.SchrezenmeirProbiotics,Prebiotics,and Synbiotics[J]Adv Biochem Engin/Biotechnol,2008,111:1–66.
[2] 钱程,霍贵成,马微.鼠李糖乳杆菌(LGG)的功能特性及其应用前景[J].食品科技,2005(9):94-98.
[3] 马鹏飞,陈有亮,金鸟君.鼠李糖乳杆菌功能特性的研究进展[J].科技通报,2009,25(2):82-96.
[4] WEI H,XU Y,CHENG B,et al.Synergistic Effects of Lactobacillus rhamnosus ZDY114and Bovine Colostrums on the Immunological Function of Mouse in Vivo and in Vitro[J].Appl Microbiol Biotechnol,2007,75:427–434.
[5] 安颖,王世宾.益生菌LGG的益生功效及在乳制品中的应用[J].食品科技,2006(7):271-274.
[6] 曾子丹,姚朔影.益生菌的研究前景及国内外发展状况[J].食品工业科技,2007,28(8):94-96.
[7] 潘丽媚,徐春厚,谢为天,等.鼠李糖乳杆菌L3-22株培养条件的优化及发酵增菌曲线[C].中国畜牧兽医学会动物微生态学分会论文集,2006.
[8]高鹏飞,李妍,赵文静,等.益生菌Lactobacillus casei Zhang增殖培养基的优化[J].微生物学报,2008,35(4):623-628.
[9] 黄丽金,陆兆新,袁勇军.响应面法优化德氏乳杆菌保加利亚亚种增殖培养基[J].食品科学,2005,26(5):103-107.
[10] 李疆,周海珍,李开雄.SAS软件优化植物乳杆菌增殖培养基的研究[J].食品研究与开发,2007,28(6):60-64.
[11] 周剑忠,李莹,单成俊,等.响应曲面法优化植物乳杆菌蔬菜汁培养基的研究[J].江苏农业科学,2008(5):216-219.
Studies on enriching factor of Lactobacillus rhamnosus L7-13 strain by response surface methodology
HU Bo,LIANG Jin-zhong
(Harbin University of Commerce,Harbin 150076,China)
Response surface methodology was used to optimize the MRS-based enriching factor of Lactobacillus rhamnosus L7-13 strain.According to the determination of viable count,the enriching effects of several additives were evaluated by using the single-factor test.screen out the main affecting factors on the Lactobacillus rhamnosus L7-13 strain.Then the central composite design and response surface analysis were used to determine the optimal levels of the main factors.Cultived in the optimized medium,the cell numerous of Lactobacillus rhamnosus L7-13 Strain increased from 7.9×108cfu/mL to 8.1×1010cfu/mL.Experiments showed that this media and culture conditions were suitable for growth and reproduction of Lactobacillus rhamnosus L7-13 strain.
Lactobacillus rhamnosus;Response surface methodology;Enriching factor
Q936
A
1001-2230(2011)01-0019-04
2010-09-20
胡博(1985-),女,硕士研究生,研究方向为微生物发酵。通讯作者:梁金钟
