高速逆流色谱法分离纯化内吗啡肽-1
2011-10-18许旭旭孙洪林何冰芳
许旭旭,毛 政,吴 斌,孙洪林,何冰芳
(1南京工业大学生物与制药工程学院,江苏 南京 210009;2浙江省食品药物监督管理局培训中心,浙江 杭州 310012)
研究开发
高速逆流色谱法分离纯化内吗啡肽-1
许旭旭1,毛 政2,吴 斌1,孙洪林1,何冰芳1
(1南京工业大学生物与制药工程学院,江苏 南京 210009;2浙江省食品药物监督管理局培训中心,浙江 杭州 310012)
利用高速逆流色谱技术对化学酶法合成的内吗啡肽-1粗样进行分离。分析了内吗啡肽-1粗样杂质的分配系数,选择乙酸乙酯-甲醇-水(3∶1.5∶3,体积比)作为两相溶剂系统,上相为固定相,下相为流动相,在主机转速为900 r/min,流速为1.0 mL/min,检测波长为280 nm条件下分离制备。从120 mg粗样中分离得到71 mg样品,内吗啡肽-1的纯度达99.1%,样品回收率为91.5%。该方法简便、快速,为高纯度内吗啡肽-1少量制法提供了技术,并可为高速逆流分离小肽合成产物提供指导。
高速逆流色谱;分离纯化;内吗啡肽-1
内吗啡肽-1(EM-1:Tyr-Pro-Trp-Phe-NH2,结构式见图1)是1997年由美国杜兰大学神经生物学家James Zadina从牛脑和人脑中分离得到的四肽[1]。内吗啡肽-1在神经系统中作用于μ-阿片受体,具有吗啡类物质的镇痛作用,而吗啡样的生理依赖性、呼吸抑制及严重的肠胃反应等副作用低,具有很好的研发前景[2]。目前内吗啡肽-1可以由化学[3]或化学酶法[4]合成,其合成产物的分离纯化多采用传统的硅胶色谱法,这种方法不仅费时费力、样品损耗大,而且分离得到的产物纯度也较低[5]。例如内吗啡肽-1化学合成后的分离纯度一般为90%[5],小肽也有通过制备型HPLC进行分离的,但每次处理量较小,而溶剂消耗较大[6]。未见有采用高速逆流色谱法分离纯化小肽合成产物的报道。
高速逆流色谱法(high-speed counter-current chromatography,HSCCC)是利用溶质在两种互不相溶的溶剂系统中分配系数的不同而进行分离的方法[7]。该技术可以用于短时间内复杂样品的有效分离,完全消除了因固体载体带来的样品不可逆的吸附和对样品沾染等影响。目前HSCCC大多应用于中草药有效成分[8-9]、抗生素[10]、蛋白质[11]等天然产物的分离与纯化,在小肽的分离提纯上报道很少。本研究首次利用高速逆流色谱法分离纯化合成样品中的内吗啡肽,在分析小肽化学酶法合成产物复杂组分的基础上,选择并优化了高速逆流色谱分离小肽化合物的工艺,一步高回收率地得到纯度为99.1%的内吗啡肽-1。

图1 内吗啡肽-1的化学结构
1 材料与方法
1.1 仪器与试剂
高速逆流色谱:TBE-300B 型高速逆流色谱仪(管径2.6 mm,柱体积300 mL,进样圈体积20 mL,上海同田生物技术有限公司),包括TBP-5002型恒流泵,N2000双通道色谱工作站;HD-4型紫外检测器(南京大学普阳科学仪器研究所);HX-1050型恒温循环器(北京博医康实验仪器有限公司);P680型高效液相色谱仪(美国戴安公司),分析柱为Kromasil 100-5 C18(4.6 mm×250 mm,Kromasil,瑞典);Water Q-TOF MicroTM质谱仪(美国Waters公司)。
内吗啡肽-1标样(上海吉尔生化公司),色谱纯甲醇(江苏汉邦有限公司),分析纯乙酸乙酯(上海申博化工有限公司,分析纯氯仿(上海凌风化学试剂有限公司),分析纯正丁醇(上海申博化工有限公司)。
1.2 实验方法
1.2.1 化学酶法合成内吗啡肽-1
内吗啡肽-1酶法合成简要步骤[12]:首先采用混合酸酐法由 Boc-Tyr和 Pro-OMe合成二肽Boc-Tyr-Pro-OH;其次,在20%甲醇反应体系中利用耐有机溶剂蛋白酶 WQ9-2催化 Boc-Trp和Phe-NH2合成二肽Boc-Trp-Phe-NH2,产物以晶体的形式直接从反应体系中析出;用50%(体积比,下同)三氟乙酸去除Boc保护基团,得到Trp-Phe-NH2;最后采用耐有机溶剂蛋白酶 PT121在水-乙酸乙酯(1∶3)双相体系中催化 Boc-Tyr-Pro-OH 和Trp-Phe-NH2缩合制备Boc-Tyr-Pro-Trp-Phe-NH2;用同样的方法去除 Boc保护基后得到内吗啡肽-1(Tyr-Pro-Trp-Phe-NH2)混合酶,为含 64.1%内吗啡肽-1的粗品。
1.2.2 溶剂体系的选择
按溶剂体系配制一定体积的上相、下相溶剂,各取相同体积的上相、下相溶剂放置于同一容器中,加入一定量的样品,剧烈振摇后静置,待上相与下相分层后,取相同体积的上相和下相样品液,然后用液相色谱以测定目标成分在上相和下相中的浓度Cu、Cl,用来计算分配系数K(K=Cu/Cl)。
1.2.3 分离方法
在分液漏斗中配制经过筛选的最佳溶剂,混合后静置过夜,取上相作为高速逆流色谱的固定相,取下相作为流动相,超声波脱气30 min处理后,用20 mL固定相溶解120 mg样品。高速逆流色谱体系开机预热后,先将固定相以10 mL/min 的恒定速度泵满螺旋管柱(200 mL),缓慢调节主机转速至900 r/min顺时针旋转,同时以2.0 mL/min 泵入流动相,待流动相开始流出分离柱时,从进样口进样,流速改为1.0 mL/min,同时开启检测器,以280 nm 波长进行检测,根据色谱图收集流出液体。
1.2.4 纯度分析和质谱检测
使用HPLC对制备得到的样品进行纯度分析,根据何平等[4]报道的方法略作调整,所用色谱柱为上述Kromasil 100-5 C18柱,柱温为30 ℃,检测波长280 nm,进样量为10 μL。流动相为甲醇和水,梯度洗脱程序:0~5 min,20%甲醇;5~30 min,20%~100% 甲醇;30~40 min,100% 甲醇;流速1.0 mL/min。
质谱仪在正离子模式下采集数据,离子源参数 ESI:毛细管电压2500 V,样品锥电压30 V,脱溶剂室温度100 ℃,离子源温度200 ℃,雾化气(N2)体积流量50 L/h,脱溶剂气(N2)体积流量400 L/h。
样品的核磁检测由中国药科大学完成。
2 结果和讨论
2.1 HSCCC分离体系的选择
溶剂体系的选择对分离效果起着决定性作用,不同的溶剂系统具有黏度、极性、密度等性质的差异,均会对相同的成分产生不同的溶解、分配能力,形成分配系数的差异,合适的体系应该具有比较理想的分配系数,K值在0.5~2.0之间最佳,不同样品的分配系数差值大于0.5可以得到有效分离[13]。本研究首先分析样品中的主要成分,经过二肽酶法缩合并去除Boc保护的样品经过HPLC检测,共有7个峰[见图3(b)],其中峰2是极性相近的底物——二肽Trp-Phe-NH2,峰3是目标化合物内吗啡肽-1(Tyr-Pro-Trp-Phe-NH2),峰 5为另一底物Boc-Tyr-Pro-OH,峰 6为脱保护前的内吗啡肽-1(Boc-Tyr-Pro-Trp-Phe-NH2),峰1、峰4、峰7是酸解过程中产生的杂质。本研究选择了几种不同极性的体系并在较好体系的基础上进行了微调,通过考察不同体系的分配系数K值,来选择合适的溶剂体系。由表1可知,在溶剂氯仿∶甲醇∶水(4∶3∶2,体积比,下同)中杂质1、2与3的K值相近,不能很好的分离;在溶剂正丁醇∶乙酸乙酯∶水(体积比5∶1∶6)中杂质4、5、6分配系数比较大,会导致较长的分离时间和较宽的峰形,不适合内吗啡肽-1的分离纯化;在溶剂乙酸乙酯/甲醇/水体系中随着甲醇比例的适当增加,内吗啡肽-1(3)的分配系数达到了合适的范围,同时与杂质的K值差异也较大,保证与杂质有较好的分离度。在乙酸乙酯∶甲醇∶水(体积比 3∶1.5∶3,)体系中不仅目标产物内吗啡肽-1有合适的分配系数0.7,且与其它组分1、2、4、5、6、7的K值差异大于0.5,故将其选择为分离小肽合成粗品中的内吗啡肽-1的溶剂体系。

表1 不同溶剂体系下粗样的分配系数
2.2 内吗啡肽-1的HSCCC分离结果
利用选择的溶剂体系,按照 1.2.3节的方法对内吗啡肽-1粗样进行HSCCC分离,固定相保留率45.0%,分离时间为2.5 h,根据图谱(见图2)收集馏分A(内吗啡肽-1)。阴影部分为馏分收集区间,对组分A进行减压浓缩,得到白色粉末71 mg(进样量为120 mg,粗品纯度64.1%),收率为91.5%。

图2 内吗啡肽-1合成粗样品的HSCCC 色谱图
2.3 产物的纯度检测和鉴定
将收集到的A峰与内吗啡肽-1标样进行HPLC检测,从HPLC 色谱图中可以看出,在280 nm波长条件下,馏分A 仅有一个色谱峰出现且保留时间与内吗啡肽-1标样相同(见图3),同时采用HPLC峰面积归一化法,计算分离得到的馏分A 的纯度为99.1%,回收率为91.5%,与传统的小肽分离方法相比效果显著。如Giuliana等[14]采用硅胶柱分离内吗啡肽-1的类似物,回收率只有 60%~90%,Wang等[15]采用硅胶柱层析法分离内吗啡肽-2的类似物回收率为40%~90%。
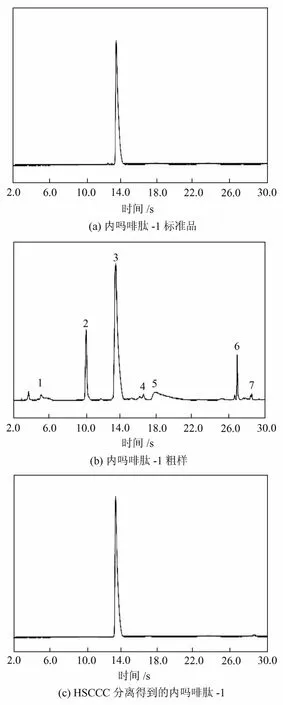
图3 内吗啡肽-1的HPLC色谱图
对馏分 A作高分辨质谱检测,HRMS:m/z611.2994. Tyr-Pro-Trp-Phe-NH2(C34H39N6O5)[M+H]+的理论计算值为611.2982,在仪器误差范围内与内吗啡肽-1的相对分子质量一致;对分离所得的内吗啡肽-1进行核磁分析(核磁共振结果由中国药科大学提供):1HNMR(DMSO,500 MHz):δ10.79(trans)和 10.74(cis)(s,s,1H,W1NH),9.43(cis)和9.35(trans)(s,s,1H,YOH),8.22(d,8.3,1H,WNH),8.03,7.85(dd,8.1,2H,YNH2),7.99(d,7.5,1H,FNH),7.59~7.56(m,trans+cis,1H,W2ar),6.90~7.33(m,14H,aromatic),6.70~6.67(m,trans+cis,2H,Y3,5),4.39~4.51(m,3H,PαWαFα),4.18(t,6.0,1H,Yα),2.77~3.09(m,8H,Yβ1Yβ2Fβ1Fβ2Wβ1Wβ2Pδ1Pδ2),1.50~1.96(m,4H,Pβ1Pβ1Pg1Pg2)。13C NMR(DMSO,500M Hz,trans+cis)δ172.6、172.5、170.9、170.8、170.7、170.3、167.0、156.7、156.5、137.7、136.0、130.7、130.3、129.2、127.9、127.3、127.2、126.2、124.6、124.0、123.6、123.2、120.9、120.8、118.2、115.3、111.4、111.2、109.9、109.7、59.6、59.1、53.6、52.5、46.7、37.4、36.3、35.3、31.1、28.8、27.5、27.4、24.4。综合 HPLC,质谱及核磁共振谱的检测结果可确定馏分A 为内吗啡肽-1。
3 结 论
采用高速逆流色谱首次分离了化学酶法合成二肽混合物,利用乙酸乙酯-甲醇-水(体积比为3∶1.5∶3)溶剂体系从120 mg(粗样含量64.1%)的合成粗样中一步分离得到71 mg纯度为99.1%的内吗啡肽-1,回收率为 91.5%。方法简捷、快速、回收率高,为分离制备高纯度的内吗啡肽-1提供了实用的手段,同时也为化学法或化学酶法合成肽类产品的高效分离纯化提供指导。
[1]James Zadina E,Hackler L,Ge L J,et al. A potent and selective endogenous agonist for the μ-opiate receptor[J].Nature,1997,386,499-502.
[2]Biondi B,Giannini E,Negri L,et al. Opioid peptides:Synthesis and biological activity of new endomorphin analogs[J].International Journal of Peptide Research and Therapeutics,2006,12:145-151.
[3]梁月洁,孟庆国,孙海军. 混合酸酐法合成内吗啡肽-1[J]. 中国新药杂志,2008,17(16):1405-1407.
[4]何平,黄卓烈,黎春怡,等. 海藻酸钠-壳聚糖固定化木瓜蛋白酶催化内吗啡肽的合成[J]. 中国生物化学与分子生物学报,2008,24(5):426-431.
[5]Cardillo G,Gentilucci L,Melchiorre P,et al. Synthesis and binding activity of endomorphin-1 analogues containingβ-amino acids[J].Bioorganic & Medicinal Chemistry Letter,2000,10:2755-2758.
[6]李建许,刘彤光,杨海龙,等. 从中华硬蜱神经节中分离出两种神经肽[J]. 科学通报,2006,21(51):2501-2504.
[7]Zhang Shaojun,Wang Mingyv,Wang Changhai. Preparative separation and purification of alkaloids from Rhizoma coptidis by high-speed counter-current chromatography[J].Separation and Purification Technology,2011,76(3):428-431.
[8]Guo Shuying,Feng Bo,Zhu Ruonan,et al. Preparative isolation of three anthraquinones from rumex japonicus by high-speed counter-current chromatography[J].Molecules,2011,16(2):1201-1210.
[9]黄海滨,成莉,吴玉强,等. 近十年高速逆流色谱法在中药分离制备方面的应用概况[J]. 广西中医学院学报,2006,9(4):85-87.
[10]Hostettmann K. Droplet counter-current chromatography——New applications in natural products chemistry[J].Journal of Liquid Chromatography,1984,7(2):231-242.
[11]Du Qizhen,Li Zhonghua. Preparative separation of isoflavone components in soybeans using high-speed counter-current chromatography[J].Journal of Chromatography A,2001,923(1-2):271-274.
[12]Sun Honglin,He Bingfang,Xu Jiaxing,et al. Efficient chemoenzymatic synthesis of endomorphin-1 using organic solvent stable proteases to green the synthesis of the peptide[J].Green Chemistry,2011,13(7):1680-1685.
[13]Ito Y. Golden rules and pitfalls in selecting optimum conditions for high-speed counter-current chromatography[J].Journal of Chromatogr A,2005,1065:145-168.
[14]Giuliana Cardillo,Luca Gentilucci,Paolo Melchiorrea,et al. Synthesis and binding activity of endomorphin-1 analogues containingβ-amino acids[J].Bioorganic & Medicinal Chemistry Letters,2000,10:2755-2758.
[15]Wang Changlin,Yao Jinlong,Ye Yua,et al. Structure-activity study of endomorph- hin-2 analogs with C-terminal modifications by NMR spectroscopy and molecular modeling[J].Bioorganic & Medicinal Chemistry Letters,2008,16:6415-6422.
Preparative isolation and purification of endormophin-1 by high-speed counter-current chromatography
XU Xuxu1,MAO Zheng2,WU Bin1,SUN Honglin1,HE Bingfang1
(1College of Biotechnology and Pharmaceutical Engineering,Nanjing University of Technology,Nanjing 210009,Jiangsu,China;2Zhejiang Food and Drug Administration Training Center,
Hangzhou 310012,Zhejiang,China)
Endormophin-1 synthesized by chem-biological method was purified by high-speed counter-current chromatograph technology(HSCCC). The optimum separation conditions were as follows:A two-phase solvent system was ethyl acetate-methanol-water(3∶1.5∶3,v/v/v). The lower phase as the mobile phase was operated at a flow rate of 1.0 mL /min,while the apparatus was rotated at 900 r/min,and detection were length was at 280 nm. Each time 120 mg of the crude sample was loaded under these conditions,and 71 mg of endorphin-1 with the purity of 99.1% was obtained. The recovery was 91.5%. The method was relatively simple,fast,and applicable to the large-scale isolation and separation of endormophin-1.
high-speed counter-current chromatography(HSCCC);preparative isolation and purification ;endormophin-1
TQ 028.9+8
A
1000-6613(2011)09-2064-05
2011-03-03;修改稿日期2011-04-27。
国家973计划项目(2011CB710800)。
许旭旭(1985—),男,硕士研究生。联系人:何冰芳,博士,教授,主要从事应用微生物、酶工程方面的研究。E-mail bingfanghe@njut.edu.cn。
