三种接种物启动Anammox-EGSB反应器的性能
2011-09-29丁爽郑平唐崇俭张吉强胡安辉
丁爽,郑平,唐崇俭,张吉强,胡安辉
浙江大学环境工程系,杭州 310058
三种接种物启动Anammox-EGSB反应器的性能
丁爽,郑平,唐崇俭,张吉强,胡安辉
浙江大学环境工程系,杭州 310058
为了优选接种物和加速厌氧氨氧化 (Anammox) 反应器启动,分别以厌氧产甲烷污泥 (Anaerobic methanogenic sludge,AMS)、新鲜厌氧氨氧化污泥 (Fresh Anammox sludge,FAS) 和储藏厌氧氨氧化污泥 (Stored Anammox sludge,SAS)作为接种物,研究了厌氧氨氧化膨胀颗粒污泥床 (Anammox-EGSB) 反应器 (R1、R2和 R3) 的启动性能。结果表明:3种接种物均能成功启动Anammox-EGSB反应器,启动性能的优劣次序为:R2 (接种物为FAS)>R3 (接种物为SAS)>R1 (接种物为AMS)。三种接种物启动Anammox反应器呈现不同的过程特性。R1的启动过程分为菌体水解期 (15 d)、活性迟滞期 (54 d) 和活性提高期 (40 d);R2的启动过程分为活性迟滞期 (2 d) 和活性提高期 (15 d);R3的启动过程分为活性迟滞期 (12 d) 和活性提高期 (57 d)。将Anammox污泥潜浴于Anammox反应器出水中,是长期储藏Anammox污泥的有效方法;反应器内氨氮去除率、反硝化作用比例和三氮比例均可作为Anammox反应器启动进程的指示参数。
厌氧氨氧化,接种污泥,启动性能
Abstract:In order to select better seeding sludge and promote start-up of Anammox reactors, we studied the start-up performances of three Anammox-EGSB bioreactors inoculated with anaerobic methanogenic sludge (AMS) (R1), Fresh Anammox sludge (FAS) (R2) and stored Anammox sludge (SAS) (R3), respectively. Results showed that these three seeding sludges could start up Anammox-EGSB bioreactors successfully, but the start-up progresses showed different characteristics. The start-up course of R1 could be divided into three phases including autolysis phase (15 d), lag phase (54 d) and activity elevation phase (40 d). However, the start-up courses of R2 and R3 only included lag phase (2 d and 12 d, respectively) and activity elevation phase (15 d and 57 d, respectively). Besides, the performance of R3 was better than that of R1, but worse than that of R2.Furthermore, bathing the Anammox sludge in the effluent of bioreactors was a convenient and effective way to keep the activity of the Anammox sludge. The ammonia removal efficiency, percentage of denitrification and the stoichiometric ratios ofcould serve as indicators to monitor the start-up of Anammox bioreactors.
Keywords:Anammox, seeding sludge, start-up performance
2000年实施“一控双达标”后,我国有机物污染得到有效遏制,氮素污染上升为主要环境问题。2009年中国环境状况公报显示,我国氨氮排放量达122.6万 t[1]。氮素污染所致的湖泊“水华”及近海“赤潮”频发,已危及农业、渔业、旅游业等诸多行业,并对饮水卫生和食品安全构成严重威胁。氮素污染的防治迫在眉睫,刻不容缓。
厌氧氨氧化 (Anaerobic ammonium oxidation,Anammox,反应式 1) 工艺是一种新型生物脱氮工艺[2-5],已成功应用于消化污泥压滤液的脱氮处理,容积去除速率高达9.50 kg N/(m3·d)[5],远高于传统硝化-反硝化工艺 [0.23~0.5 kg N/(m3·d)][6];其处理成本仅为€0.75/kg N,远低于传统生物脱氮工艺(€2-5/kg N)[7]。Anammox工艺的高效性和经济性使其成为废水脱氮的重要升级技术。

然而,Anammox菌属自养型细菌,倍增时间长,细胞产率低[2],致使Anammox反应器启动缓慢[7-11],世界上第一个生产性 Anammox反应器的启动过程长达3.5年[5],启动难已成为Anammox工艺推广应用的瓶颈。菌种 (接种物) 是生物处理的根本,选取适宜的接种物是提高生物处理效能的必要条件。因此,从选取合适菌种以缩短Anammox反应器启动时间的角度出发,本研究采用厌氧膨胀颗粒污泥床(Expanded granular sludge bed,EGSB) 反应器,试验厌氧产甲烷污泥 (Anaerobic methanogenic sludge,AMS)、新鲜 Anammox 污泥 (Fresh Anammox sludge)和储藏 Anammox污泥 (Stored Anammox sludge,SAS) 的启动性能,以期为Anammox反应器优选接种物和快速启动提供依据。
1 材料与方法
1.1 试验废水
试验采用模拟废水,其组成 (g/L) 为:KH2PO40.01,CaCl2·2H2O 0.0056,MgSO4·7H2O 0.3,KHCO31.25;微量元素浓缩液Ⅰ和Ⅱ各1.25 mL/L。和以 (NH4)2SO4和 NaNO2提供,浓度按需配制。
微量元素浓缩液Ⅰ的组成 (g/L) 为:EDTA 5,FeSO45。微量元素浓缩液Ⅱ的组成 (g/L) 为:EDTA 15,H3BO40.014,MnCl2·4H2O 0.99,CuSO4·5H2O 0.25,ZnSO4·7H2O 0.43,NiCl2·6H2O 0.19,NaSeO4·10H2O 0.21,NaMoO4·2H2O 0.22。
1.2 试验装置
Anammox工艺的装置与流程如图1所示。试验采用3个EGSB反应器,分别记为R1、R2和R3。反应器由有机玻璃制成,总容积8.0 L,有效容积4.0 L,污泥接种量3.0 L,外裹黑布,以防止光照的负面影响。废水通过蠕动泵连续泵入Anammox-EGSB反应器内,基质 (氨和亚硝酸) 随发酵液上升运动,由Anammox菌转化为N2。经三相分离器分离后,N2从反应器顶部的气室引出,出水从反应器上部的溢流堰排放。进水pH控制在6.8~7.0,操作温度控制在 (35±1) ℃。

图1 Anammox-EGSB工艺的装置与流程Fig. 1 Schematic diagram of Anammox-EGSB system. 1:influent tank; 2: peristaltic pump; 3: water distributor zone; 4:reaction zone; 5: sample ports; 6: three-phase separator; 7:settling zone; 8: NaOH solution tank; 9: gas outlet; 10:effluent tank.
1.3 接种污泥
接种污泥为AMS、FAS和SAS,分别接种于R1、R2和R3,其理化性质见表1。AMS取自浙江某造纸厂废水处理的厌氧内循环反应器 (Internal circulation,IC) 反应器;FAS直接取自本实验室的高负荷Anammox反应器;SAS取自本实验室的 Anammox污泥储罐,潜浴于出水中3个月,不作其他特殊维护。

表1 接种污泥的理化性质Table 1 Initial characteristics of the three seeding sludges
1.4 测定项目与方法
氨氮:水杨酸–次氯酸盐光度法[12];亚硝氮:N-(1-萘基)-乙二胺光度法[12];硝氮:紫外分光光度法[12];SS和 VSS:采用重量法[12];pH:pHS-9V型酸度计测定;粒径:Lecia DM2LB图像分析系统(Qwin V3)。
2 结果与分析
2.1 AMS的启动性能
以AMS为接种物的R1反应器的启动性能如图2~5所示,其启动过程可分为菌体水解期、活性迟滞期和活性提高期3个阶段。
2.1.1 菌体水解期
1~15 d为菌体水解期,主要特征为部分菌体自溶,导致出水氨氮浓度高于进水氨氮浓度。在该阶段,平均进水氨氮和亚硝氮浓度均为 (50.00±5.53) mg/L,平均出水氨氮、亚硝氮和硝氮浓度分别为 (62.13±29.55) mg/L、(0.01±0.03) mg/L 和 (0.22±0.62) mg/L;平均氨氮和亚硝氮去除率分别为 (−24.27±59.11)%和 (99.99±0.05)%;平均容积总氮负荷 (Volumetric nitrogen loading rate,VNLR) 和容积总氮去除速率(Volumetric nitrogen removal rate,VNRR) 分别为0.26 kg/(m3·d)和 (0.12±0.06) kg/(m3·d);亚硝氮的去除量和氨氮去除量之比以及硝氮产生量和氨氮去除量之比严重偏离理论值1.32和0.26。由于污泥所处环境从原来的富有机质条件 (IC反应器) 转变为现在的贫有机质条件 (Anammox反应器),接种污泥中的部分菌体发生自溶,导致出水氨氮浓度高于进水氨氮浓度;反应器内的生物反应以异养反硝化为主,未检测到Anammox反应。
2.1.2 活性迟滞期
16~68 d为活性迟滞,主要特征为菌体停止自溶,氨氮与亚硝氮开始同时消失 (Anammox活性开始显现)。在该阶段,平均进水氨氮和亚硝氮浓度均为 (58.09±11.52) mg/L,平均出水氨氮、亚硝氮和硝氮浓度分别为 (45.01±15.05) mg/L、(0.05±0.15) mg/L和0 mg/L;平均氨氮和亚硝氮去除率分别为 (11.52±20.05)%和 (99.93±0.24)%;平均VNLR、VNRR和容积产气率 (Volumetric gas production rate,VGPR)分别为 (0.31±0.06) kg/(m3·d)、(0.17±0.05) kg/(m3·d)和 (0.03±0.07) L/(L·d) ;和仍远离理论值 1.32和 0.26。在活性迟滞期前段,进水氨氮浓度与出水氨氮浓度基本持平;在活性迟滞期后段,氨氮有一定的去除,至69 d,氨氮去除率跃升为65.88%,标志活性迟滞期结束。
2.1.3 活性提高期
69~108d为活性提高期,主要特征为菌体数量的增长和菌体活性的提高,氨氮与亚硝氮同时消失量增加 (Anammox活性大幅提高)。在该阶段,平均进水氨氮和亚硝氮浓度分别为 (170.71±55.58) mg/L和 (187.56±58.54) mg/L,平均出水氨氮、亚硝氮和硝氮浓度分别为 (36.16±10.23) mg/L、(1.60±4.60) mg/L和 0 mg/L;平均氨氮和亚硝氮去除率分别为(76.32±9.97)%和 (99.20±2.03)%;平均 VNLR、VNRR 和 VGPR 分别为 (0.94±0.30) kg/(m3·d)、(0.84±0.30) kg/(m3·d) 和 (0.59±0.25) L/(L·d)。(1.47±0.26)和0,前者与理论值1.32差距缩小,而后者仍远离理论值0.26。在以氨和亚硝酸为基质的无机条件下,异养菌受到抑制,Anammox菌得以富集,反应器内的主导反应由反硝化转变为Anammox反应。
2.2 FAS的启动性能
以FAS为接种物的R2反应器的启动性能如图2~5所示。整个启动过程可分为活性迟滞期和活性提高期2个阶段。
2.2.1 活性迟滞期
1~2 d为活性迟滞期,主要特征为菌体适应和活性维稳。在该阶段,平均进水氨氮和亚硝氮浓度均为 (182.05±5.63) mg/L,平均出水氨氮、亚硝氮和硝氮浓度分别为 (32.33±0.16) mg/L、(2.31±0.54) mg/L和 (21.01±3.70) mg/L;平均氨氮和亚硝氮去除率分别为 (82.23±0.09)%和 (98.73±0.29)%;平均 VNLR、VNRR 和 VGPR 分别为 (5.96±0.00) kg/(m3·d)、(5.39±0.01) kg/(m3·d) 和 (4.13±0.01) L/(L·d)。分 别 为(1.20±0.01) 和 (0.14±0.02),前者与理论值 1.32 接近,后者与理论值0.26仍有一定的偏离。
2.2.2 活性提高期
3~17 d为活性提高期,主要特征为菌体数量增加和菌体活性提高。在该阶段,平均进水氨氮和亚硝氮浓度为 (185.7± 36.41) mg/L 和 (197.87±18.22) mg/L,平均出水氨氮、亚硝氮和硝氮浓度分别为 (22.45±4.94) mg/L、(1.30±1.27) mg/L 和 (33.35±6.55) mg/L;平均氨氮和亚硝氮的去除率分别为 (87.85±2.90)%和 (99.36±0.58)%;平均 VNLR、VNRR和 VGPR分别为 (6.90±1.03) kg/(m3·d)、(6.48±1.04) kg/(m3·d)和 (4.95±0.71) L/(L·d)。分别为 (1.20±0.05) 和 (0.20±0.03),相比活性迟滞期,以上两者更接近理论值1.32和0.26。
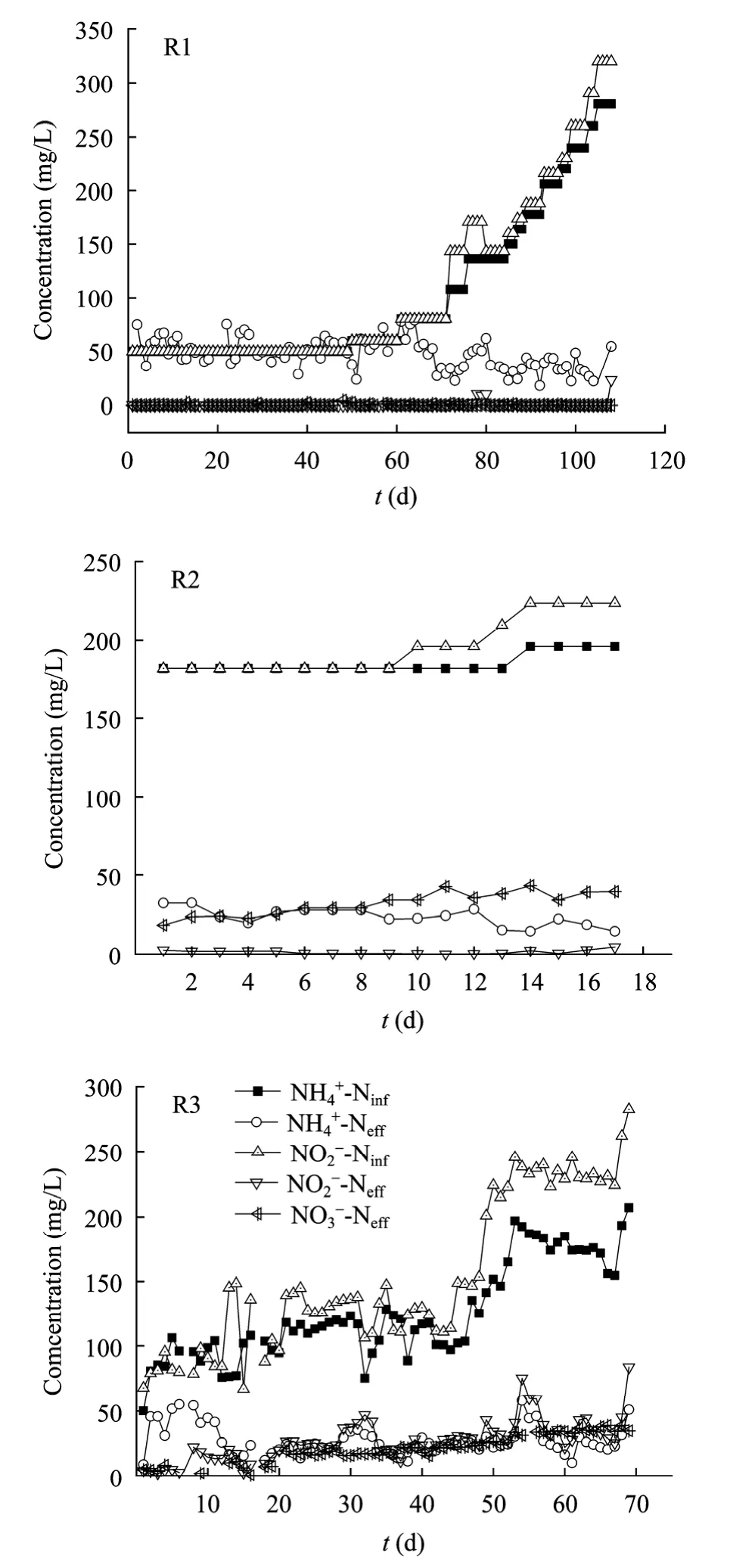
图2 R1、R2和R3反应器进出水三氮浓度Fig. 2 The influent concentrations of-N and effluent concentrations ofof R1, R2 and R3.
2.3 SAS的启动性能
以SAS为接种物的R3反应器的启动性能如图2~5所示。整个启动过程可分为活性迟滞期和活性提高期2个阶段。

图 3 R1、R2和 R3反应器的容积负荷、容积去除率和容积产气率Fig. 3 VNLR, VNRR and VGPR of R1, R2 and R3.
2.3.1 活性迟滞期
1~12 d为活性迟滞期,主要特征为菌体的适应,Anammox功能较强,反硝化作用仍占一定比例。在该阶段,平均进水氨氮和亚硝氮浓度分别为 (87.90±15.69) mg/L和 (84.00±8.37) mg/L,平均出水氨氮、亚硝氮和硝氮浓度分别为 (40.45±12.20) mg/L、(9.37±7.24) mg/L 和 (4.53±2.40) mg/L;平均氨氮和亚硝氮去除率分别为 (55.30±12.20)%和 (89.02±8.43)%;平均 VNLR、VNRR和 VGPR分别为(0.92.±0.18) kg/(m3·d) 、 (0.65±0.11) kg/(m3·d) 和(0.43±0.11) L/(L·d);分别为 (1.61±0.31) 和 (0.10±0.04),偏离理论值1.32和0.26。

图4 R1、R2和R3反应器的基质去除率Fig. 4 Substrate removal efficiency of R1, R2 and R3.
2.3.2 活性提高期
13~69 d为活性提高期,主要特征为菌体数量的增加和菌体活性的提高。在该阶段,平均进水氨氮和亚硝氮浓度分别为 (133.13±36.00) mg/L 和(166.54±55.50) mg/L,平均出水氨氮、亚硝氮和硝氮浓度分别为 (25.60±10.80) mg/L、(30.68±14.76) mg/L和 (22.87±9.26) mg/L;平均氨氮和亚硝氮去除率分别为(80.18±7.81)%和 (81.42±7.19)%;平均 VNLR、VNRR 和 VGP 分 别 为 (2.29.±0.88) kg/(m3·d)、(1.85±0.75) kg/(m3·d) 和 (1.38±0.53) L/(L·d) 。分 别 为(1.27±0.25) 和 (0.21±0.06),两者与理论值 1.32 和0.26相差不大。该阶段 Anammox反应已占主导地位,反应器的Anammox功能不断增强。

图5 R1、R2和R3反应器内三种氮素的化学计量比Fig. 5 Stoichiometric ratio ofandof R1, R2 and R3.
3 讨论
3.1 Anammox反应器启动进程的指示参数
Anammox反应器中存在多种微生物反应,其启动过程实际上是 Anammox反应逐步在反应器占据主导地位的演变过程。这种转变过程可以通过基质利用、产物形成等现象表现出来,因此可用基质利用和产物形成作为 Anammox反应器的启动进程的指示参数。
第一,氨氮去除率可指示Anammox反应器启动性能的变化。在菌体水解期,R1的氨氮没有去除反而增加,表明R1内几乎没有Anammox反应;在活性迟滞期,R1、R2和R3内氨氮均得到了一定的去除,表明 3个反应器内显现一定强度的 Anammox反应;在活性提高期,R1、R2和R3内氨氮均有较高的去除,表明3个反应器内Anammox反应增强。因此,在厌氧条件下,氨氮的去除可以反映Anammox反应的强度并指示反应器的启动进程。
第二,反硝化作用的比例可指示Anammox反应器启动性能的变化。由表 2可知,在菌体水解期和活性延滞期,R1反应器的Anammox活性较低,主导反应为反硝化作用,而到活性提高期,R1反应器的主导反应发生质变,Anammox反应几乎完全替代反硝化作用。在活性迟滞期和活性提高期,R2、R3反应器的主导反应均为Anammox反应。因此,反硝化作用的比例可作为 Anammox反应器启动进程的指示参数。
表2 Anammox-EGSB启动过程中反硝化作用对于去除的贡献率Table 2 Percentage of denitrification that contributes to the removal of

表2 Anammox-EGSB启动过程中反硝化作用对于去除的贡献率Table 2 Percentage of denitrification that contributes to the removal of
Autolysis phase(%)Lag phase(%)Activity elevation phase (%)R1 100.00 70.25 00.00 R2 − 00.00 00.00 R3 − 23.80 00.00
第三,3种氮素之间的比例可指示Anammox反应器启动性能的变化。氨氮与亚硝氮以特定的比例被同时去除是Anammox反应的重要特征。R1启动后的一直远远偏离理论值,直到69 d左右才逐渐接近理论值;R3启动后,也偏离理论值,但相比R1,偏离程度不大且很快接近理论值;R2启动后,则接近于理论值。因此,可反映 Anammox反应成为主导反应的过程。在Anammox过程中,固定CO2所需的能量和还原力来自于将亚硝酸盐转化为硝酸盐的过程,因此,硝氮产量在某种程度上反映了Anammox菌的增殖情况[13]。R1启动后,一直远离理论值,其原因有待进一步探究;R3启动后,逐步接近理论值;R2启动后,接近理论值。因此,也能反映Anammox反应器性能的变化。
3.2 三种接种污泥对 Anammox-EGSB反应器的启动性能比较
由表3可知,R1呈现菌体水解期、活性迟滞期和活性提高期 3个阶段,而 R2、R3没有菌体水解期,仅有活性迟滞期和活性提高期2个阶段。R1的启动周期最长,R3次之,R2最短。
传统的硝化反硝化工艺的总氮负荷最高约为0.5 kg/(m3·d)[6],若以此作为启动成功的标准,结合表4可知启动时间为:R1(83 d)>R3(0 d)=R2(0 d)。目前一般 Anammox反应器的总氮负荷为0.6~2.5 kg/(m3·d)[14-15],若以 1.0 kg/(m3·d) 为启动成功的标准,则启动时间为:R1(93 d)>R3(7 d)>R2(0 d)。AMS、FAS和SAS均能用作接种物成功启动EGSB反应器;相比AMS,以FAS和SAS启动Anammox反应器,菌体水解期和活性迟滞期明显缩短,3种接种物以FAS最佳,SAS次之,AMS最差。

表3 Anammox-EGSB反应器启动过程的比较Table 3 Process comparison of Anammox-EGSB bioreactors started up with the three seeding sludges
3.2 启动菌源的选取
生物反应器的转化效能在一定程度上取决于菌种的数量和活性。因此,菌种的选取对生物反应器的快速启动具有十分重要的工程意义。Imajo等[16]研究表明,AMS颗粒污泥可以作为Anammox菌的附着载体,形成Anammox菌生物膜,并逐步转化为Anammox颗粒污泥。唐崇俭等[17]研究表明,以AMS颗粒污泥为接种物可以成功启动Anammox反应器,启动时间约为122 d。本研究也得到相近的结果。因此,在没有高效 Anammox菌源的情况下,AMS也是一种可取的选择。
随着Anammox工程的发展[5,16-19],直接以高效Anammox污泥作为接种物已成为可能。但是由于Anammox生长缓慢,细胞产率很低,要一次性提供大量Anammox污泥尚有困难。要达到工程启动所需的菌种量,需要菌种积累和储藏过程。本课题组把 Anammox污泥潜浴于 Anammox反应器出水中,试验证明,经 3个月的储存后,其 Anammox活性仍能维持,将其用于Anammox反应器启动,容积氮去除速率可在7 d内超过1 kg/(m3·d),启动时间显著短于 AMS。菌种保藏是费钱费力的过程,将Anammox污泥潜浴于Anammox反应器出水中,简单易行,不失为储藏Anammox污泥的有效方法。
4 结论
3种接种物均能成功启动Anammox-EGSB反应器,启动性能优劣次序为:R2(接种为 FAS)>储R3(接种物为SAS)>R1 (接种物为AMS)。3种接种物启动 Anammox反应器呈现不同的过程特征。R1的启动过程有菌体水解期 (15 d)、活性迟滞期 (54 d)和活性提高期 (40 d) 3个阶段;R2和R3的启动过程均只有活性迟滞期 (分别为2 d和12 d) 和活性提高期 (分别为15 d和57 d) 两个阶段。反应器内指示主导反应变化的参数可作为判断 Anammox反应器启动进程的重要依据。3种接种物物以FAS最佳,SAS次之,AMS最差;将 Anammox污泥潜浴于Anammox反应器出水中,是长期储藏Anammox污泥的有效方法。

表4 Anammox-EGSB反应器的启动性能比较Table 4 Performance comparison of Anammox-EGSB reactors started up with the three seeding sludges
REFERENCES
[1] The State of Environment in China in 2009[EB/OL].[2010-07-12]. http://jcs.mep.gov.cn/hjzl/zkgb/2009hjzkgb/201006/t20100603_190435.htm.
2009年中国环境状况公报[EB/OL]. [2010-07-12].http://jcs.mep.gov.cn/hjzl/zkgb/2009hjzkgb/201006/t2010 0603_190435.htm.
[2] Mulder A, van de Graaf AA, Robertson LA, et al.Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor. FEMS Microbiol Ecol,1995, 16(3): 177−184.
[3] Strous M, Fuerst JA, Kramer EHM, et al. Missing lithotroph identified as new planctomycete. Nature, 1999,400(6743): 446−449.
[4] Zheng P, Xu XY, Hu BL. New theory and Technology for Biological Nitrogen Remaval. Beijing: Science Press,2004: 5−7.
郑平, 徐向阳, 胡宝兰. 新型生物脱氮理论与技术. 北京: 科学出版社, 2004: 5−7.
[5] van der Star WRL, Abma WR, Bolmmers D, et al. Startup of reactors for anoxic ammonium oxidation: Experiences from the first full-scale anammox reactor in Rotterdam.Water Res, 2007, 41(18): 4149−4163.
[6] Gerardi MH. Nitrification and Denitrification in the Activated sludge Process. New York: Jhon Wiley & Sons,Inc, 2002.
[7] Jetten MSM, Wagner M, Fuerst J, et al. Microbiology and application of the anaerobic ammonium oxidation(‘anammox’) process. Curr Opin Biotechnol, 2001, 12(3):283−288.
[8] Zhang SH, Zheng P. Studies On start-up technique of anammox bioreactor. China Environ Sci, 2004, 24(4):496−500.
张少辉, 郑平. 厌氧氨氧化反应器启动方法的研究. 中国环境科学, 2004, 24(4): 496−500.
[9] Meng FN, Zhang SJ, Wang HC,et al. The start-up of dealing with reject water by ANAMMOX inoculatd with mixed sludge. China Environ Sci, 2009, 29(3): 318−324.
孟凡能, 张树军, 王洪臣, 等. 混合污泥接种的厌氧氨氧化处理污泥脱水液的启动. 中国环境科学, 2009,29(3): 318−324.
[10] Pynaert K, Smets BF, Beheydt D, et al. Start-up of autotrophic nitrogen removal reactors via sequential biocatalyst addition. Environ Sci Technol, 2004, 38(4):1228−1235.
[11] Wang T, Zhang HM, Yang FL, et al. Start-up of the Anammox process from the conventional activated sludge in a membrane bioreactor. Bioresour Technol, 2009,100(9): 2501−2506.
[12] China Bureau of Environmental Protection. Methods for Monitor and Analysis of Water and Wastewater. 4th ed.Beijing: China Press of Environmental Science, 2002.
国家环保局. 水和废水监测分析方法. 4版. 北京: 中国环境科学出版社, 2002.
[13] Jetten MSM, van Niftrik L, Strous M, et al. Biochemistry and molecular biology of anammox bacteria. Crit Rev Biochem Mol Biol, 2009, 44(2/3): 65−84.
[14] Zhang SH, Zheng P, Hua YM. Nitrogen removal from sludge dewatering effluent through anaerobic ammonia oxidation process. J Environ Sci, 2005, 17(6): 1030−1033.
[15] Dapena-Mora A, Van Hulle SWH, Campos JL, et al.Enrichment of Anammox biomass from municipal activated sludge:experimental and modeling results. J Chem Technol Biotechnol, 2004, 79(12): 1421−1428.
[16] Imajo U, Tokutomi T and Furukawa K. Granulation of Anammox microorganisms in up-flow reactors. Water Sci Technol, 2004, 49(5/6): 155–164.
[17] Tang CJ,Zheng P,Chen JW, et al. Performance of Anammox bioreactors started up with different seeding sludges. China Environ Sci, 2008, 28(8): 683−688.
唐崇俭, 郑平, 陈建伟, 等. 不同接种物启动 Anammox反应器的性能研究. 中国环境科学, 2008, 28(8):683−688.
[18] Abma W, Schultz CE, Mulder JW, et al. The advance of Anammox. Water 21, 2007, 36: 36−37.
[19] Joss A, Salzgeber D, Eugster J, et al. Full-scale nitrogen removal from digester liquid with partial nitritation and anammox in one SBR. Environ Sci Technol, 2009, 43(14):5301−5306.
Performances of Anammox-EGSB bioreactors started up with three different seeding sludges
Shuang Ding, Ping Zheng, Chongjian Tang, Jiqiang Zhang, and Anhui Hu
Department of Environmental Engineering, Zhejiang University, Hangzhou 310058, China
Received: July 16, 2010; Accepted: November 16, 2010
Supported by: National High Technology Research and Development Program of China (863 Program) (No. 2009AA06Z311), National Natural Science Foundation of China (No. 31070110).
Corresponding author: Ping Zheng. Tel/Fax: +86-571-86971709; E-mail: pzheng@zju.edu.cn
国家高技术研究发展计划 (863计划) (No. 2009AA06Z311),国家自然科学基金 (No. 31070110) 资助。
