蒸汽爆破玉米秸秆酶解动力学
2011-09-29任省涛程可可宋安东张建安
任省涛,程可可,宋安东,张建安
1 河南农业大学生命科学学院,郑州 450002
2 清华大学核能与新能源技术研究院,北京 100084
蒸汽爆破玉米秸秆酶解动力学
任省涛1,2,程可可2,宋安东1,张建安2
1 河南农业大学生命科学学院,郑州 450002
2 清华大学核能与新能源技术研究院,北京 100084
为了掌握蒸汽爆破玉米秸秆的酶解特性,研究了不同底物浓度、酶浓度、温度对反应速率的影响。运用米氏方程对酶解动力学过程进行拟合,结果表明,纤维素酶对该玉米秸秆的水解反应在反应前3 h符合一级反应,可用米氏方程对其进行拟合。在转速为120 r/min、酶浓度为1.2 FPU/mL、pH 5.0、温度为45 ℃时米氏常数Km为11.71 g/L,最大反应速率Vm为1.5 g/(L·h)。确立了包括底物浓度、酶浓度、温度在内的酶解动力学模型,该模型适合温度为30 ℃~50 ℃。
米氏方程,玉米秸秆,酶解,动力学,纤维素酶
Abstract:In order to learn the enzymatic hydrolysis characteristics of steam-explosion pretreated corn straw by cellulase, the effects of substrate concentration, cellulase concentration and temperature were determined. The kinetics of the hydrolysis reaction could be described with the Michealis-Menten equation, and the hydrolysis reaction obeyed the classical first-order reaction rate in the first three hours. In the condition of 45 °C and pH 5.0 and the stirring rate 120 r/min, the Michealis constant (Km) and maximum rate (Vm) for 1.2 FPU/mL of cellulase were 11.71 g/L and 1.5 g/(L·h). The kinetic model, including the parameters such as substrate concentration, enzymatic concentration and temperature, was suit for the hydrolysis reaction under the temperature range from 30 °C−50 °C.
Keywords:Michealis-Menten equation, corn stover, enzymatic hydrolysis, kinetics, cellulase
最近几十年内,全球变暖日益严重,温室气体特别是 CO2气体的排放已经成为人类关注的焦点。化石燃料的燃烧是产生温室气体的直接来源,已成为环境污染的主要根源[1-2]。化石燃料是不可再生资源[3],随着化石燃料的日益枯竭,许多国家都在积极探索新的能源以应对能源危机。生物质能源一直是人类赖以生存的重要资源,在整个能源系统中占据重要地位。我国生物质原料非常丰富,年产量约11.45亿吨,其中秸秆就达7亿多吨,玉米秸秆占到了35%,为我国能源问题提供了巨大的资源[4-5]。
但是由于植物本身对纤维素酶的抗逆性,直接利用纤维素酶酶解植物秸秆效率很低,一般进行预处理。其中,蒸汽爆破以对环境无污染、能耗低被认为是最有前景的预处理方式之一。通过蒸汽爆破预处理可使物料的结构变得分散,从而使纤维素得到充分暴露[6-8],继而有利于后续的酶解和发酵。纤维素类物质的酶解需要几种纤维素酶的协调作用,是一个复杂的物理化学变化过程。其中包括一些物理的、动力学的和大量的转化参数,并且有些情况下这些参数又是可变的,从而导致对纤维素酶酶解纤维素类物质的动力学模型的构建相当困难[9]。纤维素酶解动力学已经研究了将近50年,但是我们对于纤维素酶解动力学的认识仍然是不完善的,仍然不能对结果进行很好的预测。学术界关于纤维素酶酶解纤维素有很多分歧,有人认为酶解纤维素是一个不同纤维素酶的协调作用;有人认为纤维素类物质底物的结构、中间产物 (纤维二糖) 和终产物 (葡萄糖) 对酶解有抑制[10]。Nidetzky等[11]发现各种纤维素酶的协调作用起很重要的作用,在纤维素被绿色木酶复合物降解过程中,各个纤维素酶的吸附慢慢增加,不存在偏好性;而 Converse和 Optekar[12]认为纤维素外切酶更容易被吸附。Andric等[13]研究了葡萄糖在小麦秸秆酶解过程中的抑制作用,发现随着葡萄糖浓度的增加抑制作用逐渐增强,特别是当葡萄糖初始浓度达到40 g/L时,发现在酶解的初期葡萄糖的浓度却在下降,低于初始的 40 g/L,其认为是由于转糖苷的作用;同时用渗透膜对酶解过程中的葡萄糖进行在线分离,从而使酶解速度大大提高。Kadam等[14]认为除了产物如葡萄糖、纤维二糖的抑制外,底物本身的一些性质也是影响酶解速率的一个重要原因,他的研究表明无定形纤维素的酶解速率是结晶纤维素的5~10倍,由此提出了关于底物本身特性的底物活力参数的概念,并构建了包括产物葡萄糖、纤维二糖和底物活力在内的模拟方程。Zheng等[15]用朗缪尔吸附方程模拟了木质素对纤维素酶酶解纤维素的负面影响,并构建了适用于底物浓度范围为 4%~12%、酶加载量为 15~50 FPU/g纤维素的酶解反应方程。本研究采用蒸汽爆破预处理 (2.5 MP,10 min) 的玉米秸秆为底物,进行纤维素酶酶解实验,研究了底物浓度、酶浓度、反应温度对其酶解速率的影响,运用米氏方程并结合Arrhenius方程、范特霍夫方程模拟了包括温度、底物浓度、酶浓度在内的酶解动力学模型,为酶解反应的进一步工艺优化提供了参考。
1 材料与方法
1.1 材料
玉米秸秆:取自郑州北郊河南农业大学实验农场,干燥并粉碎40~60目的玉米秸秆进行蒸汽爆破预处理 (2.5 MPa,10 min)。
纤维素酶:自制的纤维素酶,酶活为100 FPU/mL。酶活测定用DNS法。
1.2 方法
汽爆预处理后的玉米秸秆样中,除含纤维素外,还含有多种水溶性抑制物,可能抑制酶解反应速率[16]。在研究酶解动力学前,先对样品进行充分水洗,以洗脱抑制物。取水洗、干燥后的固体部分,加入所需的酶、水及缓冲液,最后定容为25 mL。用磷酸盐缓冲液调pH为5.0。测前3 h的葡萄糖浓度变化情况,每样2个平行,取平均值。
葡萄糖的测定:高效液相色谱测定。
色谱条件:色谱柱为 Aminex HPX-87H,流动相为0.005 mol/L硫酸,流速为0.8 mL/min,检测器为RID-10A折光示差检测器,柱温为65 ℃,进样体积为 20 µL。
葡萄糖的生成速率 (V) =生成的葡萄糖的含量/溶液体积/反应时间。
2 结果与分析
2.1 底物浓度对反应速率的影响
蒸汽爆破预处理的玉米秸秆经过水洗,取固体部分作底物,在温度为45 ℃,转速为120 r/min,底物浓度[S]分别为 5、10、20、30、40、50、60 g/L时进行酶解。由葡萄糖生成速率对数 (lnv) 对底物对数 (ln[S]) 作图得到图1所示直线,表明在反应开始 3 h内,纤维素酶降解玉米秸秆的反应遵循一级反应规律。由葡萄糖生成速率V对底物浓度[S]作图得到图 2,可以看出初始时由于随着底物浓度的增加,酶的利用率也增加,表现为葡萄糖生成速率不断增加;当底物达到一定值,酶完全与底物结合,此时葡萄糖生成速率达到最大值。此后尽管底物不断加大,反应速率却不再上升而是趋于平衡。曲线符合经典的米氏方程曲线,可以用米氏方程描述。
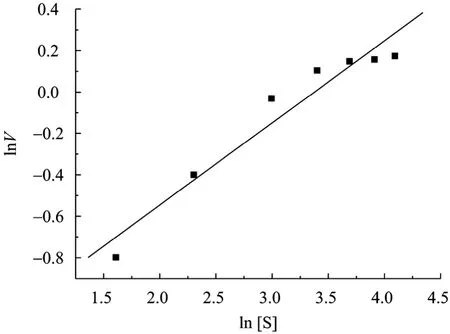
图1 lnV与ln[S] 的关系图Fig. 1 Relationship between lnV and ln[S].

图2 反应速率与玉米秸秆浓度的关系图Fig. 2 Relationship between reaction velocity and corn stover concentration.
Michealis-Menten 提出酶促反应步骤如下:
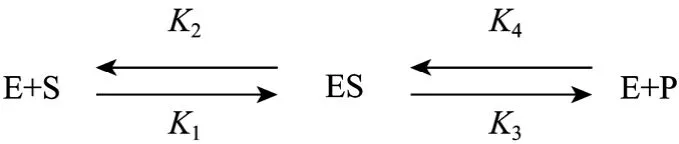
酶 (E) 与底物 (S) 结合形成中间产物 (ES),中间产物分解成产物 (P),从而酶重新游离出来。K1为 (ES) 生成的反应速率常数,K2、K3分别代表(ES) 的分解反应速率常数。K4为 (E)+(P) 复合生成(ES) 的反应速率常数。在反应初期,由于产物P的浓度很低,不足以引起可逆反应,K4可以忽略,因此 (ES) 的形成速率可以写为

开始时底物浓度远远大于酶浓度,即[S]远大于[E],因此被酶结合的底物[ES]可以忽略。所以[S]−[ES]≈[S]
[ES]的分解速率为

根据反应动态平衡,可知[ES]的形成速率跟分解速率相等。

得出动态平衡时的[ES]

因为酶反应速率V与[ES]成正比,所以V=K3[ES]将 (3) 代入得

运用Lineweaver-Burk法,以1/V对1/[S]作图,得到图 3,用最小二乘法线性拟合,可以得到 Vm=1.50 g/(L·h),Km=11.71 g/L。
回归方程

方程的相关系数r=0.998,表明差异极显著。
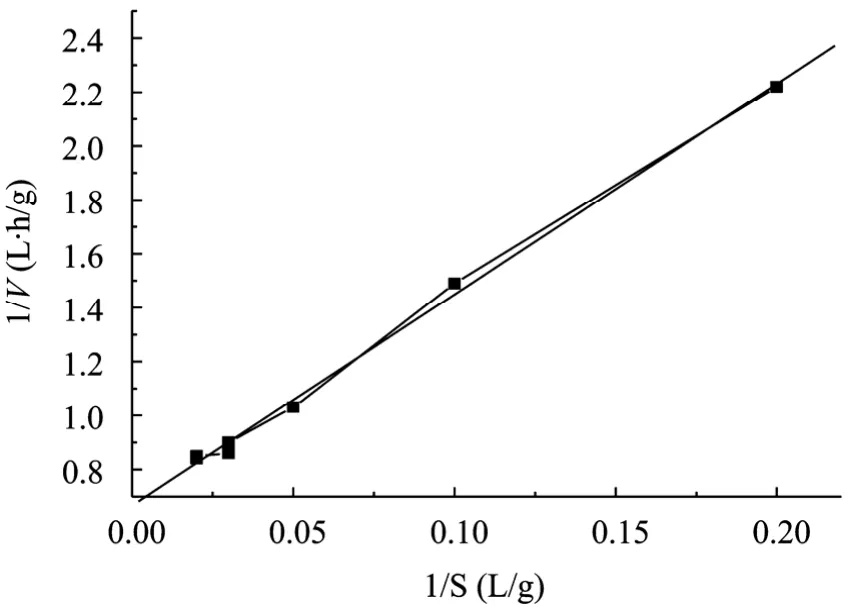
图3 纤维素酶水解玉米秸秆的Lineweaver-Buck图Fig. 3 Lineweaver-Buck plots for corn stover hydrolyzed with cellulose.
高培基等[17]用纯纤维素粉为酶解底物,得到酶解初速度为12 g/(L·h),远远高于蒸汽爆破预处理玉米秸秆为底物所进行的酶解初速度。可能是因为虽然蒸汽爆破使秸秆中的纤维素得到了有效的分离,但是仍然有部分纤维素被半纤维素和木质素包裹;此外不溶的木质素和蒸汽爆破产生的一些抑制物也是产生酶解初速度偏低的原因。
Kadam等[14]认为决定酶解初速度高低的主要原因是底物的无定形区所占的比例。
2.2 酶浓度对反应速率的影响
在温度为45 ℃,转速为120 r/min,底物浓度为60 g/L,反应液酶浓度分别为0.4、0.6、0.8、1.0、1.2 FPU/mL时进行酶解,酶浓度与反应速率的关系如图4所示。
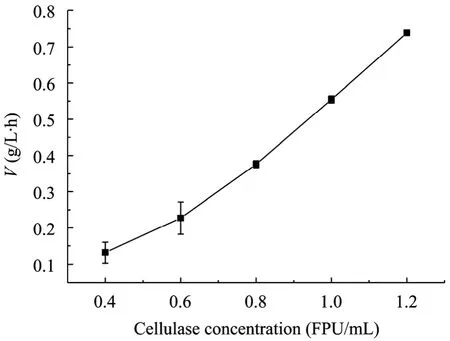
图4 反应速率与酶浓度的关系图Fig. 4 Relationship between reaction velocity and enzyme concentration.
从图 4可以看出,随着酶浓度的增加,反应速率与酶浓度基本呈线性关系,反应速率与酶浓度呈正比。当酶促反应体系的温度、pH不变,底物充分过量的情况下,酶量越大,则生成的产物越多,反应速率就越快。可以用酶促反应机理解释,有方程 (3) 可以写为=K[Et],在底物浓度极大时,[S]在反应过程中的改变量很小,K=K3[S]/(Km+[S])可视为常数,因此反应速率V正比于[Et],两者呈线性关系,与实验结果相符。Linda等[18]用蒸汽预处理的小麦秸秆作底物,酶的加载量分别为3、6、12、14 FPU/g小麦秸秆,发现随着酶浓度的增加,反应速率依次增加,与本实验所得结果一致。
2.3 温度对反应速率的影响
在底物浓度为50 g/L,转速为120 r/min,温度分别为30 ℃、35 ℃、40 ℃、45 ℃、50 ℃时进行酶解,反应温度与反应速率见图5。随温度的升高,酶解速率也随着升高。这一现象与酶促反应的规律相吻合,即在一定范围内,温度升高,酶促反应速率加快。
用lnV对1/T (×103K−1) 作图 (T为华氏温度,K) 如下,运用最小二乘法线性回归可以得到如图6所示直线,可见,lnV在30 ~50 ℃℃范围内与温度倒数呈线性关系,表明纤维素酶降解玉米秸秆反应的反应速率随温度的变化符合Arrhenius方程

图5 反应速率与温度的关系图Fig. 5 Relationship between reaction velocity and temperature.

图6 lnV与1/T关系图Fig. 6 Relationship between lnV and 1/T.

变为指数形式为:V=A×exp(−Ea/RT)
通过线性回归方程求得Ea=38.56 kJ/mol,指前因子 A=14.42 g/(L·h)。统计检验的相关系数r2=0.982,表明 Arrhenius方程对本研究数据的拟合是极显著的。余洪波等[19]以白腐菌生物-碱氧化预处理的玉米秸秆作底物,运用响应面分析了包括温度、pH、转速在内的纤维素酶解反应。结果表明温度在49 ℃,pH为4.8,转速为200 r/min时酶解反应结果最好。Oh等[20]研究了酶解温度为30 ℃~50 ℃的酶解情况,结果显示随着温度的升高,酶解初速率也依次增高,得到活化能为43.6483 kJ/mol,本实验结果与之接近。
平衡常数Ks与温度T的关系,服从范特柯夫方程

酶促反应K3>>K2,Ks≈Km,以不同温度梯度下测定的米氏常数Km回归求得焓度H∆=14.424 kJ/mol,频率因子 C=2.498×103。统计相关性 r=0.975。由此确立纤维素酶水解蒸汽预处理玉米秸秆的酶解动力学模型方程为:

3 结论
纤维素酶酶解蒸汽爆破预处理玉米秸秆的前3 h,反应遵循一级反应规律,可以用米氏方程进行模拟。用双倒数法和最小二乘法进行线性回归,得到米氏常数Km为11.71 g/L,最大反应速率Vm为1.5 g/(L·h)。
附录
[Et]:总的酶量
[ES]:酶与底物所形成的中间产物的浓度
[Et]−[ES]:游离状态的酶的浓度
[S]:底物浓度
B:积分常数
R:气体常数,J/(mol×K)
Ea:活化能,kJ/mol
A:指前因子,g/(L·h)
Ks:平衡常数
∆ H :焓度,kJ/mol
C:频率因子
REFERENCES
[1] Ni WD, Jin H, Li Z, et al. DME economy: the key to the problems of energy and environment of China. Coal Chem Ind, 2003, 31(4): 3−9.
倪维斗, 靳晖, 李政, 等. 二甲醚经济: 解决中国能源与环境问题的重大关键. 煤化工, 2003, 31(4): 3−9.
[2] Liu M. Chinese energy utilization and environmental protection on the current situation. Shanxi Energy Conservation, 2002(3): 17−18.
刘明. 关于我国能源利用与环境保护的现状分析. 山西能源与节能, 2002(3): 17−18.
[3] Liu ZX, Liu ZQ, Huang WH. The key countermeasures of controlling fossil fuel environment pollution in China.Resour Ind, 2005, 7(5): 49−52.
刘志逊, 刘珍奇, 黄文辉. 中国化石燃料环境污染治理重点及措施. 资源·产业, 2005, 7(5): 49−52.
[4] Zhang XY, Lei ZT. Overview of biomass energy in China.J Chem Ind Forest Products, 1997, 31(4): 20−22.张雪元, 雷振天. 中国生物质能源概况. 林产化工通讯,1997, 31(4): 20−22.
[5] Chen HZ, Li ZH. Ligncellulosical microorganisms and biomass total utilization. Biotechnology Bull, 2002, (2):25−29, 34.
陈洪章, 李佐虎. 纤维素原料微生物与生物量全利用.生物技术通报, 2002, (2): 25−29, 34.
[6] Kumar S, Gupta R, Lee YY, et al. Cellulose pretreatment in subcritical water: effect of temperature on molecular structure and enzymatic reactivity. Bioresour Technol,2010, 101(4): 1337−1347.
[7] Wang K, Jiang JX, Xu F, et al. Influence of steaming pressure on steam explosion pretreatment of Lespedeza stalks (Lespedeza crytobotrya): part 1. Characteristics of degraded cellulose. Polym Degrad Stab, 2009, 94(9):1379−1388.
[8] Kuo CH, Lee CK. Enhancement of enzymatic saccharification of cellulose by cellulose dissolution pretreatments. Carbohydr Polym, 2009, 77(1): 41−46.
[9] Gan Q, Allen SJ, Taylor G. Kinetic dynamics in heterogeneous enzymatic hydrolysis of cellulose: an overview, an experimental study and mathematical modelling. Process Biochem, 2003, 38(7): 1003−1018.
[10] Zhou XG, Qi FM, Wheeler MM, et al. Inhibition of termite cullulases by carbohydrate-based cellulase inhibitors:evidence from in vitro biochemistry and in vivo feeding studies. Pestic Biochem Physiol, 2008, 90(1): 31−41.
[11] Nidetzky B, Steiner W, Hayn M, et al. Cellulose hydrolysis by the cellulases from Trichoderma reesei: a new model for synergistic interaction. Biochem J, 1994,298(3): 705−710.
[12] Converse AO, Optekar JD. A synergistic kinetics model for enzymatic cellulose hydrolysis compared to degree-of-synergism experimental results. Biotechnol Bioeng, 1993, 42(1): 145−148.
[13] Andric P, Meyer AS, Jensen PA, et al. Effect and modeling of glucose inhibition and in situ glucose removal during enzymatic hydrolysis of pretreated wheat straw. Appl Biochem Biotechnol, 2010, 160(1): 280−297.
[14] Kadam KL, Rydholm EC, McMillan JD. Development and validation of a kinetic model for enzymatic saccharification of lignocellulosic biomass. Biotechnol Prog, 2004, 20(3): 698−705.
[15] Zheng Y, Pan ZL, Zhang RH, et al. Kinetic modeling for enzymatic hydrolysis of pretreated creeping wild ryegrass.Biotechnol Bioeng, 2009, 102(6): 1558−1569.
[16] Palmqvist E, Hahn-Hägerdal B, Galbe M, et al. The effect of water-soluble inhibitors from steam-pretreated willow on enzymatic hydrolysis and ethanol fermentation.Enzyme Microb Technol, 1996, 19(6): 470−476.
[17] Gao PJ, Qu YB, Wang ZN. Analysis and estimation of cellulose hydrolysis. Chin J Biotech, 1988, 4(4): 321−326.高培基, 曲音波, 王祖农. 纤维素酶解过程的分析和测定. 生物工程学报, 1988, 4(4): 321−326.
[18] Linda M, Jakobsson EL, Galbe M, et al. Steam pretreatment of dilute H2SO4-impregnated wheat straw and SSF with low yeast and enzyme loadings for bioethanol production. Biomass Bioenergy, 2008, 32(4):326−332.
[19] Yu HB, Zhang XY, Ke J, et al. Optimization of enzymatic hydrolysis of corn straw after biological-alkaline/oxidative pretreatment. Transact Chin Soc Agri Eng, 2009, 25(4):201−205.
余洪波, 张晓昱, 柯静, 等. 生物-碱氧化预处理玉米秸秆酶解条件的优化. 农业工程学报, 2009, 25(4):201−205.
[20] Oh KK, Kim TY, Jeong YS, et al. Bioconversion of cellulose to ethanol by the temperature optimized simultaneous saccharification and fermentation.Renewable Energy, 1996, 9(1/4): 962−965.
Kinetics of enzymatic hydrolysis of steam-explosion pretreated corn straw
Shengtao Ren1,2, Keke Cheng2, Andong Song1, and Jian’an Zhang2
1 College of Life Science, Henan Agricultural University, Zhengzhou 450002, China
2 Institute of Nuclear and New Energy Technology, Tsinghua University, Beijing 100084, China
Received: June 28, 2010; Accepted: October 20, 2010
Supported by: National High Technology Research and Development Program of China (863 Program) (No. 2007AA100702-3), National Basic Research Program of China (973 Program) (No. 2011CB707406).
Corresponding author: Jian’an Zhang. Tel/Fax: +86-10-89796086; E-mail: zhangja@tsinghua.edu.cn
国家高技术研究发展计划 (863计划) (No. 2007AA100702),国家重点基础研究发展计划 (973计划) (No. 2011CB707406) 资助。
