一种六核笼状锂配合物的制备、结构及合成机理研究
2011-09-29畅功民薛小燕黄淑萍
王 莉 畅功民 薛小燕 黄淑萍 陈 霞*,,2
(1山西大学化学化工学院与应用化学研究所,太原 030006)(2南开大学元素有机化学国家重点实验室,天津 300071)(3山西省农业科学院农产品综合利用研究所,太原 030037)
一种六核笼状锂配合物的制备、结构及合成机理研究
王 莉1畅功民3薛小燕1黄淑萍1陈 霞*,1,2
(1山西大学化学化工学院与应用化学研究所,太原 030006)(2南开大学元素有机化学国家重点实验室,天津 300071)(3山西省农业科学院农产品综合利用研究所,太原 030037)
由[PhN(SiMe2(OMe))Li]2与哌啶腈通过加成反应合成了1种新型六核笼状锂配合物3,该配合物晶体结构已经确定,并用1H NMR和X-单晶衍射对配合物3进行结构表征,其晶体呈笼状结构且属于单斜晶系:P21/n,a=1.24883(19)nm,b=1.4027(2)nm,c=1.8534(3)nm;β=95.894(2)°;V=3229.5(8)nm3,Z=2,R1=0.0477,GOF=0.946。
合成;晶体结构;锂配合物;机理
0 引 言
自20世纪80年代以来,由于胍基和脒基化合物的立体结构和电子密度的可变性,已经引起人们广泛的兴趣。特别是胍基化合物,胍是多功能配体,具有多种配位方式及其与金属中心的键合模式。胍作为配体可以是分子,单负离子[(RN)2CNR2]-或双负离子[(RN)3C]2-,这些特点使胍基配体在配位化学和金属有机化学中将发展成为非常有价值的配体[1]。贝利等已经报道了N,N′,N″-三苯胍单负离子钌配合物[2]。然而胍双负离子或取代胍双负离子配体形成的过渡金属配合物比较少见。据我们所知,双核铁羰基化合物作为第一个胍双负离子配体形成的过渡金属配合物被报道[3]。 也有报道 N,N′,N″-三苯胍双锂盐和二杂金属钙-锂 N,N′,N″-三苯胍配合物,它们的合成表明了胍双负离子配体与金属配位的多样性[4]。脒基配体多种多样的结构类型,以及在键型、键长、键角、空间相对位置及排列对化学活性与反应选择性的影响等方面规律性的结果,为结构化学提供了丰富的信息,已成为金属有机化学的重要组成部分。本课题组已经合成了不同结构的脒基和胍基配体[5-12],由于脒基和胍基的优良配位能力,本文设计合成了一种新型的胍基锂化合物3,其合成路线如下(Scheme 1):
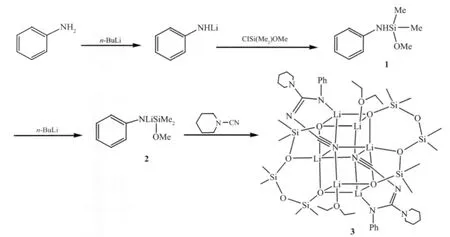
Scheme 1 Preparation of cage compound 3
1 实验部分
1.1 试剂与仪器
实验采用标准Schlenk技术,在氮气保护下进行。乙醚、四氢呋喃、正己烷等溶剂先经钠丝干燥处理,再回流后使用。 苯胺(A.R.级),哌啶腈(A.R.级,购于百灵威试剂公司),正丁基锂(购于百灵威试剂公司)。Bruker DKX300 核磁共振仪,Smart CCD X-射线衍射仪,VarioⅢ-元素分析仪。
1.2 合 成
1.2.1 化合物 ClSi(OMe)Me2的制备
0℃下,在含10.40 g MeONa的甲醇和乙醚的混合溶液中加入 22.00 mL Me2SiCl2,搅拌 5 h,产生白色沉淀,静置,过滤,常压蒸馏滤液,收集70℃左右的馏分,得 14.40 g 化合物 1,产率 64.0%。1H NMR(C6D6,298 K,300 MHz),δ(ppm):0.109~0.445(3s,6H,SiMe2),3.433(s,3H,OMe),3.708(s,1H,NH),6.753~7.247(q,5H,Ph)。
1.2.2 化合物1和化合物2的制备
-78 ℃下,在含 1.00 mL(10.97 mmol)苯胺的正己烷溶液中加入浓度为1.795 mol·L-1的丁基锂溶液 6.01 mL, 反应 4 h 后,-78 ℃下再加入 1.43 mL(10.97 mmol)ClSi(OMe)Me2,反应 4 h 后,过滤,得化合物1的正己烷溶液。 在-78℃下,继续向化合物1的溶液中加入浓度为1.795 mol·L-1的丁基锂溶液6.01 mL,反应 4 h,恢复至室温,产生白色沉淀,过滤,弃去滤液,抽干沉淀,称重 1.82 g,产率 87.8%,该沉淀为化合物 2。1H NMR(C6D6,298 K,300 MHz),δ(ppm):0.18(s,6H,SiMe2),3.15(s,3H,OMe),3.708(s,1H,NH),6.75(t,1H,Ph),6.87(d,2H,Ph),7.25(m,2H,Ph)。13C NMR(C6D6,298 K,75 MHz),δ(ppm):2.75(2C,SiMe2),51.73(1C,OMe),116.93(1C,Ph),120.38(1C,Ph),125.19(1C,Ph),131.89(2C,Ph),160,69(1C,Ph)。
1.2.3 化合物 3 的制备
0 ℃下,在含 0.606 g(3.21 mmol)化合物 2 的乙醚溶液中加入 0.37 g(3.21 mmol)哌啶腈,反应 5 h,溶液颜色变为暗红色,有少许棕色沉淀,过滤,浓缩滤液至大约10 mL,在-30℃下放置,过夜,出现无色块状晶体化合物3,适于X-单晶衍射测定结构。抽干晶体称重 2.71 g, 产率:48.0%。1H NMR(C6D6,298 K,300 MHz),δ(ppm):0.186~0.201(m,18H,SiMe2),1.226(t,6H,CH3),1.412(m,4H,CH2),1.587(m,2H,CH2),3.119(m,4H,CH2),3.517(m,4H,CH2),6.751(m,2H,Ph),7.162(m,3H,Ph)。 Anal.Calcd.for C46H86Li6N8O10Si6(%):C,49.89;H,7.765;N,11.12。 Found(%):C,49.84;H,7.757;N,11.20。
1.3 晶体结构测定
选取大小为 0.4 mm×0.4 mm×0.3 mm 的单晶,在Smart CCD-X射线衍射仪,使用经过石墨单色器单色化的 Mo Kα 射线(λ=0.071013 nm)作为入射辐射, 在 178 K 下,1.82°<θ<25.00°范围内 (-13≤h≤14;-15≤k≤16;-20≤l≤22),以 ω/2θ的扫描方式,共收集到5672个独立衍射点,其中3935个为独立反射,化合物3的结构采用直接法解出,全部非氢原子坐标及各向异向性热参数经最小二乘法修正。所有计算用SHELXS-97程序进行。最终偏离因子R1=0.0477。
2 结果与讨论
2.1 化合物3的晶体结构
X-射线衍射实验结果表明,化合物3的晶体结构晶体的组成为C46H86Li6N8O10Si6,属于单斜晶系,P21/n空间群, 晶胞参数 a=1.24883(19)nm,b=1.4027(2)nm,c=1.8534(3)nm;β=95.894(2)°;Dc=1.153 g·cm-3,Z=2,F(000)=1200。晶体数据列于表1,部分键长、键角列于表2。

表1 化合物3的晶体学数据Table 1 Crystal data of compound 3

表2 化合物3主要的键长和键角Table 2 Selected bond lengths(nm)and angles(°)for the compound 3
CCDC:816546。

图1 化合物3的分子结构图Fig.1 Molecular structure of compound 3
由X-RAY晶体结构图中可以得出,该化合物存在中心对称,化合物中有6个锂原子形成了笼状配位结构。中心12个原子形成了3个平面和2个变形的立方体。 Li1 分别和 4 个原子 (O1i,O5,O4,N4)配位,形成了四面体结构。Li3分别和4个原子(O1i,N4i,O4,N4)配位,也形成了四面体结构。 Li2 采取五配位的配位方式,分别和 O1,O3,O4,N4,N4i原子配位。分子内的Li2-N4键长为0.2223(4)nm,分子间Li2-N4i键长为0.2171(5)nm,略长于分子内的键长。分子内的Li1-O4键长为0.1875(4)nm,分子间Li1-O1′键长为0.1908(4)nm,略长于分子内的键长。

图2 化合物3的六核笼状结构图Fig.2 Hexanuclear cage structure of compound 3
N1-C12、C12-N3和 N3-C13的键长分别为0.1309(3)、0.1386(3)和 0.1290(3)nm,介于普通的 CN单键(0.147 nm)C=N双键(0.128 nm)的键长之间,C13-N4的键长为0.1165(3)nm与碳氮三键的键长0.116 nm接近,因此,N1-C12-N3-C13-N4形成共轭体系,N1、N4 与 Li3 配位。N1-C12-N2、N1-C12-N3 和N2-C12-N3 的键角分别为 127.1(2)°、119.0(2)°和113.9(2)°,由于价键之间的范德华斥力所致,C12并不是标准的sp2杂化。
2.2 化合物3的形成机理
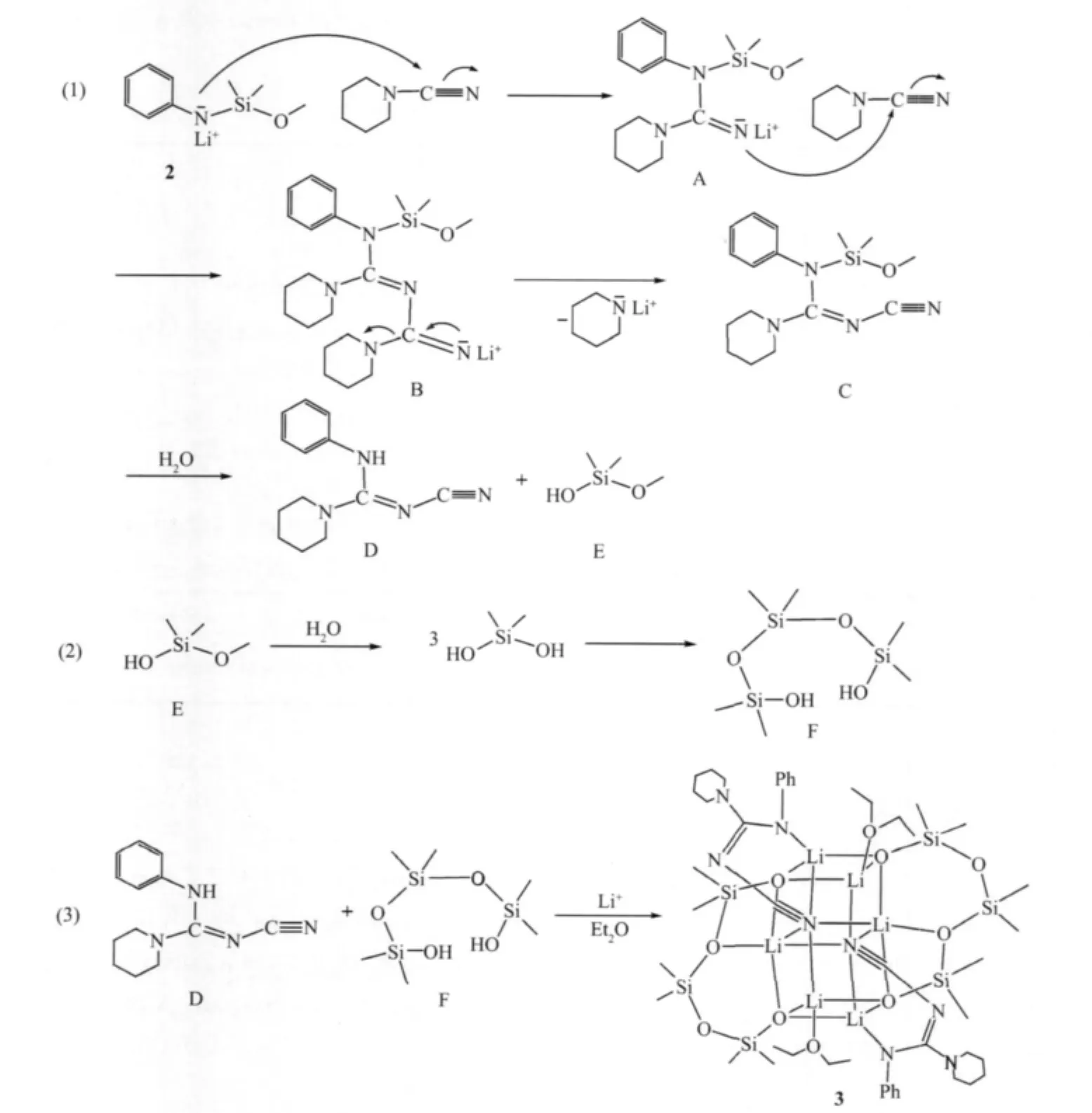
Scheme 2 Plausible routes for the compound 3
通过研究,我们推断该反应经历了以下历程得到化合物3(Scheme 2)。(1)锂盐2氮负离子进攻哌啶腈的氰基碳,发生亲核加成反应,形成离子A;离子A的氮负离子进攻哌啶腈的氰基碳,发生二次亲核加成反应,形成离子B;离子B发生1,3-非键电子对置换,其实质是亲核取代,形成分子C和哌啶氮负离子,哌啶氮负离子再水解为哌啶;分子C中Si-N键易水解,形成分子D和分子E;(2)分子E是烷氧基硅醇,其烷氧基易水解,得到硅二醇;硅二醇不稳定,易发生分子间脱水,形成三聚的相对较稳定硅氧烷二醇分子F;(3)分子D和分子F在乙醚中和锂离子配位形成二聚的六核笼状结构化合物3。
[1](a)Bailey P J,Pace S.Coord.Chem.Rev.,2001,214:91-141(b)Edelmann F T.Coord.Chem.Rev.,1994,137:403-481
[2]Bailey P J,Mitchell L A,Parsons S.J.Chem.Soc.Dalton Trans.,1996:2839-2841
[3]Bremer N J,Cutcliffe A B,Farona M F,et al.J.Chem.Soc.A,1971:3264-3266
[4]Bailey P J,Mitchell L A,Raithby P R,et al.Chem.Commun.,1996:1351-1352
[5]Zhou M S,Wei X H,Liu D S,et al.J.Organomet.Chem.,2007,692:5195-5202
[6]Bai S D,Guo J P,Liu D S.Dalton Trans.,2006:2244-2250
[7]Chen X,Wang L,Liu D S,et al.Acta Cryst.,2005,E61:m574-m576
[8]Chen X,Guo J P,Liu D S,et al.J.Organomet.Chem.,2002,655:89-95
[9]Chen X,Wang L,Guo J P,et al.Mendeleev Commun.,2005,15:160-161
[10]Chen X,Guan L L,Eisen M S,et al.Eur.J.Inorg.Chem.,2009:3488-3495
[11]CHEN Xia(陈霞),WEI Xue-Hong(魏学红),LIU Dian-Sheng(刘滇生),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2005,21(4):519-522
[12]CHENXia(陈霞).ThesisfortheDoctorateofShanxiUniversity(山西大学博士论文).2006.
Synthesis,Structure and Mechanism of a Lithium Complex with Hexanuclear Cage Structure
WANG Li1CHANG Gong-Min3XUE Xiao-Yan1HUANG Shu-Ping1CHEN Xia*,1,2
(1School of Chemistry and Chemical Engineering,Shanxi University,Taiyuan 030006,China)(2State Key Laboratory of Elemento-organic Chemistry,Nankai University,Tianjin 300071,China)(3Agricultural Utilization Research Institute of Shanxi Academy of Agricultural Sciences,Taiyuan 030037,China)
A novel hexanuclear cage lithium complex 3 was synthesized by addition reaction of[PhN(SiMe2(OMe))Li]2with piperidyl nitrile and its crystal structure was determined.Compound 3 was characterized by1H NMR spectra and X-ray diffraction patterns.The crystal of compound 3 shows a cage structure and belongs to monoclinic space group:P21/n,with a=1.24883(19)nm,b=1.4027(2)nm,c=1.8534(3)nm;β=95.894(2)°;V=3229.5(8)nm3,Z=2,R1=0.0477,GOF=0.946.CCDC:816546.
synthesis;structure;lithium complex;mechanism
O614.111
:A
:1001-4861(2011)05-0835-05
2010-07-05。收修改稿日期:2011-01-20。
国家自然科学基金(No.20942009,21072120),山西省留学回国人员基金(No.2009010),山西省科技活动择优(2009)资助项目。
*通讯联系人。 E-mail:chenxia@sxu.edu.cn
