利用同步辐射X射线衍射研究家蚕的纺丝过程
2011-09-18张耀鹏邵惠丽胡学超
黄 燕,张耀鹏,罗 杰,邵惠丽,胡学超
(东华大学 纤维材料改性国家重点实验室,材料科学与工程学院,化学纤维研究所,上海 201620)
蚕丝具有质轻细长、光泽独特、手感优良、穿着舒适等优良特性,素有“纤维皇后”之美称。一直以来,蚕的纺丝机理都是生物学家、化学家及材料学家们的研究热点。迄今为止,大多科学家都认为蚕的纺丝是液晶纺丝,但对于丝素蛋白的液晶形成机理,则存在多种不同说法,如Viney等[1-2]的盐桥球状棒理论、Magoshi等[3]的丝素液晶成纤理论、Kaplan等[4]的胶束理论及于同隐等[5-6]的折叠链理论等。对于丝素蛋白成纤过程中聚集态结构的形成,现有研究尚未得出一致的理论。而从蚕本身出发,研究其腺体中纺丝液的流动状态及聚集态结构的变化,无疑对丝素蛋白的纤维化机理研究具有较重要的借鉴作用。
同步辐射作为X射线源,具有通量高、准直性高以及波长连续可调等优点[7]。同步辐射X射线衍射技术是研究生物大分子晶体的主要手段,已证实蚕丝具有半晶型形态结构[8];生物丝具有高度可延伸性主要受其微观结构的无序相(disordered phase)的影响,而其晶体结构也可发生弹性形变。另外,Martel等[9-10]利用同步辐射X射线衍射技术研究了pH、剪切速率[11]对微流体管道中再生丝素蛋白水溶液构象转变的影响。本文利用同步辐射广角X射线衍射(SR-WAXD)对五龄家蚕、解剖后的蚕腺体,以及脱胶丝进行测试,研究干燥过程及拉伸过程中腺体内丝素蛋白有序态结构的演变,并探索丝素蛋白在纤维化过程中其聚集态结构的变化过程和主要影响因素。
1 实验
1.1 活蚕测试
将五龄家蚕经丙酮麻醉后固定于金属实验台,通过改变固定蚕体的方式使其背面或侧面分别置于同步辐射X射线光路中,并依次对蚕体的头部、胸部、腹部、尾角处进行同步辐射X射线衍射测试(图1),采用 Mar 345成像板探测器记录二维X射线衍射结果。因蚕腺体(图2)以Z字型折叠在蚕体内,蚕体尾角处主要有后部腺体(P),腹部中有部分后部腺体(P)、中部腺体后区(MP)和中区(MM),胸部中有中部腺体前区(MA)和前部腺体(A),头部中只有部分前部腺体(A)、吐丝管和喷丝口。

图1 同步辐射广角X射线衍射测试家蚕示意图(侧面入光方式)Fig.1 Schematic setup of SR-WAXD experiment on silkworm (incident beam from lateral silkworm)
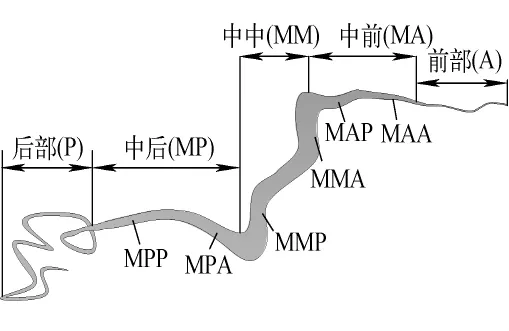
图2 蚕腺体各区段示意图Fig.2 Scheme of different divisions of silk gland
1.2 腺体及脱胶丝测试
1.2.1 有表皮湿态腺体 将五龄家蚕麻醉后置于培养皿中解剖,用去离子水清洗腹内,取出两条完整的腺体备用。腺体按其P、MP、MM、MA、A进行切断(图2),将各样品贴附于聚酰亚胺膜(商品名Kapton)上,对其进行同步辐射X射线衍射测试。其中,后部腺体、前部腺体各测试1点,中部腺体各区分别测试不同两点(即MPP、MPA;MMP、MMA;MAP、MAA)。另外,由于同步辐射X射线光斑较前部腺体大,因此,前部腺体测试时需将同等长度的5根前部腺体并排进行测试。
1.2.2 去表皮湿态腺体 将蚕内腺体取出后,用去离子水浸泡约30s,再用尖嘴镊子将其白色表皮剥除,由于前部及后部腺体的表皮不易去除,本实验仅将中部腺体切为MP、MM、MA 3段进行测试,方法同上。
1.2.3 腺体的干燥 取去表皮湿态腺体MM、MA两段分别进行干燥,每隔5min左右测试1次,且用称重法对其称量,若5min内其质量波动范围在0.1%之内,即认为腺体已完全干燥。总测试时间约为1~2h,测试方法同上。
1.2.4 腺体及脱胶丝的拉伸 将去表皮湿态腺体MM固定于自制拉伸仪,分别以拉伸速度17.4及29.0μm/s进行拉伸,并对其进行同步辐射X射线衍射原位测试。为了对比结果,将成束脱胶丝[12]固定于相同光路进行X射线衍射测试。
1.3 同步辐射光束线参数
储存环能量,800MeV;流强,200mA;光斑尺寸,2mm×1mm;X射线波长,0.154nm;束线阻拦器尺寸,1cm×1cm;探测器直径,345mm;成像板像素,150μm。样品到探测器距离与放样方式有关,介于155~176mm。实验过程中,光源光斑位置未随时间变动。本实验在国家同步辐射实验室(合肥)X射线衍射和散射试验站完成。
1.4 数据处理
本实验采用聚丙烯薄片为标样,利用软件FIT2D对其衍射环进行圆心定位,并校准样品到探测器距离。为避免成像板原有图样的影响,对样品二维衍射图谱的左下角部分做相同角度区域的90°扇形积分,得到其一维衍射图谱。利用Origin 8扣除对应背景的衍射数据,得到实际样品的一维衍射图谱。上述标定的圆心和样品到探测器的距离可用于相同放样方式下的所有测试样品。由于放样方式不同,各样品所扣除的背景衍射数据以及样品到探测器距离有所不同。对于活蚕、拉伸的腺体和脱胶丝,扣除的背景是空气的衍射数据;对于未拉伸的腺体,所扣除的背景是Kapton膜和空气的衍射数据。对于活蚕和未拉伸的腺体(固定于出光口),校正后的样品到探测器距离为155mm;对于拉伸的腺体和脱胶丝(固定于拉伸仪),校正后的样品到探测器距离为176mm。当样品固定于拉伸仪时,需移动探测器,使拉伸仪置于出光口和探测器之间。
2 结果与讨论
2.1 活蚕蚕体不同部位及测试方式对其WAXD结果的影响
家蚕丝素蛋白的结晶结构通常分为丝素Ⅰ(silkⅠ)和丝素Ⅱ(silkⅡ)两种结构[13]。silkⅡ是以氢键连接的反平行β-片层(β-sheet)结构,而silkⅠ由于其结构不稳定,易转变成为结构更稳定的silkⅡ结构,使得对它的结构研究较困难,并存在一些争议。例如:在Lotz等[14]提出的曲轴模型中,丙氨酸残基和谷氨酸残基分别以 β-片层和 α-螺旋构象存在;在 Fossey等[15]提出的模型中,左旋的片层结构 (lefthanded sheet-like conformation)和右旋的片层结构(right-handed sheet-like conformation)共存,且左右扭曲程度相同;Asakura等[16-17]认为silkⅠ是一种重复的Ⅱ类β-转角结构。
使用0.154nm的X射线光束,文献[18-19]中silkⅡ(β-片层)结构的主要结晶衍射峰在2θ=20°左右。其中,2θ=19.7°的衍射峰([200]晶面,晶面间距为0.45nm)与分子链间的排列相关(图3中方向a),而2θ=20.6°的衍射峰([020]晶面,晶面间距为0.43nm)与β-片层之间的排列相关(图3中方向b)。由于这两个衍射峰很接近,常重叠为1个衍射峰。另外,silkⅡ还在2θ=8.7°、9.9°([010]晶面)、23.3°([002]晶面)、24.5°([201]晶面)、27.3°([012]或[220]晶面)、29.7°([030]晶面)、31.8°([022]或[130]晶面)、39.0°([003]晶面)和39.9°([040]晶面)处有结晶衍射峰,对应的晶面间距分别为1.01、0.895、0.38、0.36、0.326、0.301、0.281、0.231 和0.226nm。silkⅠ 的 主 要 结 晶 衍 射 峰 在2θ=12.3°左右(晶面间距为0.72nm),2θ=15.8°、18.9°为α-螺旋的衍射峰(晶面间距分别为 0.47nm 和 0.56nm)[13]。 另 外,2θ=11.5°~12.5°范围内的平缓衍射峰通常被认为与丝素蛋白无定型结构相关[18]。

图3 silkⅡ(β-片层)结晶结构示意图Fig.3 Scheme of silkⅡ (β-sheet)crystal structure
图4和5分别为蚕体各部位的二维和一维X射线衍射图谱。从图4可看出,与蚕体胸部、腹部及尾角处相比,蚕头部的X射线衍射图谱明显不同。从图5可进一步看出,无论采用侧面入光还是背面入光的方式测试,蚕体胸部、腹部和尾角处的X射线衍射曲线均较平滑,而其头部的衍射曲线的衍射峰较明显,强度也高于其他部位的曲线。这可能是由于X射线穿透蚕体胸部、腹部及尾角处时,被其表皮或体内器官部分吸收,因此无法得到明显的衍射信息。蚕头部的衍射图谱中均有明显衍射峰,但不同测试方式所得到的峰位和强度有所不同。当采用侧面入光方式测试时,图5a中在8.8°、19.8°及27.1°处出现了衍射峰,结合文献[18-19]可知,这些峰分别与silkⅡ结晶结构中晶面间距为1.01、0.895及0.326nm的晶面的衍射有关。当采用背面入光方式测试时,图5b中分别在12.3°、18.9°及27.3°附近有3个明显的衍射峰。其中,12.3°的衍射峰是silkⅠ的衍射峰(晶面间距为0.72nm);27.3°的 衍 射 峰 是silkⅡ 的[012]或[220]晶面的衍射峰;18.9°处的衍射峰是晶面间距为0.56nm的α-螺旋结构的衍射峰。对其的解释可能为丝素蛋白在蚕头部吐丝口处形成纤维的过程中,丝素蛋白大部分已转变为silkⅡ晶体结构,但仍存在部分未转变完成的α-螺旋结构。比较图5a及b可发现,同样是蚕的头部,入光方式的不同造成衍射峰的形状区别很大。该现象可能是由蚕头部躯壳的衍射或对X射线的吸收所引起的。由于无法对蚕头部躯壳单独制样实验,尚不能确定具体影响大小。由上述分析可知,衍射曲线上标示的具体峰位与silkⅡ或silkⅠ结构的衍射峰位十分接近,因此可认为这些衍射峰与丝素蛋白晶体结构相关的可能性更大。另外,图4中蚕头部的二维衍射图均为同心圆环状,说明此时在吐丝口中的初生纤维中,结晶区没有明显取向,这是由于纤维尚未经过蚕头部的扭动拉伸。

图4 活蚕的WAXD二维图谱Fig.4 2-D WAXD patterns of silkworm
2.2 丝素蛋白在湿态腺体不同部位中的有序态结构
图6为湿态腺体各区段的WAXD一维图谱,其中,图6a中的腺体有表皮,图6b中的腺体被剥除表皮。对于有表皮的湿态腺体,P、MPP只在11.5°处出现1组平缓的衍射峰,通常被认为此与丝素蛋白无定型结构相关;MPA、MMP、MMA、MAP出现两组衍射峰,除在11.5°处出现与之前类似的衍射峰外,还分别在27.0°、27.3°及26.9°处出现1组衍射峰。这组衍射峰的峰位接近或等于27.3°,可能与silkⅡ结晶结构中晶面间距为0.326nm的[012]或[220]晶面的衍射有关。而且,腺体在接近中部腺体前区的MAP的过程中,该峰位有逐渐接近27.3°的趋势。这说明腺体中的silkⅡ结构有可能在向前部丝腺流动的过程中逐渐形成。另外,如图7所示,水的衍射峰的峰位大约在28.0°附近,因此该组衍射峰还可能与腺体中水的含量有关。腺体中较高的水含量,可能导致27°附近衍射峰的峰强变大。对于去表皮的湿态腺体(图6b),结果与有表皮的湿态腺体基本相似。从图6a中还可看出,与带皮腺体的其他区段相比,P、MPP、MAA、A区段在11.5°附近的无定形结构的衍射峰较明显,而在27.3°附近出现的衍射峰强度较弱或不存在,这可能与该部分腺体的直径较小、表皮所占比例较大、丝素水溶液所占比例较少有关。其中,A区段中丝素溶液的浓度最高,腺体直径最小,却在27.3°附近出现的衍射峰强度较P、MPP、MAA稍强,因此可能与P、MPP、MAA中silkⅡ结构尚未明显形成有关。

图5 活蚕不同部位的WAXD一维图谱Fig.5 1-D WAXD patterns of different parts of silkworm

图6 湿态腺体各区段的WAXD一维图谱Fig.6 1-D WAXD of different divisions of wet silk gland
2.3 干燥过程对腺体中丝素蛋白有序态结构的影响
为了研究水分流失对丝素蛋白晶体结构转变的影响,对不同干燥时间的去表皮湿态腺体进行了同步辐射WAXD测试。图7为MA、MM干燥过程的测试结果,图中可明显观察到干燥过程中衍射峰位置发生了明显变化。对于MA(图7a),从初始干燥阶段的衍射峰可看出其含有无定形结构,与前述湿态腺体的测试结果相符。随着水分减少,位于28.0°处的水的衍射峰强度逐渐减弱直至消失,其2θ值也随之减小。干燥完成后,位于11.5°处的平缓衍射峰消失,而在11.9°处出现尖峰,其数值与晶面间距为0.72nm的silkⅠ的衍射峰相近(12.3°)。另外,在19.7°处出现了1组与silkⅡ结构相关的晶面间距为0.45nm的[200]晶面的衍射峰,同时在27.8°处出现1组肩峰,接近于晶面间距为0.326nm 的[012]或[220]晶面的衍射峰(27.3°)。而 MM(图7b)与 MA干燥过程的变化基本相似,但干燥完成时间远长于MA。由于MA比MM更接近于吐丝口,因此MA处纺丝液的组成也更接近于吐丝口处纺丝液的组成(如pH降低且更接近丝素蛋白的等电点)。而纺丝液从吐丝口处喷出时可迅速固化,因此MA处纺丝液的固化速度也较快。
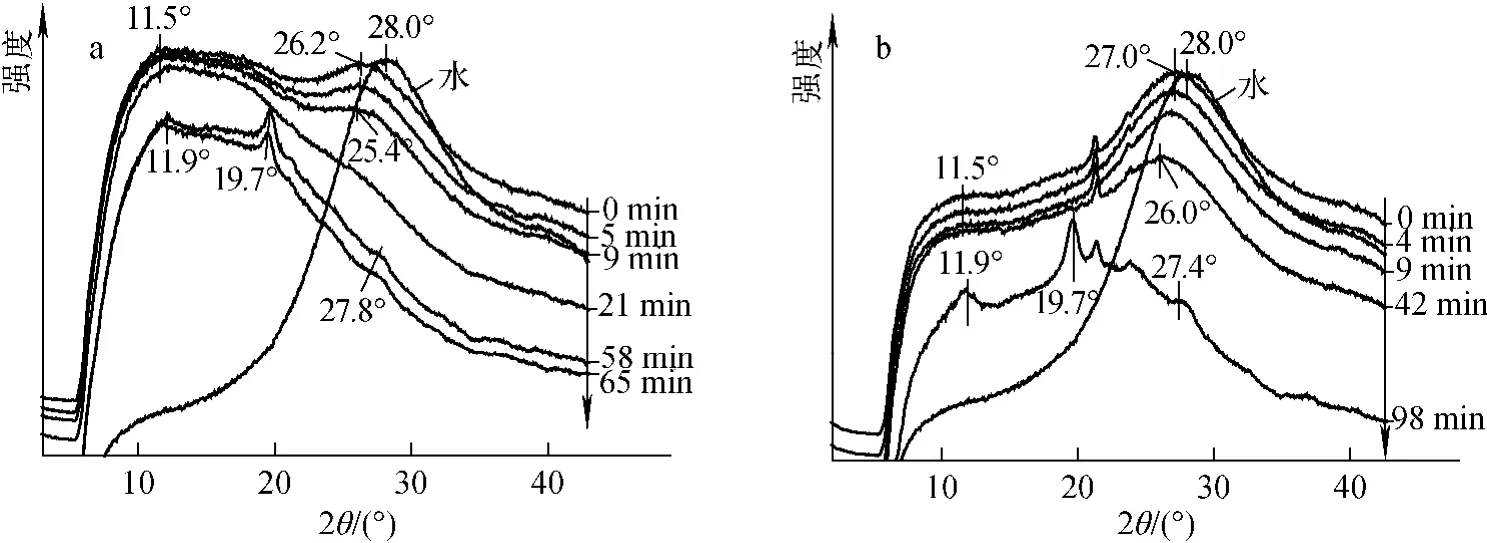
图7 水及中部腺体在不同干燥时间的WAXD一维图谱Fig.7 1-D WAXD of water and the middle division of silk gland at different drying time
从上述结果可看出,湿态腺体在干燥过程中,丝素蛋白中水分流失而固化,同时丝蛋白构象发生变化。水的衍射峰逐渐减弱乃至消失,而与silkⅠ、silkⅡ晶体结构有关的衍射峰逐渐增多。丝素蛋白构象从无定形结构逐渐失水转变成交替堆积的α-螺旋和/或β-平行折叠构象趋于由β-反平行折叠形成完整的silkⅡ层状晶体结构。另外,对中部腺体干燥前后的二维衍射图谱(图8)进行对比发现,干燥后的图谱为同心圆环,这说明水分的流失可诱导丝素蛋白结晶,但结晶区并未发生明显取向,蚕丝中的晶区取向可能是在蚕吐丝后经过头部的扭动拉伸而诱导形成的。

图8 中部腺体在不同干燥时间的WAXD二维图谱Fig.8 2-D WAXD of the middle division of silk gland at different drying time
2.4 中部丝腺在拉伸过程中有序态结构的演化
为了研究拉伸对腺体有序态结构的影响,对腺体进行匀速拉伸并结合SR-WAXD进行测试(图9)。从图9a中可发现,拉伸速度为17.4μm/s时,随着拉伸倍率(拉伸位移与腺体原长的比值)的增加,水的衍射峰(28.1°)强度逐渐减少,乃至消失;在38.6°处出现的弱峰,其数值与晶面间距为0.231nm的[003]晶面的衍射峰相近(39.0°),衍射强度发生小幅增强。当拉伸倍率达0.7时,在22.6°附近出现1组与silkⅡ结构相关的[002]晶面的肩峰,其强度也逐渐增强。拉伸倍率达1.0时,在9.2°、24.9°处附近出现两组衍射峰,其中2θ=9.2°的衍射峰有可能与silkⅡ结晶结构的[010]晶面相 关,2 4.9°处较尖的衍射峰与晶面间距为0.36nm 的[201]晶面的衍射峰相近(24.5°)。而拉伸倍率达1.8时,出现在20.6°处的衍射峰是silkⅡ的[020]晶面的衍射峰。从图9b可发现,拉伸速度为29.0μm/s时,各衍射曲线与图9a有相似的变化趋势。不同之处在于:当拉伸倍率达1.5时,在21.5°、23.8°及41.9°处出现的峰位均接近脱胶丝的衍射峰;出现在27.2°处的衍射峰,与silkⅡ晶体结构的[012]或[220]晶面的衍射峰有关(27.3°)。对于37°左右的尖峰,与文献中silkⅠ和silkⅡ结构的衍射峰不同,尚有待进一步研究。从上述结果可看出,以较慢速度拉伸腺体的过程中,腺体逐渐脱水,与silkⅡ结构相关的晶面衍射峰逐渐增多,且强度逐渐增强;当拉伸速度增大时,这种趋势更加明显,且衍射峰的峰位愈接近于脱胶丝的峰位。这说明拉伸是丝素蛋白成纤的主要诱导因素,并使丝素蛋白向silkⅡ结构转变。另外,将中部腺体不同拉伸倍率下的二维衍射图谱与脱胶丝(图10)进行对比发现,脱胶丝的衍射图谱中可观察到明显的衍射光斑,而1.8倍拉伸后的中部腺体并未发现明显的光斑,说明中部腺体被拉伸1.8倍时,结晶区并不会因拉伸而有明显取向。而蚕在纺丝过程中,远大于1.8的拉伸倍率导致脱胶丝有明显的取向结构。

图9 脱胶丝(DS)及中部腺体中区(MM)在不同拉伸速度及拉伸倍率下的WAXD一维图谱Fig.9 1-D WAXD of degummed silk and the middle division of silk gland at different drawing rates and drawing ratios

图10 脱胶丝及中部腺体中区(MM)在不同拉伸倍率下的WAXD二维图谱Fig.10 2-D WAXD of degummed silk and the middle division of silk gland at different drawing ratios
3 结论
丝素蛋白在五龄熟蚕头部吐丝口处形成与silkⅠ、silkⅡ晶体相关的结构;丝腺内水分流失诱导丝素蛋白形成有序态结构,湿态腺体在干燥过程中,其构象转变成β-反平行折叠并趋于形成完整的silkⅡ层状晶体结构;拉伸作用为丝素蛋白成纤化的主要影响因素,可诱导丝素蛋白形成silkⅡ晶体结构。
[1]KERKAM K,VINEY C,KAPLAN D,et al.Liquid crystallininity of natural silk secretions[J].Nature,1991,349:596-598.
[2]VINEY C.Light-microscopy of self-assembling biological macromolecules[J].Am Chem Soc,Div Polym Chem,1992,33(1):757.
[3]MAGOSHI J,MAGOSHI Y,NAKAMURA S.Crystallization,liquid crystal,and fiber formation of silk fibroin[J].J Appl Polym Sci:Appl Polym Symp,1985,41:187-204.
[4]JIN H J,KAPLAN D L.Mechanism of silk processing in insects and spiders[J].Nature,2003,424(6952):1 057-1 061.
[5]李光宪,于同隐.丝蛋白纤维化机理(Ⅰ)[J].科学通报,1989,21:1 656-1 659.LI Guangxian,YU Tongyin.The fibrillization mechanism of silk fibroin(Ⅰ)[J].Chinese Science Bulletin,1989,21:1 656-1 659 (in Chinese).
[6]于同隐,李光宪.丝蛋白纤维机理的模型——应力作用下丝蛋白构象的转变[J].高分子学报,1993,4:415-422.YU Tongyin,LI Guangxian.A model of the fibrillization mechanism of silk fibroin the conformational transition of fibroin by stretching [J].Acta Polymerica Sinica,1993,4:415-422 (in Chinese).
[7]徐彭寿,潘国强.同步辐射应用基础[M].合肥:中国科学技术大学出版社,2009:215-216.
[8]KRASNOV I,DIDDENS I,HAUPTMANN N,et al.Mechanical properties of silk:Interplay of deformation on macroscopic and molecular length scales[J].Phys Rev Lett,2008,100(4):048104.
[9]MARTEL A,BURGHAMMER M,DAVIES R,et al.A microfluidic cell for studying the formation of regenerated silk by synchrotron radiation small-and wide-angle X-ray scattering[J].Biomicrofluidics,2008,2(2):24 104.
[10]MARTEL A,BURGHAMMER M,DAVIES R J,et al.Silk fiber assembly studied by synchrotron radiation SAXS/WAXS and raman spectroscopy[J].J Am Chem Soc,2008,130(50):17 070-17 074.
[11]ROSSLE M,PANINE P,URBAN V S,et al.Structural evolution of regenerated silk fibroinunder shear: Combined wide-and small-angle X-ray scattering experiments using synchrotron radiation[J].Biopolymers,2004,74(4):316-327.
[12]王洪,张耀鹏,邵惠丽,等.再生丝素蛋白水溶液稳定性的研究[J].合成纤维,2004(S1):12-14.WANG Hong,ZHANG Yaopeng,SHAO Huili,et al.The stability of regenerated silk fibroin solution[J].Synthetic Fiber in China,2004(S1):12-14(in Chinese).
[13]DRUMMY L F,PHILLIPS D M,STONE M O,et al.Thermally induced alpha-helix to beta-sheet transition in regenerated silk fibers and films[J].Biomacromolecules,2005,6(6):3 328-3 333.
[14]LOTZ B,COLONNA C F.The chemical structure and the crystalline structures ofBombyx morisilk fibroin[J].Biochimie,1979,61(2):205-14.
[15]FOSSEY S A,NEMETHY G,GIBSON K D,et al.Conformational energy studies of beta-sheets of model silk fibroin peptides:Ⅰ.Sheets of poly(Ala-Gly)chains[J].Biopolymers,1991,31(13):1 529-1 541.
[16]ASAKURA T,ASHIDA J,YAMANE T,et al.A repeated beta-turn structure in poly(Ala-Gly)as a model for silkⅠ ofBombyxmorisilk fibroin studied with two-dimensional spin-diffusion NMR under off magic angle spinning and rotational echo double resonance[J].Journal of Molecular Biology,2001,306(2):291-305.
[17]ASAKURA T,OHGO K,KOMATSU K,et al.Refinement of repeated beta-turn structure for silkⅠconformation ofBombyxmorisilk fibroin using C-13solid-state NMR and X-ray diffraction methods[J].Macromolecules,2005,38(17):7 397-7 403.
[18]UM I C,KI C S,KWEON H Y,et al.Wet spinning of silk polymer:Ⅱ.Effect of drawing on the structural characteristics and properties of filament[J].Int J Biol Macromol,2004,34(1-2):107-119.
[19]SHEN Y,JOHNSON M A,MARTIN D C.Microstructural characterization ofBombyxmorisilk fibers[J].Macromolecules,1998,31(25):8 857-8 864.
