一种红光树枝状铱配合物的合成、表征及其对Hg2+的识别研究
2011-09-15李襄宏赵鑫帝吕康乐张爱清
李襄宏赵鑫帝 吕康乐 张爱清
(中南民族大学化学与材料科学学院,武汉 430074)
一种红光树枝状铱配合物的合成、表征及其对Hg2+的识别研究
李襄宏*赵鑫帝 吕康乐 张爱清
(中南民族大学化学与材料科学学院,武汉 430074)
本文基于Ir(Btp)2(acac)为发光内核,合成了一种外围为萘环的苄醚型树枝状红光铱配合物,并通过NMR、MS和元素分析实验表征了该配合物。利用紫外-可见吸收光谱与磷光光谱实验研究了该配合物对金属离子的识别作用。结果表明:在CH3CN/THF溶液中,仅Hg2+的加入能引起配合物的最大吸收峰和发射峰均发生蓝移,溶液颜色由桔黄色变为浅绿色。该配合物可作为识别汞离子的光化学传感器。
铱配合物;磷光;汞离子;离子识别
近年来,以重金属磷光配合物为化学传感器引起了人们的极大兴趣[1-3]。与有机荧光材料相比,重金属磷光配合物具有较大的Stokes位移和较强的磷光信号,可与背景的荧光信号相区分[1-4]。作为性能最好的磷光材料[5],铱配合物在小分子及离子识别领域引起了人们的广泛关注。通过改变配体结构,将不同的受体单元引入铱配合物,利用其3MLCT态吸收和3MLCT态发射性质的变化,铱配合物不仅可以作pH探针[6-7],还实现了对阴离子[7-10]、阳离子[11-17]以及半胱氨酸[18]的识别。但是,关于铱配合物用于离子检测的报道总体上还不多见,因此对其合成及其对重金属离子识别的研究具有重要意义。
Hg2+作为一种高毒性的金属离子,不仅严重污染环境,而且对人的神经系统也具有极大的破坏作用,因此如何快速、准确地识别汞离子非常重要。本文合成了外围为萘环的苄醚型树枝状红光铱配合物 Ir(Btp-NG2)2(acac),其合成路线如 Scheme 1所示。其发光内核为Ir(Btp)2(acac),由于Btp含有硫原子,提供了能与Hg2+作用的接受单元[15-16,19],将该配合物用于Hg2+的识别,取得了令人满意的结果。
1 实验部分
1.1 试剂和仪器
2-(2-苯并噻吩)吡啶-4-甲醇按文献[20]方法合成;NG2-Br按文献[21]方法合成。乙腈、四氢呋喃、MnSO4·H2O、(NH4)2Fe(SO4)·6H2O、AgNO3、Hg(NO3)2·1/2H2O、Pb(NO3)2、Ni(NO3)2·6H2O、Zn(NO3)2·6H2O、Cd(NO3)2·4H2O、Co(NO3)2·6H2O、Cu(NO3)2·3H2O 均购自国药集团化学试剂有限公司,为A.R.试剂。
紫外-可见光谱在LABMDA 35紫外-可见分光光度计上测试得到;荧光光谱在LS 55荧光光谱仪上测试得到。核磁共振谱在Mercury Plus 400 NB核磁共振仪上测定;元素分析由VarioELⅢO-元素分析测试系统完成;质谱在SHIMADZU基质辅助激光电离解吸-时间飞行质谱仪(MALDI-TOF-MASS)上获得。
1.2 配体Btp-NG2的合成
N2保护下,将 1.0 mmol 2-(2-苯并噻吩)吡啶-4-甲醇溶在10 mL THF中,依次加入1.2 mmol NaH,1.1 mmol NG2-Br,室温下搅拌 2~3 h 后,加 20 mL蒸馏水终止反应,用CH2Cl2萃取2~3次后合并有机相,水洗2~3次后用无水Na2SO4干燥,滤除干燥剂后,旋蒸除去溶剂即得到粗品,柱层析分离得到浅黄色固体,产率:60%。1H NMR(CDCl3,400 MHz):δ 8.58(d,J=4.8 Hz,1H),7.84~7.73(m,22H),7.50~7.46(m,12H),7.32~7.30(m,2H),7.13(d,J=4.8 Hz,2H),6.73(s,4H),6.65(s,2H),6.63(s,2H),6.58(s,1H),5.17(s,8H),5.00(s,4H),4.54(s,4H);13C NMR(CDCl3,100 MHz):δ 160.51,160.40,152.89,149.96,148.53,145.00,140.90,140.72,140.37,139.62,134.50,133.52,133.35,128.68,128.26,128.03,126.69,126.53,126.38,125.61,125.35,124.80,124.45,122.84,122.83,121.60,121.09,117.84,107.06,106.74,101.96,101.90,73.00,70.48,70.27。m/z[MALDI:DI]:1167.5(M+),1275.2(M+Ag+)。C79H61NO7S(%)E.A.,Found.(Calcd.):C 81.21(80.56),H 5.26(5.51),N 1.20(1.26)。
1.3 配合物Ir(Btp-NG2)2(acac)的合成[20]
N2保护 下,1.28 mmol Btp-NG2 及 0.583 mmol IrCl3·3H2O 溶解在 15 mL 乙氧基乙醇/H2O(3∶1,V/V)中。100~120℃反应24 h后,冷却反应液,加入10 mL蒸馏水抽滤得到固体,依次用无水乙醇、正己烷、无水乙醚洗涤2~3次后晾干。将所得产品与0.5 mmol乙酰丙酮(acac)以及 0.5 mmol无水碳酸钠溶解在9 mL乙氧基乙醇中,100~120℃反应12~15 h后,冷却反应液,加入10 mL蒸馏水抽滤得到固体,晾干后柱层析(二氯甲烷/石油醚)分离得到暗红色固体。产率:45%。1H NMR(DMSO-d6,400 MHz):δ 8.35(d,J=6.0 Hz,2H),7.89~7.82(m,34H),7.69(s,1H),7.61(d,J=7.6 Hz,2H),7.51~7.45(m,24H),7.22(d,J=5.2 Hz,1H),6.96(t,J=8.6 Hz,2H),6.75~6.68(m,18H),6.63(s,2H),6.09(d,J=8.4 Hz,1H),5.22(s,1H),5.20(s,16H),5.04(s,8H),4.83(s,4H),4.59(s,4H),1.63(s,6H)。m/z[MALDI:CHCA]:2628.00(M+2)。C163H127N2O16S2Ir(%)E.A.,Found.(Calcd.):C 74.55(74.28),N 1.07(1.13),H 4.87(4.95)。UV-Vis(λ,ε/104L·mol-1·cm-1):273(11.85),310(5.18),341(2.87),478(0.71)。
1.4 配合物的光谱实验
光谱滴定实验中Ir(Btp-NG2)2(acac)乙腈/四氢呋喃溶液(9∶1,V/V)的浓度恒定为 2.0×10-5mol·L-1,加入到Ir(Btp-NG2)2(acac)溶液中的不同金属盐类化合物溶液的浓度为 1×10-2mol·L-1。用移液管移取 2.5 mL Ir(Btp-NG2)2(acac)乙腈/四氢呋喃溶液(9∶1,V/V)于1 cm光程长的石英液槽中,然后以微量注射器取小量体积的金属离子溶液逐步加入到石英槽内,加入后静置1 min,使之充分混合,然后测定光谱变化。金属离子盐溶液的总加入量不超过100 μL,以保证溶液体积无明显变化。
2 结果与讨论
2.1 紫外-可见吸收光谱
Ir(Btp-NG2)2(acac) 在乙腈/四氢呋喃溶液(9∶1,V/V)的紫外-可见吸收光谱如图1所示。出现在280~400 nm的吸收峰归属于外围为萘环的苄醚型树枝状C^N配体2-苯并噻吩吡啶的单线态π-π*跃迁[14,22]。位于478 nm的弱吸收峰则归属于单重态的金属→配体的电荷转移跃迁(1MLCT)[14,22]。随着Hg2+的加入,Ir(Btp-NG2)2(acac)的吸收光谱发生了明显变化 (见图1)。478 nm的吸收峰逐渐变弱,并在420 nm处出现了1个新的吸收峰,在443和388 nm处出现2个等当点。其最大吸收光谱蓝移了近58 nm,溶液颜色由桔黄色变为浅绿色。这表明Ir(Btp-NG2)2(acac)可作为“肉眼识别”的Hg2+比色传感器。从图1插图中的滴定曲线可以看出Ir(Btp-NG2)2(acac)和Hg2+形成了 1∶1 的配合物。对 Ir(Btp-NG2)2(acac)的滴定曲线进行1∶1拟合,得到其与Hg2+的结合常数为3.6×104L·mol-1[23],与文献[15]报道的数值比较接近,这说明外围为萘环的苄醚型树枝的引入对Ir(Btp-NG2)2(acac)识别金属离子的影响不大。而对于其他金属离子如 Co2+、Cd2+、Fe2+、Ni2+、Pb2+、Ag+、Zn2+、Mn2+等,Ir(Btp-NG2)2(acac)的吸收光谱几乎没有发生变化。可见,Ir(Btp-NG2)2(acac)对Hg2+具有高度的选择性。
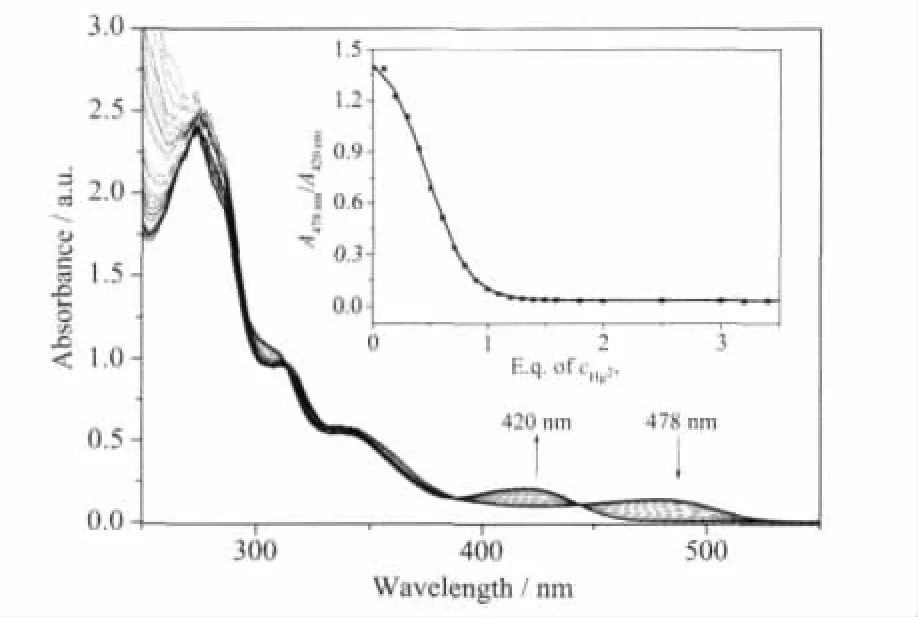
图1 随汞离子的加入,Ir(Btp-NG2)2(acac)的乙腈/四氢呋喃溶液(c=2×10-5mol·L-1)的紫外-可见光谱的变化;插图:A478nm/A420nm对汞离子的滴定曲线Fig.1 UV-Vis absorption spectra changes of Ir(Btp-NG2)2(acac)(c=2×10-5mol·L-1)in CH3CN/THF solutions upon the addition of Hg2+;Inset:A478nm/A420nmchanges as a function of cHg2+
2.2 磷光光谱
Ir(Btp-NG2)2(acac) 在乙腈/四氢呋喃溶液(9∶1,V/V)的磷光光谱(未除氧)如图2所示。该配合物的最大发射峰位于614 nm,为红光发射。随着Hg2+的加入,614 nm处的发射峰逐渐减弱,并在580 nm处出现了1个新的发射峰,强度逐渐增强。最大发射峰蓝移了32 nm,发射光颜色从红光变为桔黄光。另外,从磷光光谱的滴定曲线可以得出Ir(Btp-NG2)2(acac)与 Hg2+形成了 1∶1 的配合物,这与从紫外-可见吸收光谱滴定实验中得到的结果一致。
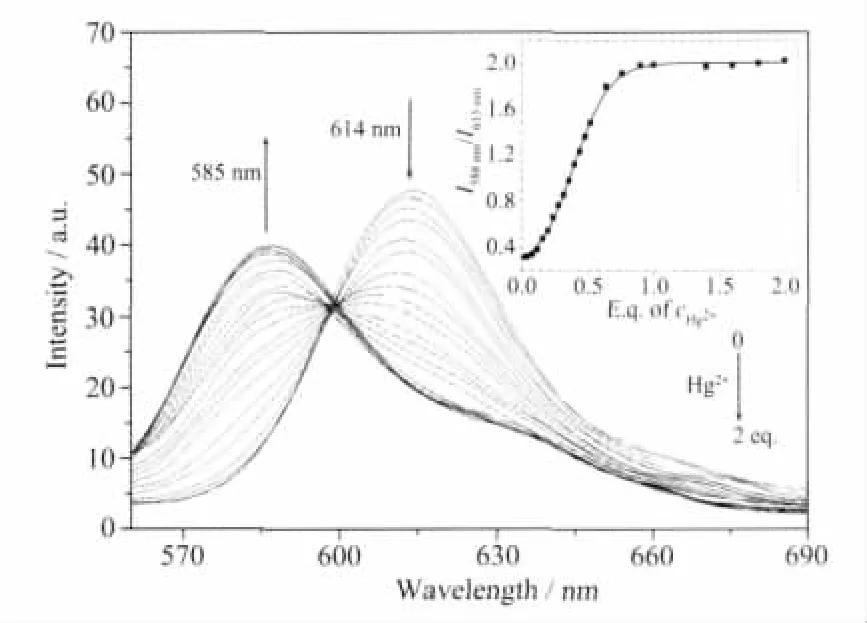
图2 随汞离子的加入,Ir(Btp-NG2)2(acac)的乙腈/四氢呋喃溶液(c=2×10-5mol·L-1)的非除氧磷光光谱的变化(λex=360 nm);插图:I588nm/I615nm对汞离子的滴定曲线Fig.2 Phosphorescent spectra changes of Ir(Btp-NG2)2(acac)(c=2×10-5mol·L-1)in air-equilibrated CH3CN/THF solutions upon the addition of Hg2+(λex=360 nm);Inset:I588nm/I615nmchanges as a function of cHg2+
随后,我们将其他金属离子如Co2+、Cd2+、Fe2+、Ni2+、Pb2+、Ag+、Zn2+、Mn2+等分别加入Ir(Btp-NG2)2(acac)的溶液,考察其对金属离子的选择性。发现其磷光光谱只发生了强度上的微弱变化,光谱未发生移动。从图3可见,只有加入Hg2+才会引起Ir(Btp-NG2)2(acac)的发射光谱发生明显的变化。由此,进一步表明Ir(Btp-NG2)2(acac)对Hg2+有非常高的选择性(如图3 所示)。
2.3 Ir(Btp-NG2)2(acac)对Hg2+的识别机理
根据软硬酸碱理论[24],汞离子是一种软酸,对硫原子(软碱)有着比较高的结合能力。Palomares等发现了汞离子和硫原子配位能引起钌配合物溶液颜色的显著变化[25-26]。因此,配合物Ir(Btp-NG2)2(acac)的光物理性质的显著变化,是由汞离子和配体上硫原子的孤对电子发生配位作用引起的[15-16,19]。由于非共轭型树枝的引入对配体及配合物的能级几乎没有影响[20],而Ir(Btp-NG2)2(acac)-Hg的吸收和发射性质明显不同于文献所报道的Hg-Btp[15]的吸收和发射性质,因此,可以排除Hg2+的加入引起配合物Ir(Btp-NG2)2(acac)发生分解的可能性。
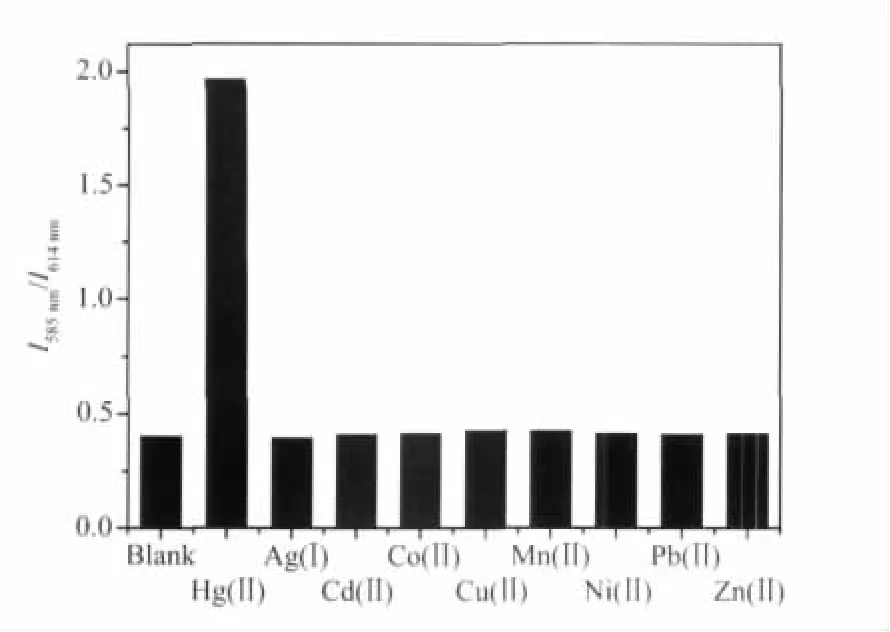
图3 Ir(Btp-NG2)2(acac)乙腈/四氢呋喃溶液(c=2×10-5mol·L-1)的发射光谱对等物质的量的各种金属离子的响应Fig.3 Luminescent responses of Ir(Btp-NG2)2(acac)(c=2×10-5mol·L-1)to various metal ions(equiv.molar ratio)in CH3CN/THF solutions
图4给出了加入Hg2+前后Ir(Btp-NG2)2(acac)和Ir(Btp-NG2)2(acac)-Hg配合物在发射波长分别为614和585 nm处对应的激发波长,这2个发射峰所对应的激发光谱明显不同。加入Hg2+前后,配合物Ir(Btp-NG2)2(acac)的紫外-可见吸收光谱、激发光谱以及发射光谱的显著变化表明Ir(Btp-NG2)2(acac)与配合物Ir(Btp-NG2)2(acac)-Hg的基态不同。由于非共轭型树枝的引入几乎不改变配体及配合物的能级[20],我们认为Hg2+与硫原子的配位作用降低了环金属化配体苯并噻吩部分的电子云密度和环金属化配体的给电子能力,这样铱中心的电子云密度也相应的降低,使得轨道间的能级差增大[15],从而导致紫外光谱和发射光谱的明显蓝移。

图4 配合物Ir(Btp-NG2)2(acac)和Ir(Btp-NG2)2(acac)-Hg配合物在发射波长分别为614 nm(—)和585 nm(…)所对应的激发光谱Fig.4 Excitation spectra of complex Ir(Btp-NG2)2(acac)and Ir(Btp-NG2)2(acac)-Hg monitored at 614 nm(—)and 585 nm(…)
3 结 论
合成了一种外围为萘环的苄醚型树枝状红光铱配合物,并通过NMR、MS和元素分析实验表征了该配合物。该配合物在各种金属离子作用下的紫外-可见吸收光谱和荧光光谱变化表明,该配合物是一类很好的汞离子比色和磷光多信号传感器,其对汞离子的高选择性主要是源于Hg2+与硫的强配位作用。
[1]de Silva A P,Gunaratne H Q N,Gunnlaugsson T,et al.Chem.Rev.,1997,97(5):1515-1566
[2]Demas J N,DeGraff B A.Coord.Chem.Rev.,2001,211(1):317-351
[3]Zhao Q,Li F Y,Huang C H.Chem.Soc.Rev.,2010,39:3007-3030
[4]ZHANG Deng-Qing(张灯青),ZHAO Sheng-Yin(赵圣印),LIU Hai-Xiong(刘海雄).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2008,24(11):1816-1821
[5]HUANG Chun-Hui(黄春辉),LI Fu-You(李富友),HUANG Wei(黄维).Introduction to Organic Light-Emitting Materials and Devices(有机电致发光材料与器件导论).Shanghai:Fudan University Press,2005:334-348
[6]Licini M,Gareth Williams J A.Chem.Commun.,1999:1943-1944
[7]Zhao Q,Liu S J,Shi M,et al.Organometallics,2007,26:5922-5930
[8]Goodall W,Williams J A G.J.Chem.Soc.,Dalton Trans.,2000:2893-2895
[9]Zhao Q,Li F,Liu S,et al.Inorg.Chem.,2008,47:9256-9264
[10]Lou B,Chen Z Q,Bian Z Q,et al.New J.Chem.,2010,34:132-136
[11]Ho M L,Hwang F M,Chen P N,et al.Org.Biomol.Chem.,2006,4:98-103
[12]Ho M L,Cheng Y M,Wu L C,et al.Polyhedron,2007,26:4886-4892
[13]Schmittel M,Lin H.Inorg.Chem.,2007,46:9139-9145
[14]Zhao Q,Liu S,Li F,et al.Dalton Trans.,2008:3836-3840
[15]Zhao Q,Cao T,Li F,et al.Organometallics,2007,26:2077-2081
[16]Zhao N,Wu Y H,Wen H M,et al.Organometallics,2009,28:5603-5611
[17]Araya J C,Gajardo J,Moya S A,et al.New J.Chem.,2010,34:21-24
[18]Chen H,Zhao Q,Wu Y,et al.Inorg.Chem.,2007,46:11075-11081
[19]Zou Y,Wan M,Sang G,et al.Adv.Funct.Mater.,2008,18:2724-2732
[20]Li X,Chen Z,Zhao Q,et al.Inorg.Chem.,2007,46:5518-5527
[21]Vögtle F,Plevoets M,Nieger M,et al.J.Am.Chem.Soc.,1999,121(26):6290-6298
[22]HUANG Jia(黄嘉),JIANG Ya-Dong(蒋亚东),TANG Xian-Zhong(唐先忠),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2009,25(3):501-505
[23]Kao T L,Wang C C,PanY T,et al.J.Org.Chem.,2005,70:2912-2920
[23]Pearson R G.J.Am.Chem.Soc.,1963,85(22):3533-3539
[24]Coronado E,Galan-Mascaros J R,Martí-Gastaldo C,et al.J.Am.Chem.Soc.,2005,127(35):12351-12356
[25]Nazeeruddin M K,Censo D D,Humphry-Baker R,et al.Adv.Funct.Mater.,2006,16:189-194
[26]Yang H,Qian J,Li L,et al.Inorg.Chim.Acta,2010,363:1755-1759
A Dendritic Red Iridium Complex:Synthesis,Characterization and Hg2+Recognition Properties
LI Xiang-Hong*ZHAO Xin-DiLÜ Kang-Le ZHANG Ai-Qing
(College of Chemistry and Materials,South-Central University for Nationalities,Wuhan 430074,China)
A Ir(Btp)2(acac)cored red dendrimer with benzyloxy-based dendrons bearing naphthyl peripheral group was synthesized and characterized by NMR,MS and element analysis experiments.The metal ions recognition properties were investigated by absorption and emission spectra.Only upon addition of Hg2+,obvious blue-shifts both in absorption spectra and emission spectra were observed with the color of the CH3CN/THF solution changing from orange-yellow to light green.The results demonstrated that an optical chemo-sensor for Hg2+based on the iridium(Ⅲ)dendrimer was realized.
iridium(Ⅲ) complexes;phosphorescence;mercury(Ⅱ) ion;ions recognition
O614.82+1
A
1001-4861(2011)02-0303-05
2010-09-06。收修改稿日期:2010-10-28。湖北省自然科学基金(No.BZY09008)资助项目。
*通讯联系人。E-mail:lixhchem@yahoo.com.cn
