巨细胞病毒感染对大鼠肝移植慢性排斥反应的致病机制探讨
2011-09-04陈海鸣万仁华邹志森单人锋高良辉
陈海鸣,王 英,万仁华,邹志森,单人锋,高良辉*
(1南昌大学第一附属医院,南昌 330006;2江西省电力职业技术学院)
肝脏移植是终末期肝病的惟一有效治疗方法,慢性排斥反应(CR)是移植肝功能丧失的重要原因。研究发现,巨细胞病毒(CMV)感染是CR发生的危险因素之一。2007年1月~2009年12月,我们观察CMV感染的肝移植受体大鼠慢性排斥反应的发生情况及纤维增生因子转化生长因子β1(TGF-β1)、血小板衍生生长因子(PDGF)和碱性成纤维细胞生长因子(bFGF)表达,初步探讨CMV感染对慢性排斥反应的致病机制。
1 材料与方法
1.1 CMV感染模型制作及干预 肝移植受体大鼠(为近交系DA雄性大鼠)84只,体质量250~350 g,均在标准条件下饲养。按随机化原则分为实验组和对照组各42只,肝脏移植术后当天至移植后30 d皮下注射CsA 1 mg/(kg·d)。实验组移植当天腹腔注射人巨细胞病毒(HCMV,浙江大学第一附属医院血液病研究所馈赠[1])0.4 ml,对照组腹腔注射生理盐水0.4 ml。两组均于移植术后0、1、2 d肌肉注射氨苄青霉素200 mg/(kg·d)。
1.2 相关指标观察 两组均于肝移植后1、6、10、20、30、60 d各处死6只大鼠,采集移植肝脏及血清观察以下指标。
1.2.1 肝组织病理学变化 取肝组织制作切片,常规HE染色、Masson三色染色,参考Gao等[2]方法观察肝组织病理学变化。
1.2.2 排斥反应活动指数(RAI) 对移植肝脏、胆管炎性损伤、阻塞性动脉病变及纤维化按程度轻重计算RAI。①胆管炎性损伤:损伤为0分;少数胆管被炎症细胞围绕,上皮细胞有核/浆比例增加等轻度反应为1分;多数或全部胆管有炎症细胞浸润,上皮细胞呈核多形性、极性改变,胞质空泡化等退行性改变略多为2分;上述两项伴有退行性变和局灶性管腔破坏明显,或部分胆管结构完全破坏为3分。②肝动脉阻塞性病变:正常动脉为0分;内膜增生或细胞浸润、动脉管腔缩小<10%原管腔为1分;动脉管壁增厚、10%≤管腔缩小<50%为2分;动脉因阻塞性动脉病变或纤维化,动脉管腔缩小≥50%原管腔或完全闭塞为3分。③肝纤维化:无纤维化为0分;汇管区纤维化,小叶间无纤维间隔形成为1分;汇管区纤维化,小叶间不完全的纤维间隔形成为2分;汇管区纤维化,小叶间完全的纤维间隔形成为3分;广泛纤维化形成,弥散性肝硬化为4分。三项RAI相加为总RAI(ORAI)。
1.2.3 肝组织 TGF-β1、PDGF、bFGF mRNA 表达检测 取冰冻肝组织30 mg。Trizol法提取RNA,逆转录cDNA,冰上行PCR反应,凝胶电泳30 min,摄影,采用RT-PCR检测各指标mRNA表达情况。
1.2.4 血清 TGF-β1、PDGF、bFGF 表达检测 取血清0.1 ml,采用双抗体夹心ELISA法,按试剂盒说明操作。
1.3 生存期 除处死大鼠外,对每组所剩6只,采用Kaplan-Meier法计算生存期。
1.4 统计学方法 采用SPSS11.5统计软件,所得数据以表示,生存率比较以Kaplan-Meier法检验,组间比较用单因素方差分析One-way ANOVA,选择LSD或Bonfferroni/Dunne t检验。检验水准α=0.05。
2 结果
2.1 病理学变化 两组均显示移植肝进行性加重的慢性排斥反应,表现为中度到重度的泡沫细胞阻塞性动脉病变、胆管损伤或消失、细胞浸润和肝纤维化。取材时间越接近临终期,病变特点越典型。
2.2 RAI ①胆管炎性损伤:肝移植后20 d内两组RAI无显著差异;实验组及对照组移植后30 d RAI分别为2.17 ±0.98、1.33 ±0.52,P <0.01。即实验组胆管损伤发生早于对照组。②肝动脉阻塞性病变:肝移植后20 d内两组无显著差别。移植30 d对照组、实验组 RAI分别为 1.33±0.52和 2.50±0.55,P <0.01。但对照组30 d、实验组20 d 和对照组60 d、实验组30 d相比无统计学意义,说明实验组动脉阻塞性病变出现的时间早。③肝脏纤维化:对照组和实验组肝移植后20 d肝纤维化RAI分别为1.0 ±0.63、1.67 ±0.52,P <0.05;30 d 分别为2.67 ±0.52、3.17 ±0.75,P <0.05;即实验组肝纤维化明显重于对照组。两组不同时点ORAI见表1。
表1 两组不同时间总排斥反应活动指数比较()

表1 两组不同时间总排斥反应活动指数比较()
注:与对照组比较,*P <0.01
组别10 d 20 d 30 d实验组 2.83 ±1.33 5.17 ±1.47* 7.17 ±1.47*对照组3.00 ±1.33 8.00 ±1.67 10.83 ±2.32
2.3 移植肝 TGF-β1、PDGF、bFGF mRNA 表达 见图1。
2.4 外周血 TGF-β1、PDGF、bFGF表达 见图2。
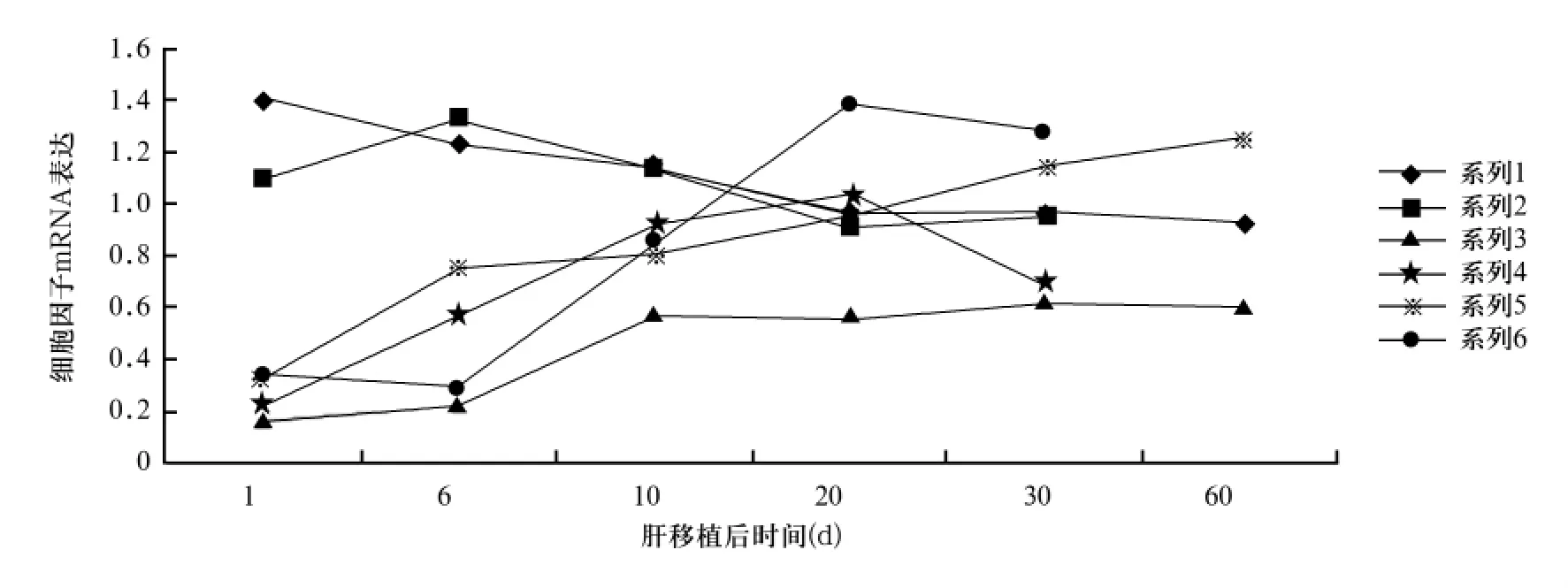
图1 两组肝组织TGF-β1、PDGF、bFGF mRNA表达

图2 两组血清TGF-β1、PDGF、bFGF表达
2.5 生存期比较 实验组和对照组生存期分别为(41.13 ±12.45)、(58 ±14.93)d,两组比较 P >0.05。
3 讨论
据报道,肝脏移植后HCMV的感染率为30% ~65%,可引起胆管消失,胆管萎缩及动脉阻塞性病变。其中18%~40%的患者出现临床症状,发病高峰期为移植后第1~3个月。有关HCMV感染与肝脏移植慢性排斥反应的关系目前尚无明确定论。Lautenschlager等[3]报道,10例肝脏移植后因慢性排斥反应导致移植物无功能者均有HCMV感染史;原位杂交检测所有移植物持续表达CMV-DNA,在剩余的胆管中有强表达,血管内皮细胞中有中等程度的表达。Arnold等研究证实,胆管消失综合征与持续HCMV感染有关。说明HCMV感染是慢性排斥反应的危险因子之一。本研究两组生存期无统计学差异,但实验组移植后20、30 d总RAI均显著高于对照组,说明HCMV感染加剧了慢性排斥反应的程度,加速了其进程。组织病理学半定量分析进一步支持该结果:实验组胆管损伤的出现显著早于对照组,动脉阻塞性病变明显重于和早于对照组,肝脏纤维化程度亦呈现同样趋势。
Michelson等[4]发现,HCMV 的 IE 蛋白可激活TGF-β1启动子,5 ~9 h 后 TGF-β1基因转录激活,导致HCMV感染早期TGF-β1mRNA水平升高。本研究实验组肝组织及血清TGF-β1表达水平均无明显升高,且与对照组无明显差异,说明HCMV感染加剧和加速慢性排斥反应时纤维化程度与TGF-β1表达水平无关。
PDGF是有丝分裂促进剂,能使间充质细胞转化成肌成纤维细胞,促使平滑肌细胞迁移与增生导致动脉粥样硬化、血管狭窄和慢性排斥;PDGF及其受体在心脏、肾脏和肺慢性排斥反应的血管病变中起关键作用[5~7]。本研究显示,慢性排斥反应时发生早期(10 d以内)实验组肝组织及血清PDFG表达升高,6~20 d时均明显高于对照组;慢性排斥反应晚期(60 d)两组PDFG表达无明显差异,提示PDFG表达升高可能参与了早期慢性排斥反应的形成。
bFGF是一多效细胞因子,在组织修复中起重要作用,可刺激血管平滑肌细胞增生、血管新生、细胞外基质积聚和神经元增生。Garrett等体外实验证实,HCMV在成纤维细胞中培养可使bFGF的表达转向高相对分子质量形式。Koskinen等发现,在大鼠心脏慢性排斥反应中,bFGF表达增多、炎症反应加重,导致血管新生和纤维化。本研究显示,慢性排斥反应时肝组织和血清bFGF均呈持续上升表达,实验组bFGF mRNA表达水平自20 d开始明显高于对照组,提示HCMV感染可增加bFGF mRNA表达水平,加速移植肝纤维化和慢性排斥反应进程。
总之,CMV感染能加剧慢性排斥反应泡沫细胞阻塞性动脉病变和肝脏纤维化病变的程度,加快慢性排斥反应的进程,其致病机制可能与增加PDGF和bFGF表达相关。
[1]Gao L,Qian S,Zeng L,et al.An animal model of human cytomegalovirus infection[J].Transplant Proc,2007,39(10):3438-3443.
[2]Gao LH,Zheng SS,Zhu YF,et al.A rat model of chronic allograft liver rejection[J].Transplant Proc,2005,37(5):2327-2332.
[3]Lautenschlager I,Hockerstedt K,Jalanko H,et al.Persistent cytomegalovirus in liver allografts with chronic rejection[J].Heratology,1997,25(1):190-194.
[4]Michelson S,Alcami J,Kim SJ,et al.Human cytomegalovirus infection induces transcription and secretion of transforming growth factor beta 1[J].J Virol,1994,68(9):5730-5737.
[5]Mancini MC,Evans JT.Role of platelet-derived growth factor in allograft vasculopathy[J].Ann Surg,2000,231(5):682-688.
[6]Lemstrom KB,Koskinen PK.Expression and localization of plateletderived growth factor ligand and receptor protein during acute and chronic rejection of rat cardiac allografts[J].Circulation,1997,96(4):1240-1249.
[7]Kallio EA,Koskinen PK,Aavik E,et al.Role of platelet-derived growth factor in obliterative bronchiolitis(chronic rejection)in the rat[J].Am J Respir Crit Care Med,1999,160(4):1324-1332.
