新资源食品蝉花菌丝体的开发
2011-08-08许胜杰叶淑幸陈劲初
许胜杰 叶淑幸 陈劲初
(台湾葡萄王生技股份有限公司)
1 蝉花简介
蝉花又名土蝉花、虫花、蝉草、蝉茸和胡蝉等,是由虫草属 (Cordyceps)真菌C.cicadae、C.sobolifera或C.cicadicola等真菌感染蝉科山蝉 (Cicada flammate)、蝼蛄 (Platypleura kaempferi)、黑蚱 (Crytotympana pustulata)及竹蝉 (Platylomia pieli)等幼虫,后于虫体头部形成花蕾状子座,而得名蝉花。药用部位为其子座及寄主昆虫的尸体 (菌核)。王琪、刘作易[1]将蝉花依不同的寄主及感染菌种分类为大蝉花或金蝉草 (Cordyceps cicadae),寄主为蠕虫 (Worm);小蝉花 (Cordycepssobolifera),寄主为蛹 (Pupa);及蝉草或蝉生虫草 (Cordycepscicadicola),寄主为成虫 (Adult)3种,并认为大蝉花才是真正的蝉花。但水野卓[2]及陈以平[3]等研究蝉花子实体所使用或发表者皆为小蝉花。蝉花多产于长江以南热带和亚热带地区,在中国大陆为福建、浙江、四川、云南、江苏等地。而中国台湾亦有农民曾在花莲光复乡掘获野生子实体 (图1)。
蝉花之名最早见于南北朝刘宋时代的 《雷公炮制论》中所记载的:“凡使蝉花要白花全者。收得后于屋下悬干,去甲土后用浆水煮一日,至夜焙干,研细用之。”野生蝉花的历史记载比冬虫夏草早了800年。蝉花入药已有一千多年的历史,根据宋朝苏颂的传统医书 《图经本草》记载:“山蜀中,其蝉头上有一角,如花冠状,谓之蝉花。”另据北宋唐慎微所著 《证类本草》记载:“蝉花味甘、性寒、无毒,具疏散风热、定惊解痉之效,主治小儿夜啼、心悸等症状。”《本草纲目》亦记载:“蝉花功同蝉蜕,又止疟疾。”传统常用方剂如 “万应蝉花散”、“蝉花明目方”及 “蝉花清热方”等,在 《中华药物大全》和 《中华药海》两部中药典籍中均有记载。在日本,也早在1612年即初见蝉花之名于 《多识篇》及小野兰山的 《本草纲目启蒙》(1803)等文献。

图1 台湾发现的野生蝉花子实体
2 功能及成分
经分析,蝉花含有腺苷、多种必需氨基酸、甘露醇、多种生物碱及麦角甾醇等成分。人工培育的蝉花菌丝体中营养成分含甘露醇2.18%、多糖21.73%,其所含氨基酸、虫草多糖、甘露醇均与冬虫夏草相似。[2]比较冬虫夏草及蝉花2种传统药材的活性成分后发现,蝉花所含虫草酸 (mannitol)及腺苷 (adenosine)的量均高于冬虫夏草,特别是腺苷含量为冬虫夏草的4倍之多。[4]蝉花子实体具有与冬虫夏草相似的化学成分,可能具有与冬虫夏草相似的药用价值。天然蝉花子实体及人工发酵菌丝体皆具有多种药理作用。
2.1 免疫调节作用 蝉花子实体含有半乳甘聚糖,依其与Con A亲和性高低将其分为亲和性高之CI-A及亲和性低之CI-P,于动物实验中连续喂食CI-A 10天、每天1 mg/kg后,发现它具有抑制实验动物Sarcoma 180肿瘤生长的功效;而CI-P则无此功效。[3]以蝉拟青霉菌株进行液态发酵生产的蝉花多糖,有助于提升实验动物白血球的数量;减少脂质过氧化物的生成,维持还原型谷胱甘肽(GSH)的含量,具有清除自由基的能力;并对肺泡巨噬细胞有活化作用。[5]以蝉花多糖体喂食高龄大鼠也有助于增强其组织器官的免疫作用。[6]以蝉花多糖对小鼠进行淋巴转化及巨噬细胞吞噬等实验结果得知,蝉花多糖体具有提高免疫功能的作用。[7]另外,Fujita等[8]从蝉花培养滤液中筛选获得了活性成分多球壳菌素 (ISP-1)(图2)。药理研究显示,ISP-1具有显著的双向免疫调节作用,能阻断IL-2受体下游的途径,抑制丝氨酸棕榈酰转移酶(SPT)活性,从而特异性抑制T细胞的增殖,而其抑制活性更为环孢菌素的10~100倍。
2.2 抗疲劳作用 喂食小鼠蝉花子实体水煎剂能明显延长小鼠的游泳时间,于实验结果发现蝉花水萃液有助于提高在常压缺氧状态下及在高温环境下的小鼠的存活时间。[9]
2.3 镇静作用 以动物进行实验,蝉花组小鼠给药1小时后测定10分钟内自主活动次数,显著少于对照组。食用人工培养的蝉花子实体有助于延长小鼠的睡眠时间,同时缩短戊巴比妥钠的翻正反射消失时间,还能增加在单位时间内的入睡率,同时证明人工培养品与天然蝉花具有相近的功效。[9]
2.4 改善肾功能 经药理研究证实天然蝉花子实体与冬虫夏草成分相近,而近年来许多动物及临床实验研究也发现,蝉花具有减轻各项慢性肾脏疾病的功效。以蝉花子实体进行临床实验研究发现,每日饮用蝉花汤有助于改善慢性肾功能衰竭患者血液及尿液中的肌酸酐 (Creatinine)清除率,改善血清蛋白含量,及减少尿蛋白排出,对早、中期慢性肾功能不全患者有一定程度的疗效。蝉花可以改善间质肾小管病变,能保护肾小管,改善肾血流动力学。[10]以固态培养蝉花菌丝 (C.sobolifera)喂食肾小球硬化的实验大鼠,其结果显示喂食固体培养蝉花菌丝体能明显减少大鼠血清肌酸酐值 (Serum creatinine/Scr)和抑制尿素氮(Blood urea nitrogen,BUN)的上升 (P<0.05),减轻大鼠肾小球硬化程度,有助于延缓大鼠肾小球硬化进程和慢性肾衰竭进展速度。[11]另一方面,利用高糖模拟糖尿病患者体内的高糖环境,探讨了多球壳菌素(ISP-1)在糖尿病肾病肾脏肥大和早期肾硬化过程中所起的作用,结果显示,ISP-1不但可有效抑制肾小球系膜细胞系肥大,还能明显减少细胞外基质分泌,因此有望将其用于治疗包括糖尿病肾病在内的肾小球硬化。[12]
2.5 降血糖 以天然蝉花子实体水萃物浓缩液连续喂食糖尿病小鼠10天,对糖尿病小鼠和正常小鼠的空腹血糖值具有显著降低作用。[13]对正常小鼠投予50 mg/kg的蝉花粗多糖体6小时后,其血糖值均有明显下降。[2]
2.6 镇痛解热 柴一秋等[14]由蝉花的人工固体或液体发酵培养物中萃取而得到一种腺苷衍生物N6-(2-hydroxyethyl)-adenosine。此化合物为虫草的特有成分,可作为虫草制品的质量控制指标之一。此外,N6-(2-hydroxyethyl)-adenosine可与α受体结合,抑制神经递质释放,从而产生镇痛作用。
2.7 抑制动脉粥样硬化形成 Hojjati等[15]以0.3 mg/kg的多球壳菌素 (ISP-1)连续60天进行每隔一天注射于动脉粥样硬化大鼠实验,结果显示,ISP-1对鞘脂类的合成有明显的抑制作用,实验大鼠的动脉硬化损伤面积明显减少。因此,ISP-1的抑制丝氨酸棕榈酰转移酶 (SPT)活性作用也许能作为治疗动脉粥样硬化的一个选择。
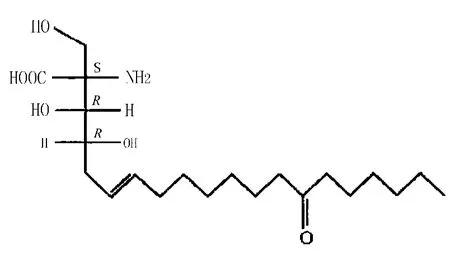
图2 ISP-1的结构
3 蝉花菌丝体开发
由于固态培养需耗费大量的人力,其产品中带有许多未耗尽的基质,所以我们以液态发酵培养方式大量生产蝉花菌丝体做为天然蝉花的代替品,并进行安全性试验及几种肾功能损伤保护模式的评估试验。
3.1 液态发酵研究 蝉花菌能利用多种碳源,其中以葡萄糖及蔗糖培养生长最佳;氮源则以酵母萃出物最佳。培养温度为24~26℃,最适pH约5.0~6.0之间,以5吨发酵槽约需培养3~5天即可完成发酵,生物质量可达2.0%以上。经减压浓缩后冷冻干燥,可得发酵全液干燥品,再经磨粉后即得蝉花菌丝体素材。
3.2 安全性评估试验 天然的蝉花子实体毒性低,自中国古代以来已有食用的纪录。上述发酵生产的蝉花菌丝体已完成基因毒性试验、14天的仔猪急毒性试验、28天及90天大鼠喂食毒性试验等安全性评估试验。在基因毒性试验方面,以2.0 g/kg体重的剂量喂食Sprague-Dawley(SD)品系大鼠其体外染色体毒性试验及动物体内微核试验。从染色体异常测试结果得知,蝉花发酵菌丝体不会使受试小鼠的染色体数目及结构发生改变,也无骨髓抑制作用及对染色体损伤的现象,没有致突变作用。在体外鼷鼠淋巴瘤tk分析法试验证实蝉花发酵菌丝体并没有明显的细胞毒性,也不会造成细胞株基因突变。而进一步将蝉花发酵菌丝体添加于离乳仔猪饲料中,进行14天的急毒性及其行为表现评估的试验结果,添加蝉花5%于离乳仔猪饲料中,连续喂食14天后不会引发仔猪急毒性现象,对其生长性能表现上并无促进或危害;在28天喂食毒性试验方面,分别以2.0 g/kg体重剂量的蝉花发酵菌丝体连续喂食SD大鼠28天及90天后,经血液及各项病理切片观测结果显示,均未对受试动物产生明显的毒性影响。
3.3 肾损伤保护模式评估
(1)蝉花菌丝体对庆大霉素 (Gentamycin)诱发大鼠肾脏损伤的缓解、保护作用。Gentamycin为临床上常用的抗生素,会引起10%~20%使用者肾小管坏死,导致肾衰竭,因此常被使用于探讨肾衰竭模式。文献中常用剂量为120 mg/kg大鼠体重,在我们预实验中发现需160mg/kg大鼠体重才有明显的伤害指标出现,故试验时,试验组先喂食蝉花1周,第2周起以160 mg/kg剂量注射大鼠并同时饲以蝉花。实验结果显示,于诱发肾损伤前先喂食蝉花菌丝体的大鼠,经Gentamycin诱发肾损伤后,发现其肾损伤程度小于未喂食蝉花或于诱发损伤后开始喂食蝉花的实验大鼠,并且其血尿中的尿素氮及血清肌酸酐、微白蛋白(Microalbumin)及NAG(N-Acetyl-β-D-glucosaminidase)等指标值较不易上升。其中无论是第3天或第7天的发酵液冻干品均有此效果。另外,还进行了剂量效应分析及产品划分分析,发现喂食量低至50 mg/kg时仍有效果,而且将全液分成菌丝及滤液,发现两部分皆有效果。
(2)蝉花菌丝萃出物对脂多糖 (Lipopolysaccharide,LPS)诱发大鼠肾脏损伤的缓解、保护作用。LPS所引起的氧化压力来自于不正常的讯号传递、细胞失能、自溶、细胞凋亡及坏死。其中与死亡蛋白酶(caspase)有关的细胞凋亡、内质网压力 (ERstress),以及与自噬因子Beclin-1、LC-3有关的自溶现象已被证实在组织伤害上扮演了重要角色。试验首先以PKI及MDCK两种分别为近端及远程肾小管细胞株进行测试,发现LPS对两者的毒杀性皆可因蝉花菌丝体水萃取物的添加而减缓,而其中又以对远程肾小管细胞株在毒物处理下有较佳的存活率,亦即对LPS造成肾脏的毒害具有较好的保护潜力。另一方面,在动物试验时以蝉花菌丝体水萃物喂食由LPS(来源于E.coli O127:B8)引发肾损伤的大鼠,发现蝉花菌丝体水萃物可减轻LPS刺激对大鼠肾脏细胞的伤害,能有效改善大鼠的肾血流量 (Renal blood flow,RBF)及肾丝球过滤率 (Glomerular filtration rate,GFR),且对细胞凋亡、内质网压力及自溶三方面的伤害均具有改善其个别相关指标蛋白质的作用。[16]
(3)蝉花菌丝萃出物对环孢素 (Cyclosporine)诱发大鼠肾脏损伤的缓解、保护作用。Cyclosporine为免疫抑制剂,常用于器官移植病人以避免排斥作用,但具有肾毒性。以蝉花菌丝萃取物375 mg/kg(300 mg水萃物+75 mg酒精萃取物)连续饲喂大鼠2周后,连续注射Cyclosporine 7天,每天25 mg/kg,于注射期间持续喂食蝉花萃出物,结果发现因Cyclosporine伤害导致的肌酸酐及BUN清除率下降,皆可因喂食蝉花菌丝萃出物而得以改善。
(4)以蝉花菌丝体对以链脲霉素 (streptozotocin,STZ)诱发SD大鼠糖尿病肾脏损伤的保护作用。连续蝉花发酵液冻干粉500 mg/kg体重喂食大鼠12周,与STZ对照组相比,投予蝉花菌丝体组的肾组织中超氧歧化酶 (SOD)含量及过氧化氢酶 (CAT)蛋白质表现量显著高于STZ对照组,另发现蝉花菌丝体可以明显地降低血糖及抑制STZ引起的转化生长因子-β(transforming growth factor-β,TGF-β)蛋白表达过度,从中得知蝉花菌丝体对于肾脏组织有保护及延缓伤害的功效,血中BUN及肌酸酐皆有降低,一氧化氮 (NO)减低83%,IL-6、TNF-α、肾脏MDA、尿中蛋白NF-κ B、7GF-β都有下降趋势,肾脏肿大情形也得以改善。[17]
4 结论
由于固态培养蝉花需耗费大量的人力,产品中带有大量未耗尽的基质,且以太空包培养的方式可能会因高温加热时间长而导致塑化剂释出,相较而言,以液态发酵培养蝉花菌丝体是一种较安全并具节能环保作用的方式。保健食品开发首重安全,发酵所得蝉花菌丝体经基因毒性试验、14天的仔猪急毒性试验、28天及90天大鼠喂食毒性试验等安全性评估,显示蝉花菌丝体具有很高的食用安全性。在功能性评估方面,蝉花菌丝体可以改善间质肾小管病变,能保护肾小管,改善肾血流动力学。同时,蝉花菌丝体具有缓解过高的血糖与肾损伤的指标,对于保护糖尿病肾损伤大鼠有显著功效。蝉花与冬虫夏草同属虫生真菌复合体,且含有相近的化学成分,所以临床上常作为冬虫夏草的代用品。由于天然冬虫夏草产量日趋减少,而蝉花子实体不多,因此,蝉花菌丝体可望开发成为维护肾脏机能的保健食品。
[1]王琪,刘作易.药用真菌蝉花的研究进展[J].中草药,2004,34(4):469-471.
[2]水野卓,川合正允.菇类的化学生化学 [M].台湾国立编译馆,1992.
[3]陈以平.人工培育蝉花菌丝体对人系膜细胞增殖及细胞外基质合成的影响 [J].中医研究,2006,19(10):9-11.
[4]温鲁,唐玉玲,张平.蝉花与有关虫草活性成分检测比较[J].江苏中医药,2006,27(1):45-46.
[5]金丽琴,吕建新,杨介钻,李东、李安乐.蝉拟青霉总多糖对老龄大鼠巨噬细胞的激活作用 [J].中国病理生理杂志,2006,(1):116-119.
[6]金丽琴,吕建新,杨介钅赞,李东,李安乐.蝉拟青霉总多糖对老龄大鼠组织器官免疫功能调节的实验研究[J].中国病理生理杂志,2006,22(5):881-884.
[7]Fujita T.,Inoue K.,Yamamoto S.,Fungal metabolites.Part II.A potent immunosuppressive actively foundin Isaria sinclairii metabolite[J].J.Antibotics.1994,47(2):208-215.
[8]王砚,赵小京,唐法娣.蝉花药理作用的初步探讨[J].浙江中医杂志,2001,36(5):219-220.
[9]刘广玉,胡菽英.天然蝉花和人工培养品镇静镇痛作用比较 [J].中国现代应用药学,1991,8(2):5-8.
[10]金周慧,陈以平.蝉花汤延缓慢性肾功能衰竭进展的临床观察 [J].中华中医药学刊,2006,24(8):1457-1459.
[12]肖朝华,周建华,吴衡生.多球壳菌素对高糖诱导肾小球系膜细胞肥大及细胞外基质合成的影响[J].实用儿科临床杂志,2006,21(5):268-270.
[11]朱戎,陈以平,邓跃毅,王琳.固体培养蝉花菌丝延缓肾小球硬化作用及其机制的实验研究 [J].中国中西医结合肾病杂志,2005,6(2):70-75.
[13]宋捷民,忻家础,朱英.蝉花对小鼠血糖及造血功能影响 [J].中华中医药学刊,2007,25(6):1144-1145.
[14]柴一秋,韦忠民,陈祝安.从蝉拟青霉培养物中提取N6-(2-羟乙基)腺苷的方法.中国,1827633A.2006-09-06。
[15]Hojjati M.R.,Li Z.Q.,Zhou H.W..Effect of myriocin onplasma sphingolipid and atherosclerosis in apoE-deficient mice.J.Biol.Chem.,2005,280(11):10284-10289.
[16]Yu,C.C.,Chen C.C.,Ye S.S.,Chien C.T.,CordycepsSobolifera Extract Ameliorates Lipopolysaccharide-Induced Renal Dysfunction in the Rat,Am.J.Chin.Med.,2011,39(3):523-535.
[17]林子扬.蝉花发酵液对大鼠糖尿病肾损伤的保护作用[J].台湾弘光科技大学生物科技研究所硕士论文.2010.
