肺结核继发真菌感染患者分离真菌的基因检测与鉴定的研究
2011-06-21张丽
张 丽
(广州市花都区慢性病防治所,广东 广州 510800)
肺结核患者由于病程较长,长期的慢性消耗导致机体细胞免疫功能低下,肺组织及支气管结构均有不同程度的破坏,特别是病情较重的结核患者,往往由于肺部结核病变广泛,存在干酪样坏死和空洞等,使局部抵抗力降低,容易受到各种致病因子的侵袭,加上某些病例合并有糖尿病或其他疾病长期应用皮质激素等免疫抑制剂,使机体的抵抗力更为下降。因此结核患者合并真菌感染的状况日益增多,其中呼吸系统真菌感染占首位[1]。从2005年1月至2010年12月我单位收治肺结核患者3 049例,其中80例肺结核患者合并真菌感染。为探讨肺结核继发真菌感染患者分离真菌的基因鉴定及其类型,本文对80例肺结核患者呼吸道分泌物分离的99株真菌进行了生物学研究和基因鉴定及其分型,现将结果报道如下:
1 资料与方法
1.1 一般资料 肺结核合并真菌感染的患者80例,其中男性58例,女性22例,年龄18~63岁,平均47.8岁,X线检查和痰涂片(+)。所有病例痰连续3次培养均有酵母菌或霉菌生长。
1.2 培养基与试剂 Chrom培养基由上海科玛嘉微生物有限公司提供,微量生化反应管与试剂由杭州天和微生物试剂公司提供,白假丝酵母菌A型标准株ATCC 64550由乐通泰生物科技有限公司提供,ITS引物序列由北京赛百盛基因技术有限公司提供,白假丝酵母菌分型引物由上海生工公司合成,Taq酶、dN TP采用宝生物公司预混PCR试剂盒,Lyitcase细胞溶解酶由上海易佰聚有生物有限公司提供。
1.3 方法
1.3.1 真菌分离与鉴定 以咳痰法或气管插管吸引法采集患者下呼吸道分泌物标本[2],接种于沙氏培养基,28℃培养48~72 h后,进行涂片革兰染色镜检,凡假丝酵母菌划线接种于Chrom琼脂平板,置普通温箱内28℃培养48~72 h,凡培养基上呈优势生长的菌落判断为引起感染的病原菌,再进一步鉴定[3]。
1.3.2 常规方法鉴定 各分离菌株分别进行形态或/和生化反应鉴定。假丝酵母菌根据在Chrom培养基生长菌落的颜色、芽管试验、厚膜孢子形成试验、糖发酵及糖同化试验结果鉴定其菌种;霉菌根据菌落培养和形态特征以及镜下孢子和菌丝特点鉴定其菌种。
1.3.3 ITS检测与鉴定(真菌种间分型)
1.3.3.1 真菌基因组DNA的抽提 菌液离心后,用1 mol/L的山梨醇洗一次,用酵母用溶细胞酶[Lyticase(Sigma)]消化,获取原生质体。用10 g/L的十二烷基硫酸钠(SDS)裂解,苯酚氯仿混合提取法提取DNA[4]。
1.3.3.2 引物的设计与合成 引物序列ITS1:5'-TCCGTAGGTGAACCTGCGG-3',19 mer;ITS2:5'-GCTGCGTTCTTCATCGATGC-3',20 mer。 引 物稀释:用TE缓冲液稀释引物,终浓度为10 μmol/L。
1.3.3.3 PCR扩增 78株酵母菌与21株霉菌分别进行ITS序列的PCR扩增,条件与步骤为:反应体系总体积为50 μl,包括10×PCR 缓冲液5 μl,200 μmol/L dNTP,2 U Taq酶,引物 ITS1 和ITS2 各2 μl,蒸馏水补至50 μl。PCR反应在热循环仪上进行,95℃变性30 s,50℃退火30 s,72℃延伸30 s,40 个循环,而后72℃保持3 min延伸。
1.3.4 扩增产物分析 采用琼脂糖凝胶电泳法。PCR 产物5 μl与溴化乙啶2 μl混合,电泳缓冲液TBE,电压140 V,在含0.5 μg/ml溴化乙啶的1.5%琼脂糖凝胶电泳30 min,以50 bp、100 bp DNA梯型为分子量标准,电泳结果在紫外灯下观察。
1.4 白假丝酵母菌基因型分析 引物合成采用特异引物扩增白假丝酵母菌基因组DNA的25 S rDNA基因的内含子区,以内含子大小约379 bp及其中可转座Ⅰ型内含子片段的缺失或插入作为分型依据。一对分型引物P1、P2分别位于可转座Ⅰ型内含子的两翼[5]。P1:5'-ATAAGGGAAGTCGGCAAAATA GATCCGTAA-3'(上游引物),30 mer,P2:5'-CCTTGG CTGTGGTTTCGCTAGATAGTAGAT-3'(下游引物),30 mer。引物稀释:用TE缓冲液稀释引物至终浓度为10 μmol/L。PCR扩增方法如1.3.3.3。
2 结 果
2.1 病原性真菌种间分型结果 99株真菌的ITS序列鉴定结果及其与生物学鉴定的关系:酵母菌78株,符合率为83.3%;霉菌21株,符合率为71.4%;总符合率为80.8%,见表1和图1。
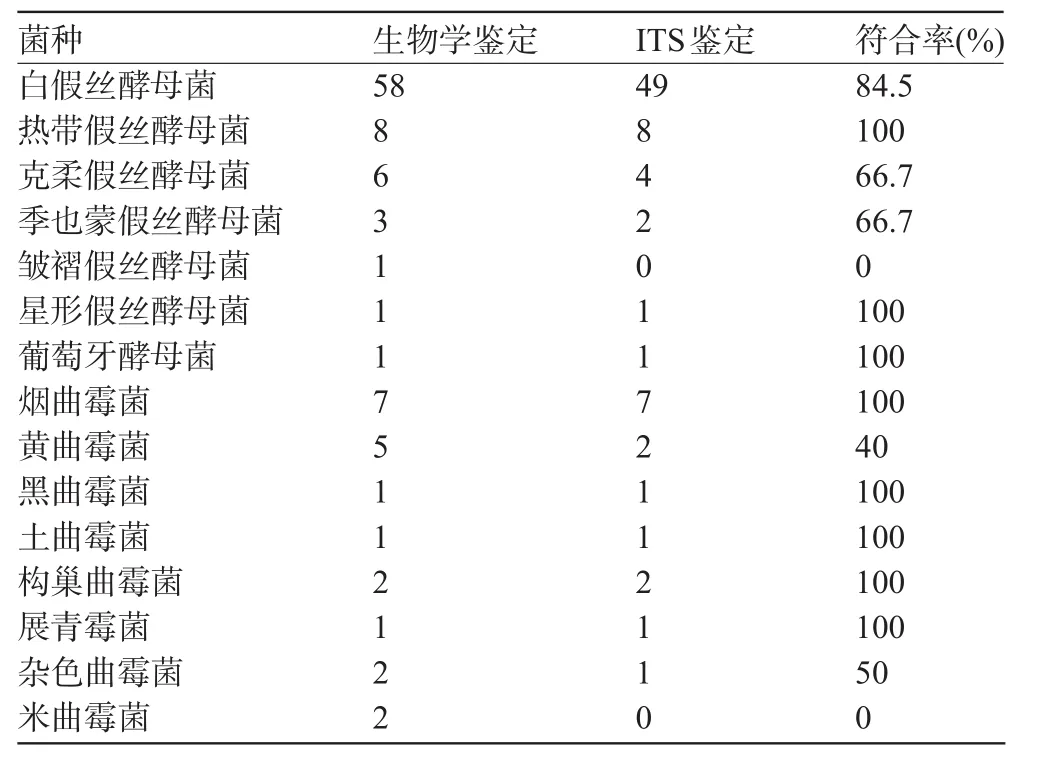
表1 肺结核合并真菌感染患者病原性真菌的ITS鉴定结果(株)
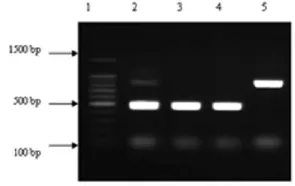
图1 病原性真菌的ITS序列PCR扩增产物电泳结果
2.2 病原性真菌的基因型 以P1、P2为引物,以白假丝酵母菌临床分离株DNA为模板进行PCR扩增,根据PCR产物的电泳图谱,插入的可转座Ⅰ型内含子片段大小约379 bp。49株白假丝酵母菌经25S rDNAⅠ型内含子基因鉴定分为3型,包括基因A型21株(40.8%)、基因B型14株(28.5%)以及基因C型15株(30.6%),未发现基因D型与基因E型菌株(图2)。PCR分型实验的重复实验结果相同,条带清晰,条带大小差异无统计学意义。
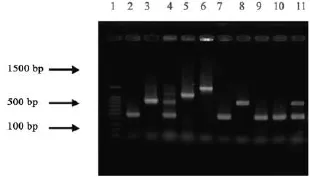
图2 白假丝酵母菌25S rDNAⅠ型内含子序列PCR扩增产物电泳结果
3 讨论
肺结核是一种慢性消耗性疾病,患者病程较长,肺组织及支气管结构均有不同程度的破坏,呼吸系统防御功能降低,易患二重感染,尤其是合并真菌感染。真菌的检测目前主要依靠常规直接镜检或培养。直接镜检操作简便、快速、实用,但检测阳性率较低,阴性结果不能排除感染,需与培养和生化鉴定结合使用,培养时间需2~3 d,耗时较长,检出率低。近年来检测真菌循环抗原(抗体)、特异性酶和代谢产物的血清学方法则存在特异性和敏感性低的缺陷。分子生物学的的出现使得真菌的检测技术得到了很大发展,不仅能检测出活的致病菌,而且能检测出死亡的和难以培养的真菌[3]。
随着真菌学研究的不断深入,许多病原真菌的基因组序列已探明。根据这些已知序列可以选择其保守区域设计具有种、属特异性的引物用于医学真菌的检测。真菌核糖体基因转录间隔区(Internal tran scribed spacer region,ITS)是位于真菌核糖体DNA(rDNA)上18S和28S基因之间的区域片段,该区域进化较快,具有一定的种间特异性和种内保守性,可将假丝酵母菌鉴定到种、亚种[5-6]。本课题结果进一步证实,传统生物学方法能够正确地鉴定绝大多数病原性真菌的菌种,而检测ITS序列则有利于真菌感染的快速诊断和提高真菌鉴定的准确率以及基因型分析与研究。本方法与传统分型方法和其他分子生物学方法相比,具有快速、简捷、可靠的优点。PCR基因分型方法具有快速、简捷、可靠、重复性好等优点。实验从模板DNA提取到PCR扩增后电泳观察结果,共耗时7 h左右,可在一个工作日内完成,比较适合临床真菌菌种内和种间分型研究。本课题应用灵敏特异的PCR分型方法,采用真菌通用引物ITS1、ITS2扩增念珠菌中18、518S rDNA基因的小段片段及其之间的内转录间隔区ITS1,利用其扩增产物片段的大小不同将13种常见真菌鉴定出来。99株真菌的ITS序列鉴定结果及其与生物学鉴定的关系:酵母菌78株,符合率为72.4%;霉菌21株,符合率为85.7%;总符合率为84.8%。白假丝酵母菌在25S rDNA编码区内存在一可转座Ⅰ型内含子核苷酸序列,根据内含子缺失以及形成的片段大小,可将白假丝酵母菌分为A、B、C、D、E五个基因型[7]。国内学者郭新美等[8]报道,在74例肺结核继发真菌感染病例中以假丝菌居多,其中白假丝菌为主,占70.3%;光滑假丝菌占12.2%;热带假丝菌占6.8%;另外还有少数隐球菌、曲霉菌、毛霉菌。陈素丽等[9]报道也是以假丝菌属居多,其中白假丝菌占51.5%,光滑假丝菌占19.9%,热带假丝菌占11.8%,曲霉菌占8.1%,毛霉菌占1.5%。本研究结果显示检出99株真菌中以白假丝酵母菌为主。49株白假丝酵母菌经25S rDNAⅠ型内含子基因鉴定分为3型,包括基因A型21株(40.8%)、基因B型14株(28.5%)以及基因C型15株(30.6%),未发现基因D型与基因E型菌株。基因A型、B型和C型是常见的病原性白假丝酵母菌,其中以基因A型的检出率最高。提示花都区肺结核合并真菌患者的病原性白假丝酵母菌也同样以基因A型、B型和C型常见,但基因A型占明显多数。本研究探讨花都区肺结核患者合并真菌感染情况以及病原性真菌常见种类、分布及基因型,实验证明检测ITS序列和25S rDNAⅠ型内含子序列有助于真菌感染的快速基因诊断和提高菌种鉴定的准确率。用于控制医院内感染和预防肺结核患者合并真菌感染,对肺结核合并真菌感染患者的治疗和预防具有重要的临床意义。
[1]胡 华,林美英,鞠云飞.老年肺结核合并肺部真菌感染的临床及药敏研究[J].临床肺科杂志,2006,11(5):154-156.
[2]叶应妩,王毓三,申子瑜.全国临床检验操作规程[M].南京:东南大学出版社,2006:744-745,871-885.
[3]Corrêa Pdos R,David PR,Peres NP,et al.Phenotypic characterization of yeasts isolated from the vaginal mucosa of adult women[J].Rev Bras Ginecol Obstet,2009,31(4):177-181.
[4]周曾同,赵 民,张 济,等.口腔白色念珠菌的PCR ITS12ITS2基因分型法的建立及应用[J].实用口腔医学杂志,2006,22(1):60-63.
[5]高 飞,陈德利,沈亮亮,等.随机分离致病性白假丝酵母菌17例的基因分型[J].同济大学学报(医学版),2004,25(3):678-680.
[6]李劲松,宋诗铎,祁 伟.深部白假丝酵母菌感染临床分离株基因分型及药敏分析[J].中国抗生素杂志,2004,29(7):426-429.
[7]李艳华,冯福民,郭 梅.恶性肿瘤患者念珠菌感染临床分离株的基因型特征研究[J].中国老年学杂志,2007,27(18):345-356.
[8]郭新美,荣学东,马秀丽.74例肺结核继发肺部真菌感染情况分析[J].中国防痨杂志,2005,27(6):380-382.
[9]陈素丽,李幸彬,李卫红.肺结核合并肺部真菌感染136例临床分析[J].临床荟萃,2006,21(18):1323-1324.
