国内外口服美洛昔康的溶出度对比研究
2011-06-18张艳华
张艳华
美洛昔康(Meloxicam)是一种新型烯醇酸类非甾体抗炎剂[1],结构与吡罗昔康、替诺昔康相似,具有良好的消炎、镇痛和解热作用。其胃肠道和肾脏不良反应较同类品种低,临床上广泛用于类风湿性关节炎(RA)、骨关节炎(OA)等疾病的治疗,许多国家甚至已将本品作为其他非甾体抗炎药的替代药物。我国约有37个生产美洛昔康制剂的厂家,涉及57个美洛昔康系列品种的批准文号,且产品工艺不尽相同,产品质量也未能得到深度评价。本文通过紫外-可见分光光度法,测定国内外美洛昔康制剂的溶出度,进而评价该药物的生物利用度,结果表明,该方法简便可靠,便于在医院开展药物的生物利用度考察[2]。
1 材料与方法
1.1 仪器、试剂和试药 仪器:RCZ-8M智能溶出测定仪(天津天大天发);Cary-100紫外可见分光光度计;CPA225D分析天平。试剂:磷酸二氢钾、氢氧化钠均为分析纯。水为纯化水。美洛昔康标准对照品(中国药品生物制品检定所,批号:100679-200401,含量:100%),美洛昔康制剂(见表1)。参比制剂:莫比可(美洛昔康片,上海勃林格殷格翰药业有限公司,规格:7.5 mg,批号:084078、084082)。
1.2 溶出度条件[3-4]方法:《中国药典》(2010年版)溶出度第一法;溶剂:磷酸盐缓冲液(pH 7.4),温度:37 ℃,转速:75、100 r/min。
2 方法与结果
2.1 紫外光谱条件 取标准曲线项下的对照品溶液,在200~500 nm波长范围内进行紫外光谱扫描,在362 nm波长处有最大吸收,故选择362 nm作为测定波长。称量各制剂生产厂家的空白辅料6.0 mg,用适量0.1mol/L氢氧化钠溶液溶解,再加磷酸盐缓冲液(pH 7.4)定容至50mL量瓶中。将上述溶液在200~500 nm波长范围内进行紫外光谱扫描。结果表明,各厂家辅料在362 nm波长处无吸收峰,不干扰测定。
2.2 标准曲线 精密称取美洛昔康对照品10.82 mg,用适量0.1mol/L氢氧化钠溶液溶解,再加磷酸盐缓冲液(pH 7.4)定容至100mL量瓶中制成储备液,待用。分别量取 0.5、1.0、2.0、3.0、4.0、5.0、6.0、7.0mL 储备液,用磷酸盐缓冲液(pH 7.4)定容至50mL量瓶。将上述各测试液置于362 nm波长处,测量紫外吸光度。结果表明,美洛昔康标准曲线方程:A=51.07826 C-0.00032,r=0.99998。线性范围:0.0541~0.7574 mg/mL。
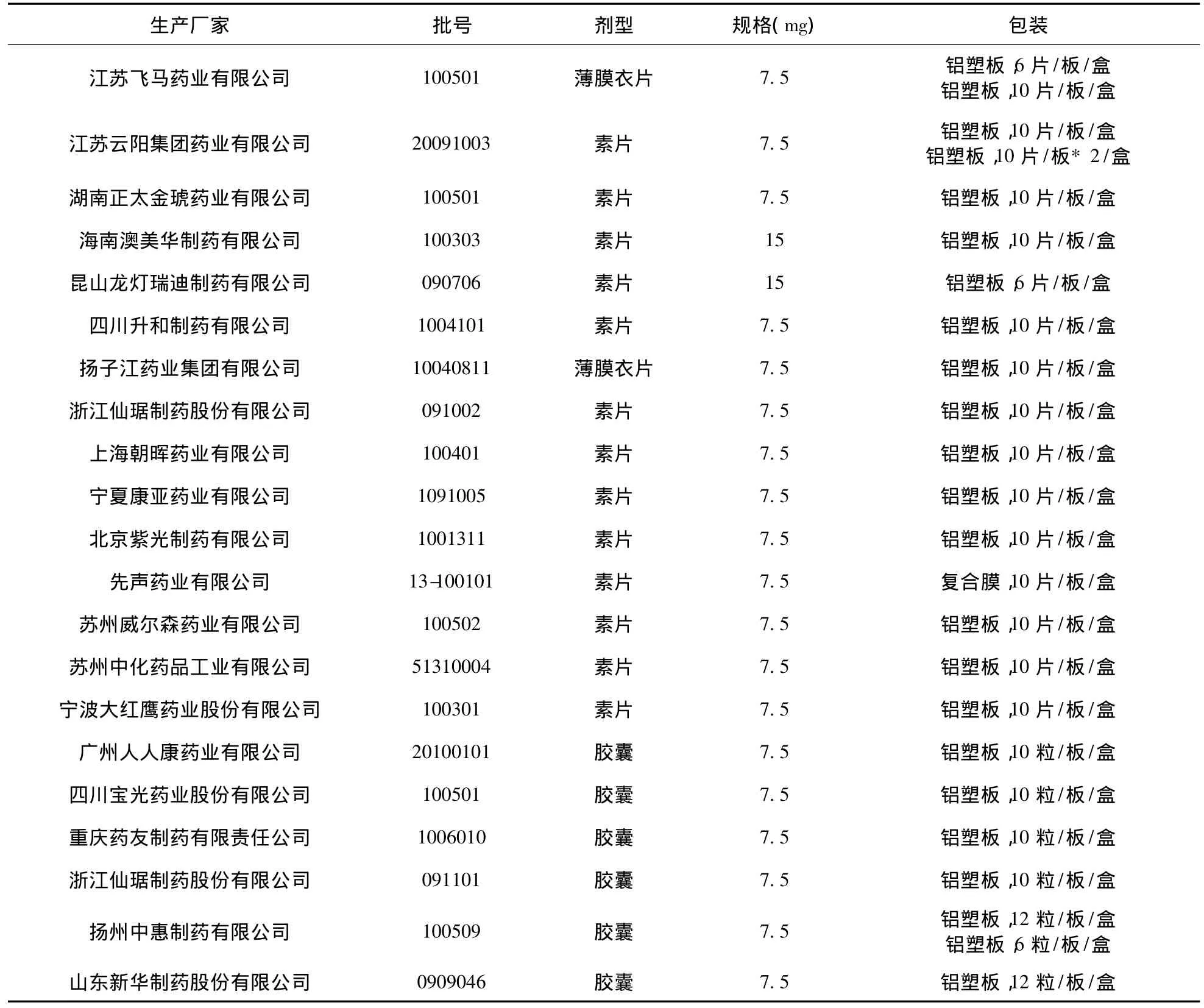
表1 国产美洛昔康制剂生产厂家及样品信息
2.3 稳定性试验 称取美洛昔康对照品10.12 mg,加适量0.1mol/L氢氧化钠溶液溶解,再加磷酸盐缓冲液(pH 7.4)溶解稀释至100mL容量瓶中,室温下放置 1、3、5、12、24 h,测得吸光度分别为 0.506、0.509、0.510、0.512、0.511,表明美洛昔康溶液在室温下24 h内稳定。
2.4 加样回收率试验 称取空白辅料6.0 mg 9份,每3份精密加上述美洛昔康对照品储备液1.0、2.0、3.0mL,分别置 50mL 量瓶中,加适量0.1mol/L氢氧化钠溶液溶解,再加磷酸盐缓冲液(pH 7.4)溶解稀释至刻度,摇匀,滤过。取续滤液,于362 nm处测定吸光度(n=9)。见表2。
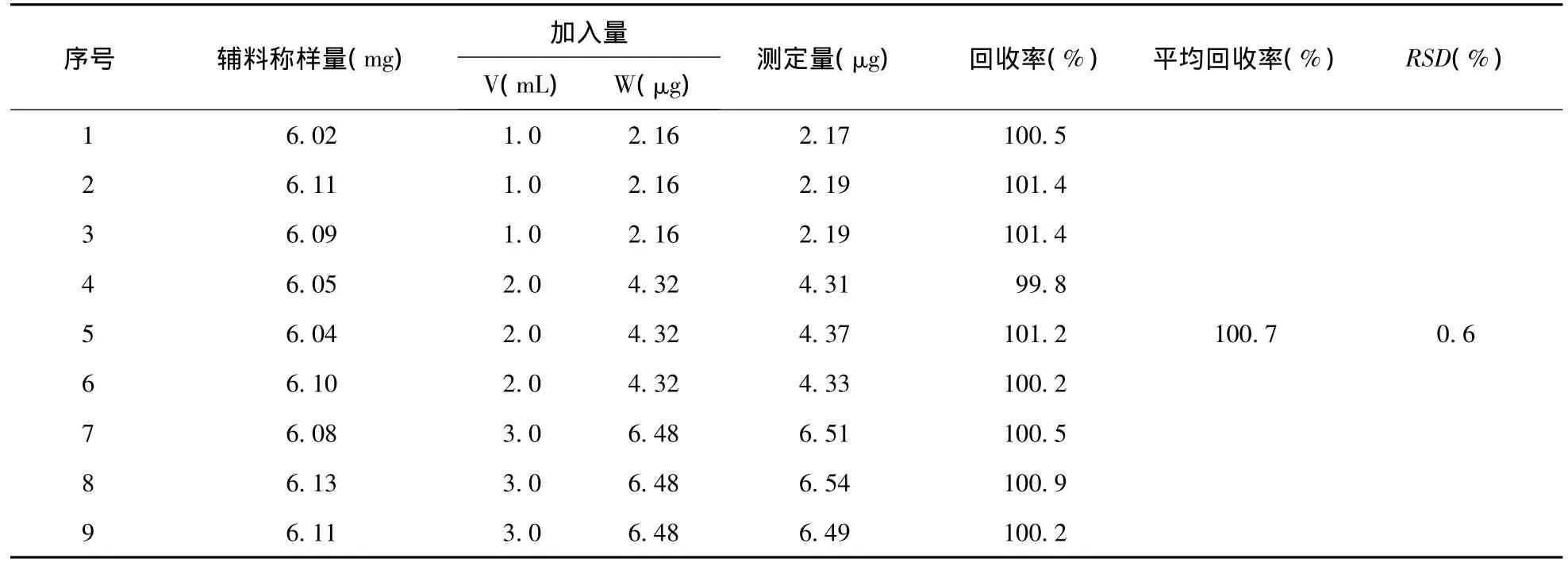
表2 加样回收率结果
2.5 样品溶出度试验 应用《中国药典》(2010年版)溶出度第一法。胶囊剂和片剂两种制剂均以900mL磷酸盐缓冲液(pH 7.4)为溶剂,转速分别为75、100 r/min,取样时间为5、10、15、30、45、60min。将各时间点的续滤液分别置于362 nm波长处,测定紫外吸光度。图1~图3为片剂、胶囊剂和参比制剂的时间-溶出率曲线图。
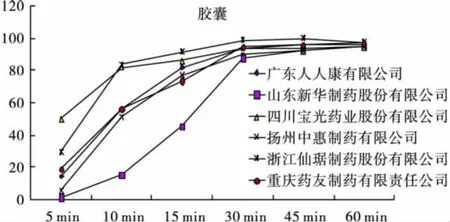
图1 国产胶囊剂溶出曲线
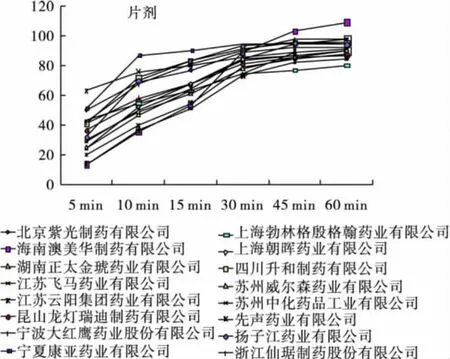
图2 国产片剂溶出曲线
根据对多个厂家溶出曲线的测定以及与参比制剂的比较可知,进口莫比在5min能达到50%的溶出量,30min能达到75%的溶出限度,溶出快速均匀。国产胶囊剂和片剂虽均能在45min达到75%的溶出限度,但是国产制剂溶出速率不均匀,5min溶出量参差不齐。

图3 进口制剂溶出曲线
3 讨论
本文采用的紫外-可见分光光度法测定美洛昔康制剂的溶出度,方法简单,操作方便,辅料对测量结果无干扰,同时,本实验方法便于在基层开展,符合《中国药典》(2010年版)的要求。
本文采用溶出度的方法,考察国产美洛昔康制剂的生物利用度,方法可靠直观,结果表明,目前国内生产的制剂能够满足现行质量标准的要求,但是在释放速度方面与进口制剂有一定差距。
美洛昔康的半衰期较长,平均半衰期可达20 h,因此,要求药物释放应该均匀缓慢,以保证体内有效药物浓度。建议应进一步研究药物的生物利用度,制定更科学的溶出度限度,以便药物能够在体内发挥更好的效果[5]。
[1]王平,顾振纶.新型非甾体抗炎药-美洛昔康[J].中国新药与临床杂志,2000,19(6):499-501.
[2]Larid JMA,Herrero JF,Garcia P,et al.Analgesic activity of the novel COX-2 prefrring NSAID,meloxicam in mono-arthritic rats:central and peripheral components[J].Inflamm Res,1997,46(6):203.
[3]药典委员会.中国药典[S].二部.北京:中国医药科技出版社,2010.
[4]孙健,李铜铃,王志霄,等.美洛昔康胶囊溶出度的测定[J].华西药学杂志,2004,19(3):225-227.
[5]苗佳,黄英,梁德荣,等.国产美洛昔康片相对生物利用度研究[J].中国临床药理学杂志,2001,17(2):139-142.
