氮素对不同氮效率小黑麦基因型叶片保护酶活性和膜脂过氧化的影响
2011-06-08匡艺李廷轩余海英
匡艺,李廷轩,余海英
(1.四川农业大学资源环境学院,四川 雅安625014;2.四川威远县环境监测站,四川 威远642450)
叶片是植物进行光合作用的主要器官,作物全株光合产物的90%~95%来自光合作用,光合时间的长短主要取决于叶片衰老的进程。自20世纪70年代,自由基伤害假说引入作物衰老研究以来活性氧自由基与作物衰老关系的研究成为学者关注的焦点[1]。研究表明,当作物受到外界环境胁迫时,其清除活性氧自由基系统中的超氧化物歧化酶(superxoide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)会迅速启动,来共同抵抗外界胁迫带来的危害[2]。而活性氧毒害引发细胞膜脂过氧化产生的丙二醛(malondialdehyde,MDA),其含量的高低亦可反应细胞膜脂过氧化程度和植物对逆境胁迫反应的强弱[3]。氮是作物所需最多的营养元素,其在作物的保护酶代谢中起着重要作用。作物抗性生理的有关研究表明,细胞中SOD、POD、CAT活性和MDA含量变化因供氮量、作物品种、生育期不同而有很大的差异。据刘连涛等[4]报道,氮素缺乏会引起棉花(Gossypiumhirsutum)丙二醛含量升高,加速叶片的衰老。魏海燕等[1]对不同氮利用效率水稻(Oryzasativa)的研究表明,齐穗后的不同时期,氮高效水稻基因型的SOD、POD和CAT活性均显著高于氮低效基因型,而MDA的含量显著低于氮低效基因型。饲草作为畜牧业生产的物质基础,其产量的高低对作物-家畜综合系统的生产力产生重要影响。当前,施用氮肥是增加饲草[5,6]与种子[7]产量、提高经济效益[8]、促进养分吸收[9]、改善品质[10]的主要手段。然而随着施氮量的增加,产投比下降,这在降低氮肥利用效率,带来资源浪费的同时,也导致了水体富营养化等一系列环境问题。已有的研究表明,作物在吸收利用氮素方面普遍存在着基因型差异[13-15],这使得挖掘作物自身吸收利用氮素的潜力,成为提高农田氮肥利用率、减少氮素损失的有效途径[16]。小黑麦(Triticosecale)作为禾本科牧草中的优良种,在我国饲草中占有重要的地位[17]。目前针对小黑麦的研究多集中于品质[18]、高产评价[19]、水盐胁迫[20,21]等方面,对于氮素供应对不同氮效率小黑麦基因型叶片保护酶活性和膜脂过氧化随生育期变化的研究鲜见报道。因此,本研究拟通过研究供氮水平对不同氮效率小黑麦基因型在苗期、分蘖期、拔节期和最佳刈割时期-抽穗期[22]时叶片保护酶活性和膜脂过氧化的影响,以及它们与地上部生物量的相关性,以期揭示不同氮效率小黑麦基因型对氮肥利用差异的可能原因及机理。
1 材料与方法
1.1 供试材料
依据2008-2009年的研究分类与评价,选取2个具有不同氮利用效率特征的小黑麦基因型为材料,分别为氮低效利用基因型(CIxt74),氮高效利用基因型(PI429186)。盆栽用土为青衣江河流冲积物发育而来的潮土,采自四川省雅安市雨城区大兴镇。其基本理化性质为:有机质9.07g/kg、全氮0.36g/kg、碱解氮25.74mg/kg、速效磷9.45mg/kg、速效钾36.32mg/kg,pH 6.12。所用尿素含N 46.70%,磷酸二氢钾含P2O552.17%、含K2O 34.53%,硫酸钾含K2O 53.94%;其中尿素为市场购买,磷酸二氢钾和硫酸钾为分析纯试剂。
1.2 试验处理
于2009-2010年在四川农业大学教学科研园有防雨设施的网室进行盆栽试验,试验所用盆体上口径27 cm,下口径20cm,高23cm,每盆装土15kg。据报道[23],150.00kg N/hm2为小黑麦的最佳施氮量,故氮素处理设0g N/盆(N0)、0.25g N/盆(N1)、0.50g N/盆(N2)、1.00g N/盆(N3)4个水平,分别相当于0,37.50,75.00和150.00kg N/hm2。所有处理的磷、钾肥用量一致,按P2O50.60g/盆、K2O 0.50g/盆施入。试验共8个处理,每个处理重复20次,完全随机排列。其中60%氮肥和所有磷钾肥配制成溶液在播种前5d与土壤充分混匀,其余40%氮肥作为追肥在拔节期施用。播种前选取饱满的种子,用50%多菌灵消毒后堆闷6h。2009年11月25日播种,每盆播10粒种子,及时补种,于2009年12月29日,定苗为8株。全生育期进行病虫害防治并适时灌溉,采用自然光照。
1.3 测定内容与方法
在小黑麦的苗期(出苗后47d)、分蘖期(出苗后82d)、拔节期(出苗后102d)和抽穗期(出苗后140d)进行采样,每次采样每个处理取4次重复。采样时将盆栽土壤和植株倾盆倒出,以免破坏植株完整根系。采收后,先用自来水洗净叶片表面灰尘和污物,然后用蒸馏水润洗,再用吸水纸将叶片附着的水分吸干。取同一盆中4株小黑麦用于叶片和根系生理测定,其余4株用于植物含氮量和根系形态的测定。将用于测定叶片生理的样品剪碎、混匀,液氮速冻后存于-80℃超低温冰箱中用于保护酶活性与膜脂过氧化产物的分析。用氮蓝四唑(NBT)法测定SOD活性[24];愈创木酚法测定POD活性[25];过氧化氢法测定CAT活性[26];硫代巴比妥酸(TBA)法测定 MDA含量[24]。将样品根系和地上部剪断分开,于烘箱中105℃杀青30min,将温度调至75℃烘干至恒重,然后测定其干重。土壤基本理化性质采用常规分析方法[27]。
1.4 统计分析
采用Excel 2003、唐启义和冯明光[28]的DPS数据处理系统进行统计分析。
2 结果与分析
2.1 氮素对不同氮效率小黑麦基因型生物量的影响
各生育期小黑麦地上部生物量存在显著的基因型差异(表1)。氮高效小黑麦基因型在同一生育期的同一供氮条件下,其地上部生物量显著高于氮低效基因型。就各生育期而言,氮高效基因型在苗期各供氮条件下,其地上部生物量为氮低效基因型的1.12,1.93,1.64和1.67倍;分蘖期为氮低效基因型的1.18,1.02,1.27和1.30倍;拔节期时为氮低效基因型的1.26,1.22,1.16和1.37倍;到最佳刈割时期-抽穗期为氮低效基因型的1.15,1.09,1.16和1.21倍。针对同一小黑麦基因型,除苗期供试小黑麦基因型地上部生物量随供氮量的增加其增产效果不明显外,其余各生育期地上部生物量随供氮量的增加而增大。在分蘖期、拔节期、抽穗期时,氮高效小黑麦基因型在正常供氮条件下,其地上部生物量分别比不施氮条件增产84.49%,40.49%和40.43%;对氮低效基因型而言,其地上部生物量分别比不施氮条件下增产66.87%,29.64%和33.15%。这表明,在正常供氮条件,氮高效基因型随供氮量增加的增产效果大于氮低效基因型。

表1 氮素对不同氮效率小黑麦基因型地上部生物量的影响Table 1 Effects of nitrogen on biomass of shoot in triticale genotypes with different N use efficiency g/株 Plant
2.2 氮素对不同氮效率小黑麦基因型叶片保护酶活性的影响
2.2.1 氮素对不同氮效率小黑麦基因型叶片SOD活性的影响 SOD是植物体内清除活性氧自由基的关键酶,能催化生物体内分子氧活化的第一中间产物——超氧自由基(O2·-)发生歧化反应,生成O2和H2O2,其活性大小是植株衰老和抗性的良好指标。各生育期小黑麦SOD活性存在显著的基因型差异(表2),氮高效小黑麦基因型在同一生育期的同一供氮条件下,SOD活性显著高于氮低效基因型。就各生育期而言,氮高效基因型在各供氮条件下,其苗期SOD活性为氮低效基因型的1.08,1.03,1.18和1.31倍;分蘖期为氮低效基因型的1.13,1.07,1.34和1.17倍;拔节期为氮低效基因型的1.20,1.25,1.19和1.10倍;到最佳刈割时期——抽穗期为氮低效基因型的1.11,1.12,1.29和1.19倍。针对同一生育期同一小黑麦基因型,其SOD活性随供氮量的增加而增强,且其活性在N2和N3条件下达到较强值。正常供氮条件下,小黑麦氮高效基因型在苗期、分蘖期、拔节期和抽穗期时其SOD活性分别比不施氮条件下提高了26.43%,6.27%,23.04%和21.14%;而氮低效基因型,其SOD活性分别比不施氮条件下提高了4.34%,2.38%,34.41%和13.29%。这表明,在正常供氮条件下,氮高效基因型的SOD活性增强的能力强于氮低效基因型。2.2.2 氮素对不同氮效率小黑麦基因型叶片POD活性的影响 POD是细胞防御活性氧毒害酶系统的成员之一,能催化H2O2氧化其他底物以清除H2O2。各生育期小黑麦POD活性存在显著的基因型差异(表3),并呈先下降后上升的趋势。除苗期和分蘖期,氮高效小黑麦基因型在同一生育期的同一供氮条件下,POD活性基本表现出显著高于氮低效基因型。就各生育期而言,氮高效基因型在各供氮条件下,在苗期时SOD活性为氮低效基因型的1.02,0.78,0.76和0.72倍;分蘖期为氮低效基因型的0.91,1.26,0.96和0.83倍;拔节期时为氮低效基因型的0.95,1.04,1.23和0.99倍;到最佳刈割时期——抽穗期为氮低效基因型的1.11,1.06,1.25和1.10倍。针对同一生育期同一小黑麦基因型,其SOD活性随供氮量的提高,规律性不明显。正常供氮条件下,分蘖期和抽穗期时,小黑麦氮高效基因型SOD活性分别比不施氮条件下提高了4.94%和7.07%,在苗期和拔节期时下降了12.41%和0.15%;而对氮低效基因型而言,其SOD活性在苗期、分蘖期和抽穗期时分别比不施氮条件下提高了24.07%,16.20%和8.31%,在拔节期时下降了4.04%。这表明在不同生育期,供氮对POD活性的影响不一致。
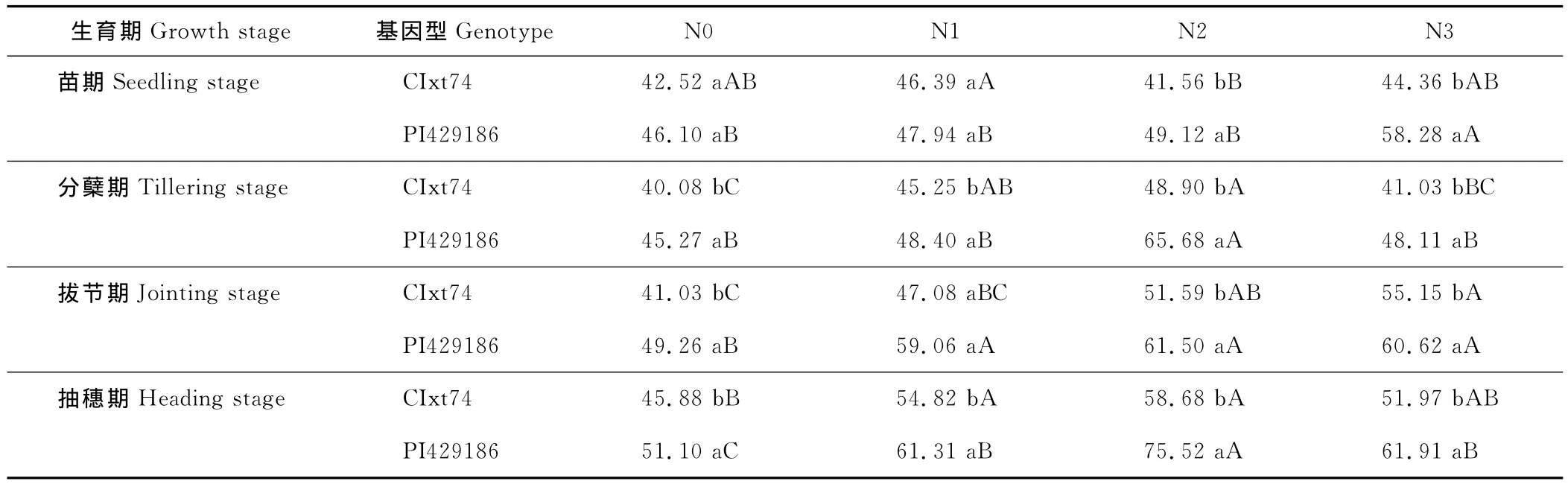
表2 氮素对不同氮效率小黑麦基因型叶片SOD活性的影响Table 2 Effects of nitrogen on SOD activity of leaf in triticale genotypes with different N use efficiency U/g FW

表3 氮素对不同氮效率小黑麦基因型叶片POD活性的影响Table 3 Effects of nitrogen on POD activity of leaf in triticale genotypes with different N use efficiency △OD470/(g FW·min)
2.2.3 氮素对不同氮效率小黑麦基因型叶片CAT活性的影响 CAT能够催化H2O2分解为H2O与O2,使得H2O2不至于与O2在铁螯合作用下反应生成非常有害的·OH,是植物体内主要的保护酶之一。各生育期小黑麦CAT活性存在显著的基因型差异(表4),氮高效小黑麦基因型在同一生育期的同一供氮条件下,CAT活性基本表现出显著高于氮低效基因型。就各生育期而言,氮高效基因型在各供氮条件下,在苗期时SOD活性为氮低效基因型的1.71,2.09,1.60和2.10倍;分蘖期为氮低效基因型的1.46,2.25,2.11和1.71倍;拔节期时为氮低效基因型的1.04,1.85,1.38和1.48倍;到最佳刈割时期——抽穗期为氮低效基因型的1.44,1.54,1.45和2.08倍。针对同一小黑麦基因型,CAT活性在苗期随供氮量的增加先下降后上降,而在分蘖期和抽穗期时其活性随供氮量的增加而加强,在拔节期时,则为先上升后下降。正常供氮条件下,小黑麦氮高效基因型在分蘖期、拔节期和抽穗期时其CAT活性分别比不施氮条件下提高了126.07%,80.48%和247.37%,在苗期时下降了17.76%;而氮低效基因型,其CAT活性分别比不施氮条件下提高了92.67%,26.70%和96.78%,苗期时下降了33.81%。这表明虽然在苗期,氮高效基因型的CAT活性在正常供氮条件下,其活性较不供氮下降,但是其降幅较氮低效基因型低,而在分蘖期、拔节期和抽穗期时,其活性较低效基因型提高明显。
2.3 氮素对不同氮效率小黑麦基因型叶片MDA含量的影响
MDA是植物在逆境和衰老过程中膜脂过氧化作用的产物,其含量常用来衡量膜脂过氧化的程度。小黑麦MDA随着生育期,其含量逐渐增加。同一生育期同一供氮条件下,氮高效小黑麦基因型叶片中MDA含量低于或显著低于氮低效基因型(表5)。就各生育期而言,氮高效基因型在各供氮条件下,在苗期时,MDA含量较氮低效基因型降低了1.03%,9.52%,35.20%和33.86%;分蘖期除N2供氮条件下,氮高效基因型MDA含量高于氮低效基因型外,其余各供氮条件较氮低效基因型分别降低了17.50%,8.75%和72.41%;拔节期时较氮低效基因型降低了18.49%,23.75%,19.48%和15.89%;到最佳刈割时期——抽穗期较氮低效基因型降低了33.35%,14.99%,24.22%和23.57%。针对同一生育期同一小黑麦基因型,其MDA含量随供氮水平的升高而降低。正常供氮条件下,小黑麦氮高效基因型在苗期、分蘖期、拔节期和抽穗期时其MDA含量分别比不施氮条件下降了63.54%,79.41%,43.96%和39.54%;而氮低效基因型,其 MDA 含量分别比不施氮条件下降了45.44%,38.42%,45.70%和30.98%。这表明,在氮高效基因型膜脂过氧化程度较氮低效基因型低,在逆境胁迫下细胞受伤害较小。
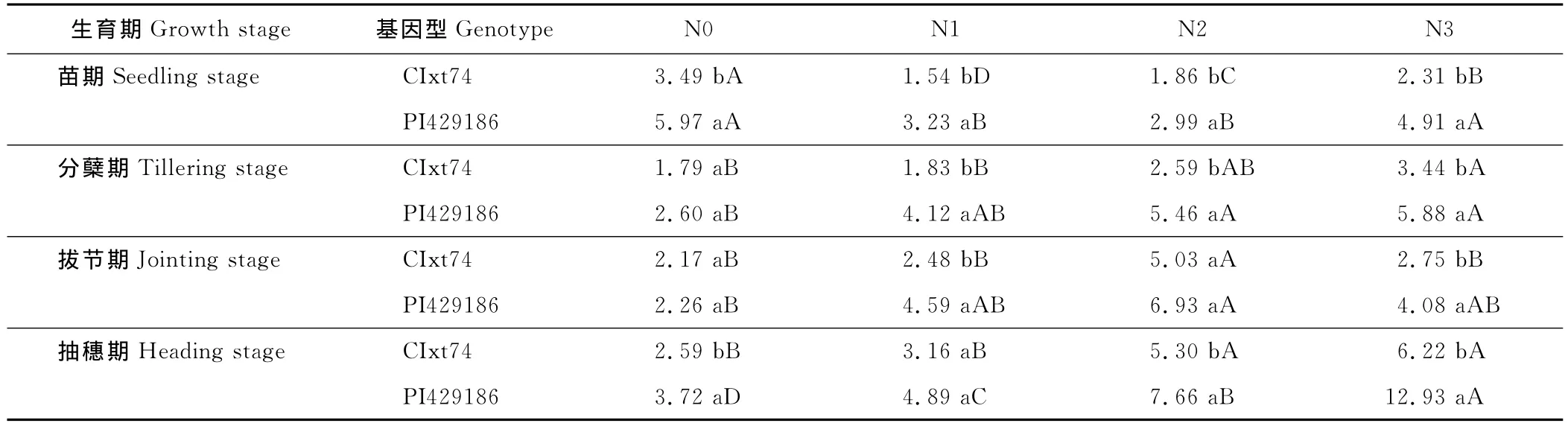
表4 氮素对不同氮效率小黑麦基因型叶片CAT活性的影响Table 4 Effects of nitrogen on CAT activity of leaf in triticale genotypes with different N use efficiency U/(g FW·min)

表5 氮素对不同氮效率小黑麦基因型叶片MDA含量的影响Table 5 Effects of nitrogen on MDA content of leaf in triticale genotypes with different N use efficiency μmol/mg FW
2.4 小黑麦叶片保护酶活性、膜脂过氧化与生物量的相互关系
小黑麦保护酶活性及膜脂过氧化产物MDA含量不仅存在显著的基因型差异,同时与小黑麦地上部生物量有着密切的相互关系。小黑麦地上部生物量与叶片中SOD、POD、CAT活性存在的相关性因生育期不同,而有不同的体现(表6)。在苗期,POD活性与地上部生物量呈极显著的负相关关系;分蘖期时,CAT活性与地上部生物量呈极显著正相关关系,到了拔节期时其叶片中SOD和CAT活性与地上部生物量达显著和极显著正相关关系,而到抽穗期时,CAT活性与地上部生物量呈极显著正相关关系。除苗期外,MDA含量与地上部生物量呈显著或极显著负相关关系。由此表明,小黑麦保护性酶系统中的SOD、POD和CAT是一个清除活性氧自由基的体系,清除活性氧自由基是其共同作用的结果,其清除能力也因生育时期不同各异。由于氮高效基因型SOD、POD、CAT在各生育期具有较高的活性,更能及时清除活性氧自由基,有效的阻止高浓度氧的积累和膜脂过氧化,降低叶片受损伤程度,提高其光合性能。因此,使其生产出更多的光合产物,增进物质积累,从而利于其提高氮素利用效率。
3 讨论
在植物体内存在SOD、POD、CAT等一系列保护酶,它们能够在逆境胁迫中维持活性氧的代谢平衡并保护细胞膜结构,协同抵御不良环境的胁迫,保证植物正常生长。MDA作为细胞膜脂过氧化产物之一,其含量的多少反应细胞受损的程度。因而,通常情况下将抗氧化酶活性和MDA含量视为作物在忍受逆境胁迫的生理指标[29]。已有的研究表明[2],作物叶片中抗氧化酶系统存在品种差异,且其活性高低受到生育期的影响。本试验条件下,不同氮利用效率小黑麦基因型的保护酶活性存在显著的基因型差异。除苗期POD活性外,氮高效小黑麦基因型叶片中SOD、POD、CAT活性在各生育期的同一供氮条件下显著高于氮低效基因型。同时,其活性随供氮量增加的幅度大于氮低效基因型。与保护酶活性相反,氮高效小黑麦基因型叶片膜脂过氧化产物MDA含量在同一生育期同一供氮条件下显著低于氮低效基因型。针对同一生育时期而言,氮高效小黑麦基因型随供氮量的增加,其细胞受损害的程度较氮低效基因型明显降低。由此说明,与氮低效基因型相比,氮高效小黑麦基因型叶片中活性氧清除酶系统能及时清除活性氧自由基,有效的阻止高浓度氧的积累和膜脂过氧化作用,从而降低叶片的损伤程度,这与相关学者对水稻的研究结果一致[1]。正常情况下,细胞自由基活性氧的产生和清除处于动态平衡状态,这些产物的浓度很低不会引起伤害[2]。但是当出现胁迫状况时,这一动态平衡就受到破坏,此时,作物就会启动相应的抗氧化系统来阻止细胞膜脂过氧化,减弱其受损程度。本研究表明,SOD、POD、CAT活性均能对地上部生物量产生影响,但其作用大小受生育时期的影响。表现为,SOD活性大小在拔节期时,与地上部生物量呈极显著正相关关系;POD活性大小在苗期时与地上部生物量呈极显著负相关关系,CAT则在分蘖期、拔节期和抽穗期时与地上部生物量呈显著或极显著正相关关系。由于苗期时,氮高效基因型地上部生物量在各供氮条件下大于氮低效基因型,说明氮高效小黑麦基因型在苗期时,其抵抗外界胁迫的能力较强,叶片受损程度相对较小,所以其POD活性可能就没有达到较强值,用于保护其可能受到的损伤。而对于氮低效小黑麦基因型,由于其对氮素吸收和利用的能力较弱,故在苗期时,就表现出细胞受到损害的情况,故其清除活性氧自由基的POD酶启动,表现出其活性显著高于氮高效基因型。因此,这时表现出POD活性在苗期时与地上部生物量呈显著负相关关系。随着小黑麦的生长,表现出SOD、POD、CAT协同作用,共同清除活性氧自由基,从而降低MDA含量,达到保护叶片生理功能,提高产量的作用。

表6 小黑麦叶片保护酶活性、膜脂过氧化与生物量的相互关系Table 6 Relationships between biomass of shoot and protective enzyme activities,lipid peroxidation of leaf in Triticale genotypes
4 结论
氮高效小黑麦基因型(PI429186)在各生育期的同一供氮条件下,其地上部生物量显著高于氮低效小黑麦基因型(CIxt74)。在同一生育期,小黑麦地上部生物量随供氮水平的增加而增大,氮高效基因型在正常供氮条件下,其生物量在分蘖期、拔节期和抽穗期分别较不施氮条件下增加了84.49%,40.49%和40.43%;而氮低效基因型增加了66.87%,29.64%和33.15%,其增产效果小于氮高效基因型。除苗期POD活性在各条件下氮高效小黑麦基因型低于氮低效小黑麦基因型,氮高效基因型小黑麦的SOD、POD、CAT活性在各生育期的同一供氮条件下,其保护酶活性高于氮低效小黑麦基因型,而MDA含量显著低于氮低效小黑麦基因型。相关分析表明,小黑麦地上部生物量与SOD、POD、CAT活性的相关性因生育期不同其相关性不一。SOD活性在拔节期时与地上部生物量呈极显著正相关,POD活性在苗期时与地上部生物量呈极显著负相关,CAT则在分蘖期、拔节期和抽穗期时与地上部生物量呈显著或极显著正相关;而与MDA含量在分蘖期、拔节期和抽穗期时呈显著或极显著负相关。
[1]魏海燕,张洪程,马群,等.不同氮肥吸收利用效率水稻基因型叶片衰老特性[J].作物学报,2010,36(4):645-654.
[2]张立新,李生秀.氮、钾、甜菜碱对水分胁迫下夏玉米叶片膜脂过氧化和保护酶活性的影响[J].作物学报,2007,33(3):482-490.
[3]刘瑞显,郭文琦,陈兵林,等.氮素对花铃期干旱及复水后棉花叶片保护酶活性和内源激素含量的影响[J].作物学报,2008,34(9):1598-1607.
[4]刘连涛,李存东,孙红春,等.氮素营养水平对棉花不同部位叶片衰老的生理效应[J].植物营养与肥料学报,2007,13(5):910-914.
[5]张晓艳,刘锋,王风云,等.墨西哥玉米留茬中糖组分含量对氮素的响应[J].草业学报,2009,18(1):184-187.
[6]何丹,李向林,万里强,等.施用尿素对当年退化天然草地物种地上部生物量和重要值的影响[J].草业学报,2009,18(3):154-158.
[7]谢国平,呼天明,王佺珍,等.施N量和收获时间对西藏野生垂穗披碱草种子产量影响研究[J].草业学报,2010,19(2):89-96.
[8]李志坚,祝廷成,秦明.不同施肥水平与组合对饲用黑麦经济效益的影响及施肥决策[J].草业学报,2009,18(3):148-153.
[9]李文西,鲁剑巍,杨娟.苏丹草-黑麦草轮作制中施肥对饲草产量及养分吸收的影响[J].草业学报,2009,18(3):165-170.
[10]黄勤楼,钟珍梅,陈恩,等.施氮水平与方式对黑麦草生物学特性和硝酸盐含量的影响[J].草业学报,2010,19(1):103-112.
[11]Zhu J H,Li X L,Christie P,etal.Environmental implications of low nitrogen use efficiency in excessively fertilized hot pepper(CapsicumfrutescensL.)cropping systems[J].Agriculture,Ecosystems and Environment,2005,111:70-80.
[12]Semenov M A,Jamieson P D,Martre P.Deconvoluting nitrogen use efficiency in wheat:A simulation study[J].European Journal of Agronomy,2007,26:283-294.
[13]陆大雷,刘小兵,赵久然,等.甜玉米氮素吸收利用的基因型差异[J].植物营养与肥料学报,2008,14(2):258-263.
[14]Haefele S M,Jabbar S M A,Siopongco J D L C,etal.Nitrogen use efficiency in selected rice(OryzasativaL.)genotypes under different water regimes and nitrogen levels[J].Field Crops Research,2008,107:137-146.
[15]Sineboa W,Gretzmacher R,Edelbauer A.Genotypic variation for nitrogen use efficiency in Ethiopian barley[J].Field Crops Research,2004,85:43-60.
[16]陈范骏,春亮,鲍娟,等.不同氮效率玉米杂交种的营养生长及光合特征[J].玉米科学,2006,14(6):127-130.
[17]李焰焰,聂传朋,董召荣.优质饲草小黑麦的品种特性及研究现状[J].安徽农业科学,2005,33(6):1093-1094,1106.
[18]王瑞清,闫志顺,李诚,等.小黑麦种子外观品质性状的遗传研究[J].麦类作物学报,2007,27(1):41-44.
[19]李春艳,李诚,孔广超,等.春性饲用小黑麦高产优质特性的综合评价[J].麦类作物学报,2007,27(1):146-148.
[20]朱俊刚,王曙光,李晓燕,等.PEG胁迫对六倍体小黑麦幼苗SOD,POD活性及MDA含量的影响[J].中国农学通报,2009,25(18):202-204.
[21]李焰焰,董召荣,聂传朋,等.盐胁迫下水杨酸及其衍生物对小黑麦幼苗生理特性的影响[J].生物学杂志,2005,22(3):11-12,32.
[22]贾慎修.中国饲用植物志(第1卷)[M].北京:农业出版社,1987:309-313.
[23]李晶,祖伟,吉彪,等.氮用量对小黑麦东农96026群体生长及饲用品质的影响[J].中国家学通报,2009,25(7):141-144.
[24]中科院上海植物生理研究所,上海市植物生理学会.现代植物生理学实验指南[M].北京:科学出版社,2004:305-306,314-315.
[25]张志良,瞿伟菁.植物生理学实验指导(第三版)[M].北京:高等教育出版社,2003:123-124.
[26]施特尔马赫.酶的测定方法[M].钱嘉渊,译.北京:中国轻工业出版社,1992:197-198.
[27]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,1999:13,106-195.
[28]唐启义,冯明光.实用统计分析及其DPS数据处理系统[M].北京:北京科学出版社,2002.
[29]张英鹏,林咸永,章永松.供氮水平对菠菜品质和抗氧化酶活性的影响[J].应用生态学报,2005,16(3):519-523.
