镉胁迫下两种菊芋幼苗的光合作用特征及镉吸收转运差异的研究
2011-06-08陈良隆小华郑晓涛刘兆普
陈良,隆小华,郑晓涛,刘兆普
(南京农业大学资源与环境科学学院 江苏省海洋生物学重点实验室,江苏 南京210095)
近年来,随着工农业生产的迅速发展,农田土壤中重金属污染日益严重。我国受重金属污染的耕地面积近2 000万hm2,约占耕地面积的1/5,其中镉(Cd)污染耕地占1 133万hm2[1]。镉是一种毒性很强的重金属,土壤中的镉不仅会对农作物产生毒害作用,如抑制植物光合作用和蒸腾作用、干扰植物的代谢过程、加速植物衰老、影响农作物产量和品质,而且能通过食物链进入人体从而引发多种疾病[2]。对于大面积受中、低度重金属污染的土壤,在中国的现实情况下要实行休耕是不现实的,并且仍有许多农田的土壤污染情况不明,无法进行有针对性的休耕[3]。如此大面积污染土壤采用传统的物理和化学方法均因经济或技术等原因难以实施,目前基本处于未修复状态。利用植物的超量富集作用以去除污染土壤中超标重金属的植物提取修复技术具有操作简单,经济上和技术上能够大面积实施等优点,是一项十分有前途的修复技术[4]。
Cd胁迫下,不同植物反应不同,近年来有关水稻(Oryzasativa)、小麦(Triticumaestivum)、玉米(Zea mays)、蔬菜等对Cd胁迫的反应及生理生化方面的研究已有较多的报道[5-8],尽管利用植物作为Cd污染环境修复材料的研究很多,但关于利用植物修复Cd污染土壤的实例还极少报道。菊芋(Helianthustuberosus)适应性强,为耐寒、耐旱、耐贫瘠、耐盐碱植物,根系发达,生物量极大,在全球的热带、温带、寒带以及干旱、半干旱地区都有菊芋的分布和栽培,在我国很多省区都可栽培[9]。在试验中发现菊芋植株中Cd含量较高,进一步利用砂培盆栽浓度梯度试验就2种菊芋对不同浓度Cd胁迫下幼苗生物量、光合特征参数及对Cd富集效果进行了比较和研究,为利用菊芋对Cd污染土壤生物修复提供理论依据。
1 材料与方法
1.1 供试材料
供试菊芋为不同品系的南芋5号(NY5)和南芋2号(NY2),采于南京农业大学江苏大丰“863”中试基地。
1.2 试验设计
本试验于2010年4月25日-2010年5月30日在南京农业大学牌楼温室中进行。菊芋块茎用自来水及蒸馏水冲洗干净后,经0.05%杀真菌剂进行表面灭菌。灭过菌的具有芽眼的菊芋块茎切片播于周转箱中装有石英砂且下部有孔的塑料盆钵中,周转箱存有一定深度的培养液,隔天换培养液,每次都充分淋洗石英砂,以保证培养条件的均一性,自然光照。待块茎萌发后用1/2Hoagland营养液浇灌。至三叶期时进行疏苗移栽,每盆保留1棵,每个处理3盆。待6叶期时进行处理,设置0,5,25,50,100和200mg/L 6个Cd浓度,处理时直接将固体形态的CdCl2·2.5H2O溶于1/2Hoagland营养液中,充分搅拌混匀,进行浇灌。处理期间隔天更换营养液,更换时应注意不让营养液沾到植株地上部分,处理3周后采样进行检测。
1.3 测定指标与方法
1.3.1 生物量测定 将菊芋幼苗从塑料盆中取出,用去离子水冲去砂粒,再用吸水纸吸干后随机选取3片倒5功能叶分别测定叶长和叶宽,然后用直尺测定株高、根长、直径,用称重法测总鲜重、根鲜重、地上鲜重,经110℃杀青10min后于60℃烘干至恒重测定总干重、根干重、地上干重。根冠比=根干重/地上干重。
1.3.2 叶绿素a(Chl a)、叶绿素b(Chl b)、总叶绿素(Chl)与类胡萝卜素(Car)的测定 采用王学奎[10]的方法。每个处理选取3株,取第4片功能叶,将整个叶子剪碎,分别称取0.1g,置于10mL容量瓶内,加95%乙醇定容至10mL。将各个处理摇匀置于避光处,过夜。待第2天残渣完全变白后,分别在665,649和470nm测定吸光值。按如下公式计算各色素含量:

式中,W为样品鲜重(g)。
1.3.3 光合作用参数的测定 采用英国PP-System公司CIRAS-1型全自动便携式光合测定系统测定净光合速率(net photosynthetic,Pn)、气孔导度(stomatal conductance,Gs)、蒸腾速率(transpiration rate,Tr)、细胞间隙CO2浓度(inter-celluar CO2concentration,Ci)等光合作用参数,水分利用效率(water use efficiency,WUE)=Pn/Tr,气孔限制值(stomatal limitation,Ls)为[1-(Ci/Ca)]计算所得(Ca为空气中 CO2浓度)[11]。测定过程采用生物效应灯为光源,光量子通量密度(photon flux density,PFD)为1 176~1 184μmol/(m2·s),叶面积2.5 cm2,大气温度17.3~18.2℃,Ca变化范围为394.2~398.1μL/L。
1.3.4 Cd富集吸收量的测定 植物根、茎和叶干样过20目筛(20孔/645.16mm2),采用HNO3-HClO4法进行消化(二者体积比为87∶13),利用电感耦合等离子体光谱发生仪(inductive coupled plasma emission spectrometer,ICP)测定其中的Cd含量,每个样品重复3次。
生物富集率(bioconcentration factor,BCF)和转移系数(translocation factor,TF)按以下公式计算[12]:

1.4 统计分析
利用Microsoft Excel软件、SPSS 16.0软件进行试验数据的统计,采用Duncan检验进行显著性分析。
2 结果与分析
2.1 不同浓度Cd对2种菊芋生物量的影响
Cd对菊芋幼苗生长具有显著的抑制作用(表1)。在Cd的胁迫下,2种菊芋的叶长都表现为下降趋势,不同的是NY5的叶长总体下降趋势较NY2平缓一些。NY5叶长在25和50mg/L的Cd浓度下差异不大,分别为对照的65.53%和68.42%;NY2的叶长在100和200mg/L Cd处理时显著低于对照,仅为对照的53.84%和50.31%。叶宽与叶长趋势基本类似。在Cd胁迫下,株高和根长显著低于对照,但随浓度增大,NY2减少量明显大于NY5。NY5对照组直径甚至低于NY2,仅为NY2的80%,但在5~200mg/L的Cd范围内,NY5直径的减少量为0.11cm,NY2则为0.22cm,是NY5直径变化量的2倍。
2种菊芋根干重、地上干重以及全株干重与表1中5个指标保持着高度相似性,但受到Cd胁迫以后,NY5变化量更小一些(表2)。在5mg/L时,根冠比均达到最大,较对照分别增大了32.89%和65.42%。但随着浓度的增大,根干重的降低幅度大于地上部干重,在最高浓度200mg/L时根冠比较对照分别下降了13.3%和32.3%。而NY5在Cd胁迫下,根冠比相对于NY2变化幅度小。
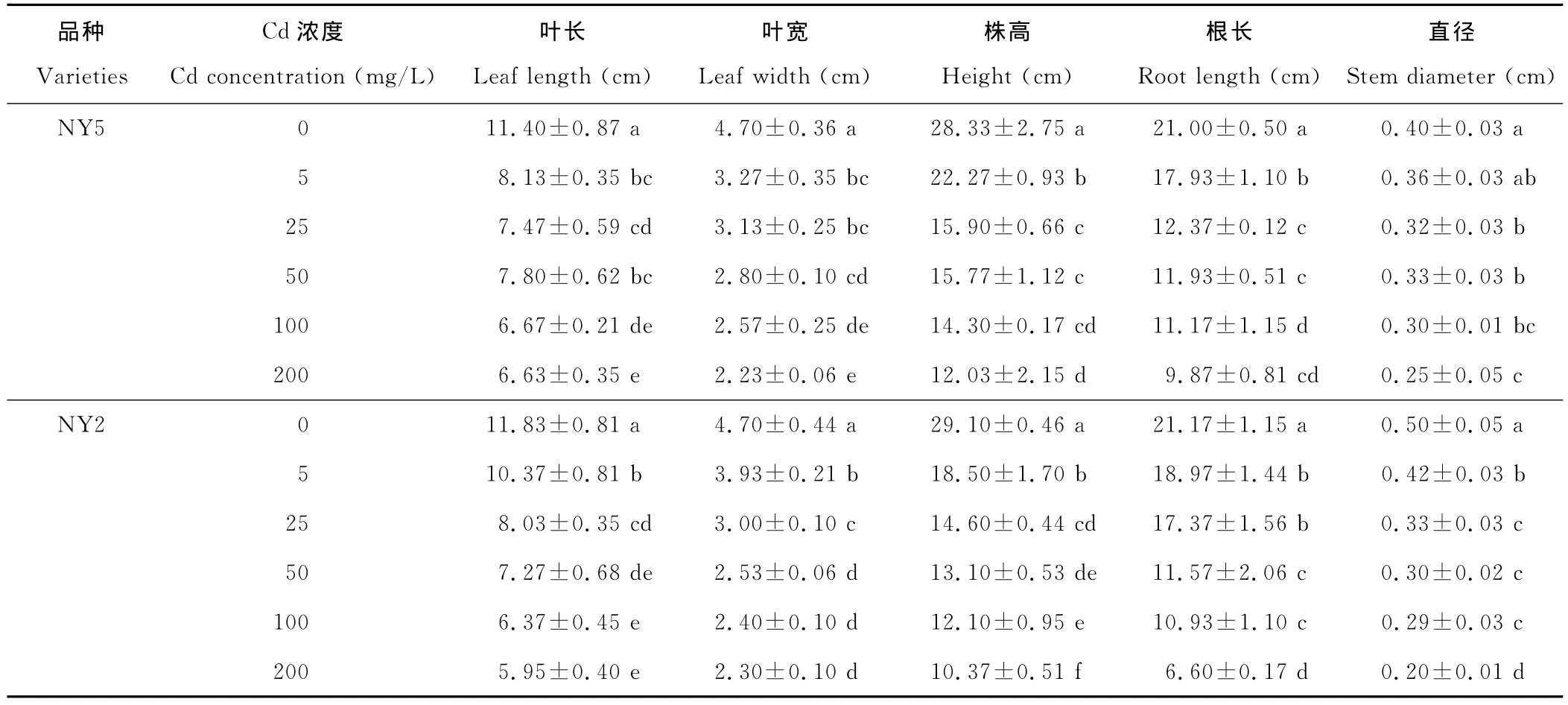
表1 不同浓度Cd对2种菊芋生物量的影响Table 1 Effects of different Cd concentrations on growth for two H.tuberosus varieties seedling

表2 不同浓度Cd对2种菊芋干重及根冠比的影响Table 2 Effects of different Cd concentration on dry weight and the root/shoot of two H.tuberosus varieties seedling
2.2 不同Cd浓度对2种菊芋幼苗叶片色素(Chla、Chlb、Chl与Car)含量的影响
在Cd胁迫下,2种菊芋叶片中叶绿素含量变化趋势都呈先降后升的趋势(图1)。NY5总叶绿素含量在100 mg/L Cd浓度时达到最低值,仅为对照组含量的33.18%,而NY2总叶绿素含量在25mg/L的Cd浓度下即达到最低点,是对照的23.08%。NY5叶片的类胡萝卜素含量处理组都高于对照,在5mg/L Cd处理时最高,为对照的1.70倍;而NY2总体呈下降趋势,除50mg/L以外,其他浓度时类胡萝卜素含量都低于对照,分别是对照的73.11%,83.56%,59.00%和32.30%。

图1 不同Cd浓度对2种菊芋叶绿素及类胡萝卜素含量的影响Fig.1 Effects of different Cd concentrations on the Chl and Car content in two H.tuberosus varieties seedling
2.3 不同Cd浓度对2种菊芋光合作用参数的影响
2种菊芋的Pn较对照组显著下降(图2),NY5在5,25,50,100和200mg/L时分别是对照的77.98%,49.33%,41.47%,36.30%和25.93%;而NY2除在25mg/L时与对照组差异不显著外,其他Cd浓度下均显著低于对照。Gs的变化趋势与Pn类似,NY5在各个Cd处理浓度下均低于NY2;NY5的Gs随Cd浓度增加而降低,NY2的Gs在25mg/L Cd处理时与对照差异不显著。NY2的Ci在Cd胁迫下变化不大,而NY5的Ci在低浓度Cd(5~50mg/L)胁迫下与对照差异不显著,在高浓度(100和200mg/L)Cd胁迫下显著低于对照。Tr在100和200mg/L Cd胁迫时显著下降,NY5和 NY2分别只有对照的45.42%,23.95%和30.77%,22.23%。
WUE和Ls的变化趋势极其相似,NY5在50mg/L Cd处理下,WUE和Ls均达到最低值,分别是对照的25.00%和36.80%;NY2的WUE相对稳定,除在5mg/L时显著低于对照外,其他Cd浓度下与对照差异不显著,而其Ls除在5mg/L Cd处理时略微低于对照外,之后随着浓度的增加,不断增大(图2)。

图2 不同Cd浓度对2种菊芋净光合速率、气孔导度、胞间CO2浓度、蒸腾速率、水分利用效率及气孔限制值的影响Fig.2 Effects of different Cd concentrations on the Pn,Gs,Ci,Tr,WUE and Ls in two H.tuberosus varieties seedling
2.4 不同Cd浓度下Cd在2种菊芋根、茎、叶的富集情况
2种菊芋体内Cd含量随着Cd浓度的升高而显著增大,根部明显高于叶片与茎部,说明根部是Cd主要富集器官,对Cd的富集能力大于茎和叶。BCF随着Cd浓度的升高而显著下降,而TF因品种的不同而有所差异,NY5的TF随着Cd浓度的增加呈先增后降的趋势,并在50mg/L Cd处理下,TF达到最大值,而NY2的TF则随着Cd浓度的升高而不断下降(表3)。
3 讨论
Cd作为一种植物非必需的元素,会严重阻碍植物生长发育,2种菊芋的生物量都随着Cd浓度的增加而减少,尤其在高浓度Cd处理下,叶长、叶宽、株高、根长、直径以及各部分干重的减少量更大,表明Cd胁迫不但能抑制菊芋的生长,且随着浓度的增加抑制作用增大。尽管菊芋受Cd胁迫的生物量显著下降,但仍可以在高达200 mg/L的Cd浓度下存活,可见,菊芋对Cd胁迫有良好的耐性。Cd对2种菊芋生物量的抑制作用为:株高>叶长>根长;NY2>NY5。这说明菊芋根部对Cd的耐受性最大,叶片次之,茎最小,而且NY5对Cd的耐性明显强于NY2。

表3 不同Cd浓度下Cd在2种菊芋根、茎、叶中的富集量Table 3 Cd content in root,shoot and leaf of two H.tuberosus varieties seedling under different Cd concentration
Cd是毒性最强的重金属元素之一,植物受到Cd胁迫时,光合作用会受到抑制,叶绿体受到破坏,抑制光合酶的活性和叶绿素的合成,光合效率降低,叶绿素总量和光合作用都呈下降趋势[13,14]。在Cd的胁迫下,NY5、NY2叶绿素a和b含量都明显下降,不过NY2的下降速度明显高于NY5,说明NY5叶片较NY2对镉的耐性更高一些。Car含量的下降在一定程度上影响活性氧的清除,如果产生的活性氧过多来不及清除,就会对光合机构造成伤害,包括对作用中心D1蛋白的破坏和叶绿素的降解[15],而2种菊芋Car的变化趋势恰恰验证了这一观点,所以在Cd的胁迫下,NY5能够通过增加叶片中Car的含量来缓解Cd的抑制作用。
净光合速率直接反映了单位叶面积的光合同化能力[11],是反映植物对Cd胁迫的响应以及鉴定植物耐Cd能力的有效生理指标。随着Cd浓度的增大,2种菊芋光合作用参数如Pn、Gs、Tr显著下降,NY2的Pn在高浓度(100和200mg/L)Cd胁迫下,显著低于NY5,这进一步说明NY2对Cd的耐性不如NY5,Pn的下降与2种菊芋各生理参数有密切的联系,尤其与光合作用场所(叶片)的生理状况联系紧密,叶片中各色素(Chl与Car)含量直接影响光合速率,在高浓度(100和200mg/L)Cd胁迫下,NY5可以通过诸如增加叶片中Car含量以及其他机制来提高对Cd的耐性,从而维持NY5的Pn在较高的水平。在大多数情况下,气孔导度的下降将造成CO2供应受阻进而使植物的光合速率下降[16,17],而本试验中,胞间CO2浓度变化不大,而气孔限制值随着Cd浓度的不断升高而增大。这说明Cd胁迫并不能通过限制气孔导度来降低胞间CO2浓度,而Gs的下降与Ls的升高应该会减弱Tr,也间接说明Pn减弱的主要原因是非气孔限制,即由叶肉细胞光合活性下降引起的,这也与叶绿素含量下降相吻合。水分利用效率即水分生产率,是显示作物水分吸收利用过程效率的一个指标[18],Cd胁迫条件下,植株脱水严重,为适应此逆境,植株水分利用效率及气孔限制值增加,以达到减少水分散失的目的,在一定程度上有利于缓解水分失衡,从而提高植株的耐镉性。
已有研究表明,大豆(Glycinemax)[19]、甘蓝(Brassicaoleracea)[20]、小白菜(Brassicarapa)[21]、萝卜(Raphanussativus)、豌豆(Pisumsativum)[22]与水葫芦(Eichhorniacrassipes)[23]等品种对 Cd吸收存在差异,不同品种植物的遗传特性差异决定其对重金属元素的吸收量,本试验也验证了前者的研究结果,虽然2种菊芋对Cd都有较强的富集作用,但NY5的Cd含量、生物富集系数以及转移系数都高于NY2,随着Cd浓度升高,BCF降低,表明Cd胁迫的加剧减弱了Cd的生物富集效率,而TF小于1说明菊芋根部是主要的Cd富集器官,从根部向地上部运输转移Cd的能力较小。一般来说,植物修复重金属污染的效率取决于2个方面,即植物体对环境中重金属的吸收富集能力以及该种植物生物量的大小[24]。虽然本试验中TF较小,但菊芋生物量巨大,具有其他植物无法比拟的优势,以25mg/L Cd浓度为标准,NY5叶、茎、根中Cd含量分别达141.90,174.79和1 344.70 mg/kg,种植一季,NY5可从Cd污染土壤转移1 000g以上的Cd。因此,应用菊芋修复重金属污染具有较大的潜力与可行性。
本研究通过对2种菊芋在不同浓度Cd胁迫下的光合特征和根、茎、叶三部分对Cd富集效果进行研究和对比,证明菊芋对Cd具有较强的吸收和富集效果,而NY5比NY2富集Cd的能力更强,但利用菊芋修复Cd污染环境还需根据污染环境的具体情况进行进一步研究。
[1]郭艳丽,台培东,韩艳萍,等.镉胁迫对向日葵幼苗生长和生理特性的影响[J].环境工程学报,2009,3(12):2291-2296.
[2]李源,李金娟,魏小红.镉胁迫下蚕豆幼苗抗氧化能力对外源NO和H2O2的响应[J].草业学报,2009,18(6):186-191.
[3]李新博,谢建治,李博文,等.镉对紫花苜蓿不同生长期生物量的影响及饲用安全评价[J].草业学报,2009,18(5):266-269.
[4]Wagner G J.Accumulation of cadmium in crop plants and its consequences to human health[J].Advances in Agronomy,1993,51:173-212.
[5]肖美秀,林文雄,陈冬梅,等.镉胁迫对耐性不同的水稻幼苗脂膜过氧化和保护酶活性的影响[J].中国生态农业学报,2006,14(4):256-258.
[6]张利红,李培军,李雪梅,等.镉胁迫对小麦幼苗生长及生理特性的影响[J].生态学杂志,2005,24(4):458-460.
[7]彭明,王焕校,吴玉树,等.镉、铅诱导玉米(Zeamays)幼苗细胞超微结构的变化[J].中国环境科学,1991,11(6):426-431.
[8]Gil J,Moral R,Gomez L,etal.Effects of cadmium on physiological and nutritional aspects of tomato plant.I.Chlorophyll(a and b)and carotenoids[J].Fresenius Environmental Bulletin,1995,(4):430-435.
[9]隆小华,刘兆普,陈铭达,等.半干旱地区海涂海水灌溉菊芋盐肥耦合效应的研究[J].土壤学报,2005,42(1):91-97.
[10]王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006:202-278.
[11]姜超强,李杰,刘兆普,等.盐胁迫对转AtNHX1基因杨树光合特性与叶绿体超微结构的影响[J].西北植物学报,2010,30(2):301-308.
[12]Shi G R,Cai Q S.Cadmium tolerance and accumulation in eight potential energy crops[J].Biotechnology Advances,2009,27:555-561.
[13]张金彪.镉对草莓的毒害及机理和调控研究[D].福州:福建农林大学,2001:41-61.
[14]李俊梅,王焕校.镉胁迫下玉米生理生态反应与抗性差异研究[J].云南大学学报(自然科学版),2000,22(4):311-317.
[15]Schnettger B,Critchley C,Santore U J,etal.Relationship between photoinhibition of photosynthesis,D1protein turnover and cholroplast structure:effects of protein synthesis inhibitors[J].Plant,Cell and Environment,1994,17:55-64.
[16]张乃华,高辉远,邹琦.Ca2+缓解NaCl胁迫引起的玉米光合能力下降的作用[J].植物生态学报,2005,29(2):324-330.
[17]马清,楼洁琼,王锁民.Na+对渗透胁迫下霸王幼苗光合特性的影响[J].草业学报,2010,19(3):198-203.
[18]王建绪,刘兆普,隆小华,等.海水浇灌对菊芋生长、光合及耗水特征的影响[J].土壤通报,2009,(3):606-610.
[19]张治安,王振民,徐克章.Cd胁迫对萌发大豆种子中活性氧代谢的影响[J].农业环境科学学报,2005,24(4):670-673.
[20]Zhao H L,Li H J,Xiao L L,etal.Effect of N and K fertilizers on yield and quality of greenhouse vegetable crops[J].Pedosphere,2008,18(4):496-502.
[21]陈瑛,李廷强,杨肖娥,等.不同品种小白菜对镉的吸收积累差异[J].应用生态学报,2009,20(3):736-740.
[22]Alexander P D,Alloway B J,Dourado A M.Genotypic variations in the accumulation of Cd,Cu,Pb and Zn exhibited by six commonly grown vegetables[J].Environmental Pollution,2006,144:736-745.
[23]纪苗苗,林波,吴跃明,等.不同水域中水葫芦对铅、镉、铬、汞的富集规律研究[J].草业科学,2010,27(7):1-4.
[24]原海燕,黄苏珍,郭智,等.外源有机酸对马蔺幼苗生长、Cd积累及抗氧化酶的影响[J].生态环境,2007,16(4):1079-1084.
