湖南省日本血吸虫线粒体atp6基因部分序列的多态性分析*
2011-06-06夏英定汪世平吴昌义尹铁球周云飞张树菊冯其梅
夏英定,汪世平,李 娟,吴昌义,田 智,尹铁球,周云飞,张树菊,冯其梅
2.华南农业大学兽医学院,广州 510642
日本血吸虫病是一种引起严重公共卫生问题的人兽共患寄生虫病,是世界卫生组织确定的六大重点热带病之一[1-2],也是我国政府高度重视并重点防治的四大传染病之一。目前,我国仍有173个县1 579个乡(镇)处于血吸虫病的流行状态,估计患者56.60万[3]。
线粒体DNA(m tDNA)结构简单、稳定、以母系方式遗传,核苷酸歧异度大、进化速度快于或等于核DNA[4-5],在种间、种内、群体间和群体内均具有广泛的多态性。m tDNA序列可以提供有效的分子标记用于种群分类、示踪个体或相关特殊种群的基因发展历史,同时还可用于构建种系发育中更细致的分支[6],目前已在寄生虫的种类鉴定及种系发育研究中得到应用[7-8]。PCR-SSCP是20世纪80年代末发展起来的一种DNA突变检测技术[9-10],方法灵敏并具备适于大样本快速筛选等特点,是遗传变异研究常用方法之一[11]。本研究对采自湖南5个不同地区日本血吸虫样本的线粒体atp6基因部分序列进行了PCR-SSCP筛选和遗传变异的多态性分析,旨在为湖南不同自然隔离群日本血吸虫的遗传特性研究提供实验依据。
1 材料与方法
1.1 虫体来源 本研究所用的日本血吸虫成虫样品,分别采自湖南长沙橘子洲、常德澧县、岳阳楼区与君山区和汨罗磊石5个流行区的野生阳性钉螺,经家兔感染传代而获得虫样,有关信息见表1。

表1 研究中使用的湖南省日本血吸虫样品来源及其atp6序列信息Tab le1 In formation of atp6 sequences of S.japonicum from Hunan Province used in present study
1.2 主要仪器与试剂 DNA提取试剂盒、Ex Taq酶、DL-2000 DNA Marker、rTaq酶,凝胶成像系统,Bio-RAD电泳系统,凝胶图像分析系统,PCR试剂。
1.3 虫体材料的处理 从70%酒精保存液中取出单个成虫(雌雄合抱的成虫用镊子轻轻分离为雌、雄两条)。将雌、雄虫分装于新的1.5m L Eppendorf管中,用蒸馏水反复冲洗3次。
1.4 DNA提取、鉴定 按Geneaid公司DNA提取试剂盒(Genomic DNA miniKit protocol-Tissue)说明书操作,抽提DNA样品用于下一步的扩增。
1.5 atp6部分序列扩增及鉴定 根据GenBankTM上已发表的atp6基因序列设计1对特异引物,上游引 物 (atp6u):5′-TA TCTGGGTTA TGGTTTACTAGA-3′, 下 游 引 物 (atp6d):5′-CGACAGAAAACT TAAGTATCTCT-3′,引物由上海生工生物工程有限公司合成。PCR反应采用25μL体系:10×缓冲液 2.5μL,dNTPs(2.5mmol/L)2μL,MgCl2(25mm ol/L)2.5μL,上 下游 引物 各0.5μL(50pmol/μL),rTaq 0.25μL,gDNA 1μL。反应条件:94℃ 5min;94℃1min,55℃30s,72℃1min,33个循环;72℃5min。经1.0%的琼脂糖凝胶电泳分析,EB染色后于凝胶成像系统鉴定并拍照。
1.6 SSCP[12]筛选及鉴定 取3μL阳性PCR产物和5μL变性载样缓冲液混匀,94℃变性10min后,立即置于冰浴中骤冷5min后上样,6%非变性聚丙烯酰胺凝胶电泳。12~20℃,90 V电泳约300min。电泳结束后,取下凝胶,双蒸水漂洗2次;将凝胶放入浓度0.25m g/L EB染色液中染色30min后于凝胶成像系统观察结果并拍照。
1.7 测序 根据SSCP分析结果,选择SSCP带型不同的代表性样品(筛选时,将特异条带的相邻条带的样品一并测序,以作比较),共筛选出13个具有代表性的atp6部分基因样品,PCR扩增后,将PCR产物直接送华大基因科技股份有限公司有限公司测序。
1.8 变异分析 将21份样品的测序结果用DNAStar 5.0和Mega 4.0软件进行多态性分析和系统发育研究。
2 结 果
2.1 atp6部分基因SSCP筛选及PCR扩增结果atp6部分基因经SSCP筛选后,通过6%非变性聚丙烯酰胺凝胶电泳鉴定,结果见图1。

图1 atp6部分基因SSCP筛选后聚丙烯酰胺凝胶电泳结果Fig.1 SSCP selection resu lts of atp6 by PAGE
从35份样品中筛选出具有代表性的atp6部分基因13份,以及长沙橘子洲和岳阳楼区样品8份,对此21份样品进行了PCR扩增。扩增产物经1%琼脂糖凝胶电泳后,在约500bp处呈现1条特异性条带(见图2),与预期的片段大小吻合,且无非特异性条带,说明本研究设计的PCR引物及反应条件具有较好的特异性。

图2 atp6部分基因PCR扩增结果Fig.2 PCR resu lts of atp6
2.2 atp6序列测定及其变异与发育分析 将测序获得的21份样品atp6部分序列用DNAStar5.0软件比对(结果见图3)分析发现,湖南省日本血吸虫各分离株的483 bp atp6基因序列中有17个变异位点(3.52%),其中16处发生了转换(G-T转换有3次、C-T转换有 7次、A-G转换有 5次、C-A 转化1次),其中C-T转换频率最高,C-A转换频率最低(见表2)。所得的atp6序列中A,G,T,C碱基平均含量分别为20.91%,21.33%,48.24%,9.52%,其中A+T平均含量为69.15%明显高于C+G平均含量30.85%。遗传差异分析表明雌雄虫之间的差异为0.0%~1.3%,各个虫株间的差异0.0%~1.5%,不同地理来源虫株间的差异为率0.0%~1.5%(表3)。
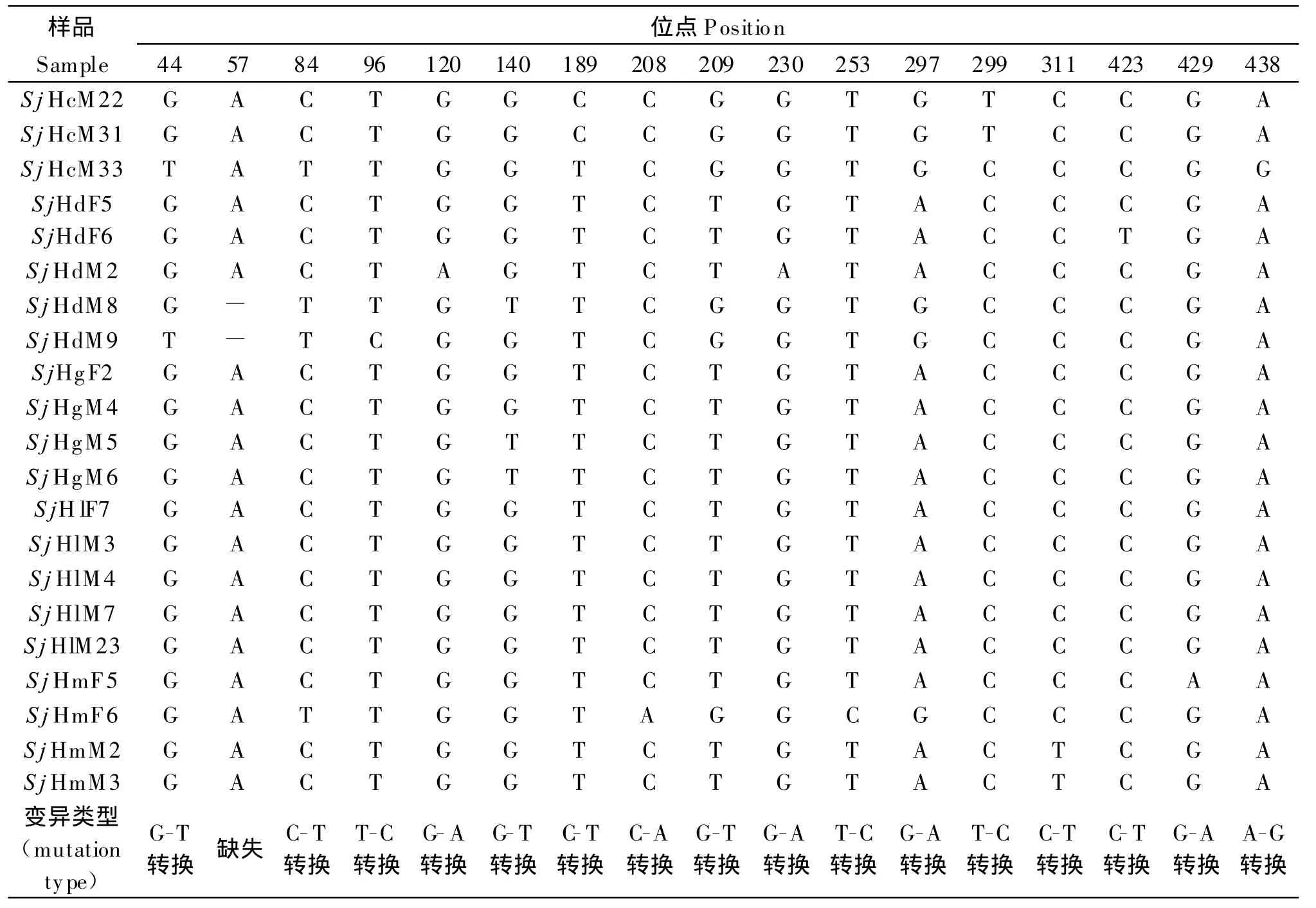
表2 atp6部分序列的变异情况Tab le 2 Variation of nucleotideacids sequences of each atp6
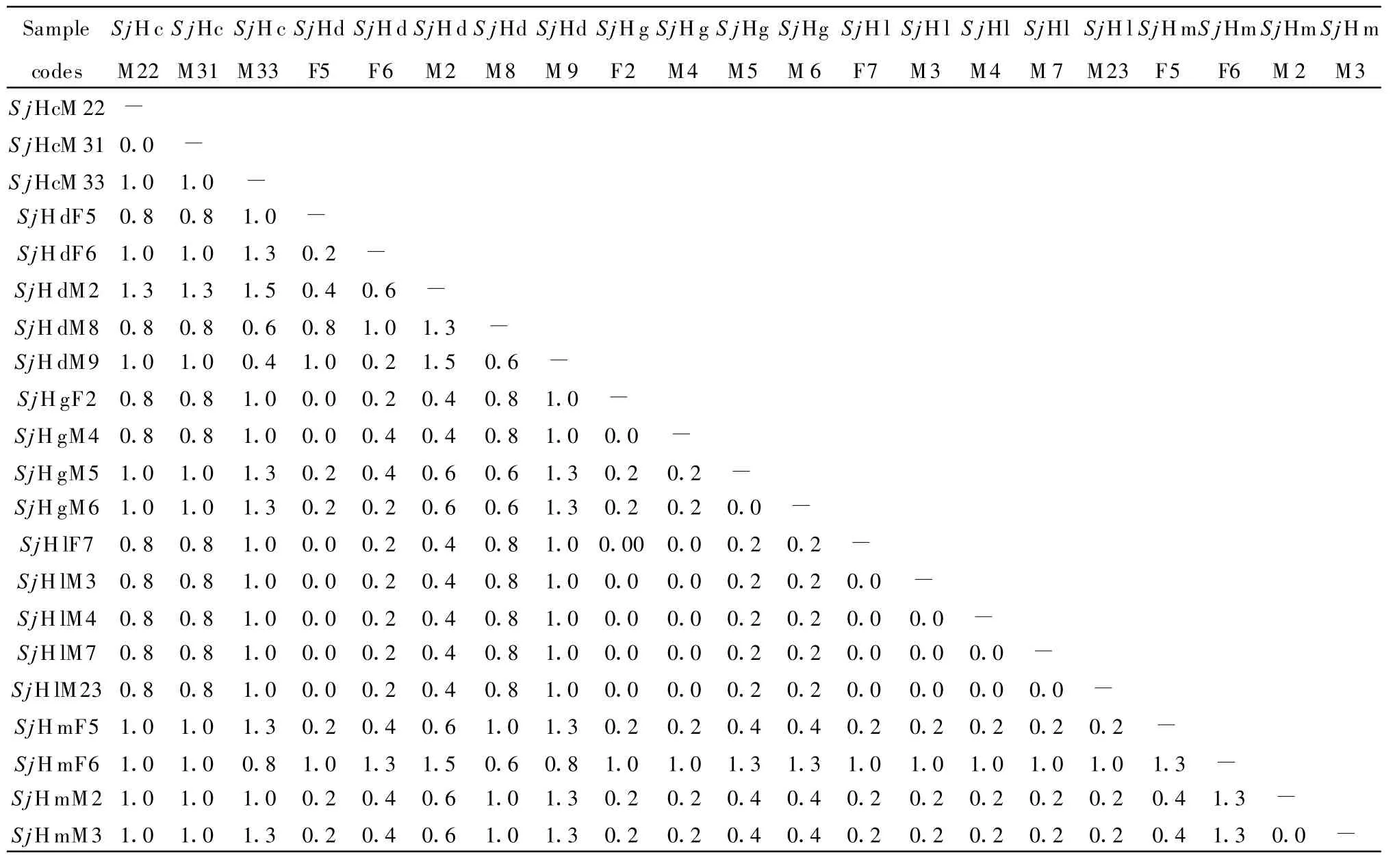
表3 各atp6部分序列的差异性比较Table 3 Differences nucleotide sequence among each atp6

种系发育分析表明,湖南省不同地域自然隔离群日本血吸虫分离株线粒体atp6基因的个体遗传差异明显,尤以汨罗和岳阳君山两地分离虫株表现突出(图4)。
3 讨 论
日本血吸虫存在明显的种和株间变异[13],由于自然环境的隔离,采用传统的分类方法已无法解释日本血吸虫各地域株的遗传分化的特征。m tDNA作为遗传标记已广泛应用于寄生虫的种类鉴定、遗传多态性和种群结构及种系发育等研究。Sorensen和Zhao等[14-15]分别通过不同的方法对中国大陆日本血吸虫虫线粒体nad 1,nad 4,nad 5,cox3基因进行了遗传多态性和种系发育以及种群内遗传变异的分析。Zarow iecki[16]等利用滑行窗口技术分析了血吸虫线粒体基因组,揭示atp6基因具有最低的变异碱基数和最丰富的信息内容。甚至还有人用线粒体atp6基因和其他线粒体基因作为分子标记来研究胡萝卜野生品种与和人工培养品种间的遗传变异情况[17-19]。Gudewar[20]等也报道了关于在印度同一地域里细粒多棘球绦虫病的两种不同基因型的线粒体基因atp6和nad2基因特性,并认为以其线粒体atp6和nad2基因分析结果可以指示该基因型的传播情况。但迄今为止,尚未见不同地域自然隔离群日本血吸虫分离株线粒体atp6基因遗传变异研究的报道。
本研究对来自我国湖南省5个不同流行地区的21份日本血吸虫样品进行了atp6部分基因序列的遗传多态性分析。结果表明来自不同流行区的21个样品总体变异率为3.52%,种内各个虫株间差异在0.0%~1.5%之间。种系发育分析表明,湖南省不同地域自然隔离群日本血吸虫分离株线粒体atp6基因的个体遗传差异十分明显,尤以汨罗和岳阳君山两地分离虫株表现突出,出现这个现象的原因可能与日本血吸虫线粒体atp6基因进化活跃的遗传特征有关。同时,或许因为湖区年年不断的涨水季节造成钉螺的迁移,导致相邻地域之间虫株互换频繁,故发生个体之间遗传特征的交叉现象。此外,湖南省流行区内长期使用大量化学药物进行灭螺灭蚴工作,也可能导致该地区日本血吸虫由于药物选择压力的加大,以致进化速度加快。但是,是否由于生存环境的选择压力造成了同一地理来源日本血吸虫个体之间atp6基因的遗传差异,其原因尚有待于进一步研究。
[1]W oodruff D S,Merrelender A M,Upatham E S,et al.Genetic variation and differen tiation of th ree Schistosoma species from the Philippines,Laos and Peninsu lar Malay sia[J].Am J T rop Med Hyg,1987,36(2):345-354.
[2]McGravey S T,Zhou X N,W illingham A L,et al.The epidem iology and host-parasite relationship sof Sch istosoma japonicumin definitive hosts[J].Parasitol Today,1999,15(6):214-215.
[3]郝阳,吴晓华,郑浩,等.2007年全国血吸虫病疫情通报[J].中国血吸虫病防治杂志,2008,20(6):401-402.
[4]Hoeh WR,Blakley KH,Brown WM.Heteroplasmy suggests lim ited biparen tal inheritan ce of Mytilusm itochondrialDNA[J].Science,1991,251:1488-1490.
[5]McManusa D P,Lea T H oa,Blair D.Genom ics of parasitic flatw orms[J].In ternational Journal for Parasitology,2004,34:153-158.
[6]Li MW,Lin R Q,Song H Q,et al.The completem itochondrial genomes for three Toxocara species of human and anim al health significance[J].BMC Genom ics,2008,9:224.
[7]Hu M,Chilton N B,Gassar R B.Them itochondrialgenom ics of parasitic nematodes of socio-econom ic im portance:recent prog ress,and implications for population genetics and systematics[J].Adv Parasitol,2003,56:134-188.
[8]McManus DP,Bow les J.Molecular genetic approaches to parasite identification:their value in diagnostic parasitology and systematics[J].In ternational Journal fo r Parasitology,1996,26:687-704.
[9]Orita M,Iw ahana H,Kanazaw a H,et al.Detection of polymorphisms of human DNA by gel electrophoresis as single-strand confo rm ation polymorphism s[J].Proc Natl Acad Sci USA,1989,86(8):2766-2770.
[10]H ayashiK,Orita M,Suzuki Y,et al.Use of labeled primers in polym erase chain reaction(LP-PCR)for a rapid detection of the product[J].Nucleic Acids Res,1989,17(9):3605.
[11]Gasser RB,Monti JR.Identification of parasitic nematodes by PCR-SSCP of ITS-2 rDNA.Mol.Cell.Probes,1997,11:201 209.
[12]Li MW ei,Zhu X Q,Robin B.Gasser,et al.Theoccurrence of Toxocaramalaysiensis in cats in China,confirmed by sequencebased analyses of ribosomalDNA[J].Parasitol Res,2006,99:554-557.
[13]Zhou X N,Guo JG,Wu X H,et al.Epidemiology of Schistosom iasis in the People's Republic of China[J].Em erg.Infect.Dis,2004,13:1470-1476.
[14]S rensen E,D rew AC,Brindley PJ,et al.Variation in the sequence of a m itochondrial NADH dehydrogenase I gene fragment among six natural populations of Schistosoma japonicum from China[J].Int JParasitol,1998,28:1931-1934.
[15]Zhao G H,Mo X H,Zou FC,et al.Genetic variability am ong Sch istosoma japonicum isolates from differen t endem ic regions in China revealed by sequences of th ree m itochondrial DNA genes[J].Veterinary Parasitology,2009,162:67-74.
[16]Zarow iecki MZ,H uyse T,Littlew ood D T J.Making them ost ofmitochondrial genomes–Markers for phylogeny,m olecu lar ecology and barcodes in Schistosoma(Platyhelminthes:Digenea)[J].International Jou rnal for Parasitology,2007,37:1401-1418.
[17]Yam agishi H,Terachi T.Molecular and biological studies on male-sterile cy toplasmin the CruciferaeⅢ.Distribution of Ogura-type cytoplasm among Japanese w uld radishes and Asian radish cultivars[J].Theor Appl Genet,1996,93:325-332.
[18]Yam agishi H,Terachi T.Molecular and biological studies on male sterile cy toplasmin the Cruciferae.I.The origin and distribution of Ogu ra male sterile cytoplasmin Japanese w ild radishes(Raphanus sativus L.)revealed by PCR-aided assay of theirm itochondrial DNAs[J].Theor Appl Genet,1994,87:996-1000.
[19]Hiroshi Yamagishi,Toru Terachi.Molecular and biological studies on male-sterile cytoplasmin the Cruciferae.II.The origin of Ogu ram ale sterile cytoplasminferred from the segregation pattern ofm ale sterility in the F1 progeny of w ild and cultivated radishes(Raphanus sativus L.)[J].Euphy tica,1994,80:201-206.
[20]Gudew ar J,Pan D,Bera A K,et al.Molecu lar characterization of Echinococcus g ranu losus of Indian animal isolateson the basis of nuclear andmitochondrial genotype[J].Mol Biol Rep,2009,36:1381-1385.
