Genistein对体外培养兔软骨细胞一氧化氮表达的影响
2011-06-02潘哲尔吴春雷朱雄白黄小敬温州医学院附属第一医院骨科温州325000
潘哲尔 李 驰 吴春雷 朱雄白 黄小敬 温州医学院附属第一医院骨科 温州 325000
原发性骨关节炎(osteoarthritis,OA)是一种常见的以关节软骨慢性进行性退变为特征的关节疾患。一氧化氮(NO)是体内重要的炎性介质,对骨关节炎的发生起着至关重要的作用[1]。本研究通过体外培养兔关节软骨细胞,应用受体酪氨酸激酶抑制剂genistein干预正常和LPS诱导炎症的软骨细胞,通过检测培养上清液中NO水平,了解受体酪氨酸激酶抑制剂genistein对软骨细胞NO表达的影响,现报道如下。
1 实验材料
1.1 动 物 4周龄新西兰白兔4只,由温州医学院动物实验中心提供,动物合格证号:SCXK(浙)2006-0026;普通级。
1.2 试剂与仪器 0.25%胰蛋白酶(Difco分装,批号:25200056);0.2%胶原酶 II(美国 Sigma 公司,批号:BY06019);20%小牛血清(DMEM,杭州四季青生物制品研究所,批号:69027263);二甲基亚砜(DMSO,德国Merk公司);受体酪氨酸激酶抑制剂genistein(美国Sigma公司,批号:G6649,根据需要用DMSO配制成不同浓度的溶液,置于-20℃保存);青霉素、链霉素(上海四药有限公司);LPS(北京邦定泰克生物技术有限公司,批号:L5418)。
2 实验方法
2.1 细胞原代培养 4周龄新西兰白兔4只,于无菌条件下切取股骨髁和胫骨平台关节软骨,Hank's液漂洗3次后,剪成1mm×1mm×1mm大小,以0.25%胰蛋白酶37℃预消化15min,然后用0.2%胶原酶37℃消化,每45min收集一次消化产物,共4次。每次收集的消化产物经筛网过滤、1000rpm离心5min后弃上清,所分离得到细胞用Hank's液漂洗离心3次,加入20%小牛血清DMEM培养液,以2×105/cm2接种于25cm2培养瓶内,置入D-6450型细胞培养箱(37℃、5%CO2)培养。
2.2 细胞换液和传代 细胞培养用具均高压灭菌30min,超净台以紫外线照射消毒>30min。48h换液消除未贴壁细胞和组织,以后隔日换液。显微镜下观察贴壁生长的单层细胞融合成片时即可传代。倒去培养瓶中陈旧性培养基,以少量Hank's液洗去培养瓶内残存培养基,重复操作两次,加入0.25%胰蛋白酶,37℃消化1~2min,显微镜下观察到细胞重新变成圆形后,吸去胰酶消化液。加入适量培养基,吸管轻轻吹打使细胞离壁并悬浮于培养基中。1000rpm离心5min后以适量培养基重悬细胞,重复操作2次。将传代细胞接种于25cm2培养瓶(密度2×105/cm2),镜下观察细胞达到亚融合状态后,换1%血清培养基过夜。
2.3 分组及干预 设置正常对照组、LPS刺激组以及LPS刺激+不同浓度genistein干预组共7组进行实验研究,LPS刺激浓度为10μg/mL,genistein干预浓度分别为 5μg/mL、10μg/mL、15μg/mL、20μg/mL 及25μg/mL;分别在培养第 1、2、3、4 天时,测定软骨细胞培养上清液NO水平。
2.4 亚硝酸盐测定 根据Griess氏[2]反应法,加以改进。在酶标板内加入细胞上清液100μL,加入1%对氨基苯磺酰胺50μL,4℃放置15min,再加入0.1%萘基乙二胺,室温30min后放置于酶标仪595nm处读取OD值。以10~100μM的亚硝酸盐溶液作为标准曲线。
3 实验结果
3.1 体外软骨细胞培养和形态观察 原代分离的软骨细胞悬浮于培养液中,静置24h后大部分细胞沉降于培养瓶壁上,72h后完全贴壁,12~14天铺满瓶底形成单层,部分区域可呈集落样生长或多层生长。传代的细胞一般24h即可完成贴壁,5~7天达到亚融合状态,生长分裂能力强于原代细胞,见图1。前2代细胞增殖、分化能力较强,细胞扩增率明显高于其他代。随着传代次数增加,细胞去分化现象明显,梭形细胞增多,增殖能力下降,传代周期延长。本研究选用第二代软骨细胞作为实验对象。

3.2 各组体外细胞培养液NO水平比较 细胞培养液中亚硝酸盐含量测定显示,空白对照组即正常关节软骨细胞不产生NO,在LPS刺激下可产生NO,且随着时间的延长,NO水平逐渐增加,genistein干预后上清液NO的水平有一定程度下降,且下降水平与genistein干预浓度和时间相关。空白对照组与LPS组、与不同浓度genistein干预组之间两两比较,差异有统计学意义(P<0.05);LPS组与LPS+genistein5μg/mL、10μg/mL干预组比较,差异无统计学意义(P>0.05);LPS 组与 LPS+genistein15μg/mL、20μg/mL及25μg/mL各干预组之间两两比较,差异有统计学意义(P<0.05),见表 1。
表1 各组体外软骨细胞培养液NO水平比较() nmoL/L
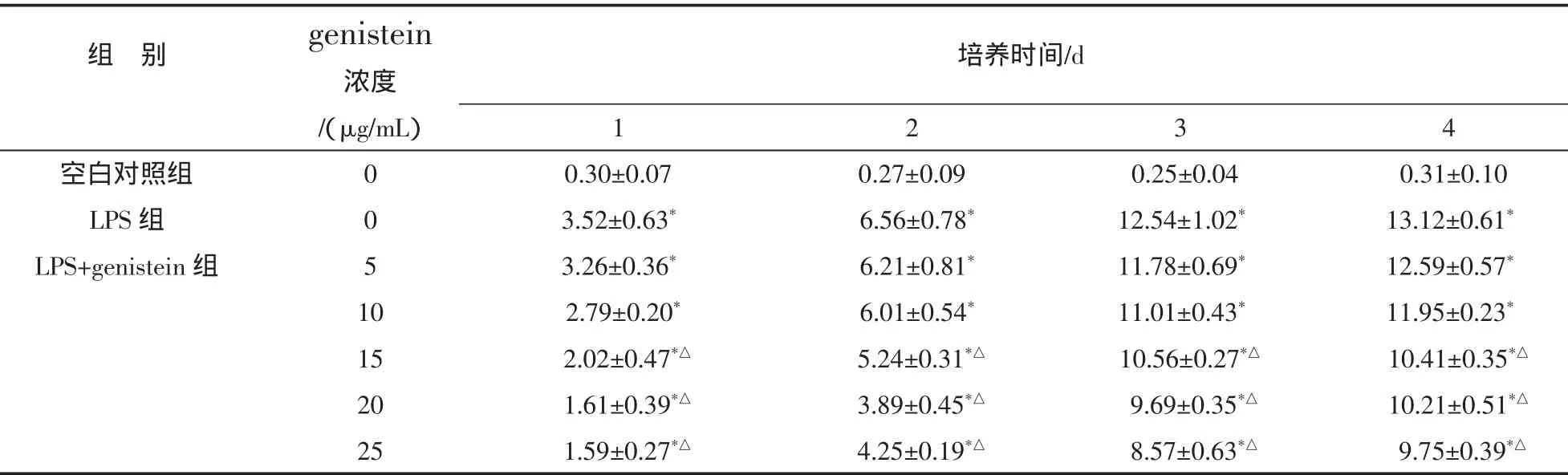
表1 各组体外软骨细胞培养液NO水平比较() nmoL/L
注:与空白组比较,*P<0.05;与 LPS 组比较,△P<0.05;
培养时间/d/(μg/mL)1234空白对照组 0 0.30±0.07 0.27±0.09 0.25±0.04 0.31±0.10 LPS 组 0 3.52±0.63* 6.56±0.78* 12.54±1.02* 13.12±0.61*LPS+genistein 组 5 3.26±0.36* 6.21±0.81* 11.78±0.69* 12.59±0.57*10 2.79±0.20* 6.01±0.54* 11.01±0.43* 11.95±0.23*15 2.02±0.47*△ 5.24±0.31*△ 10.56±0.27*△ 10.41±0.35*△20 1.61±0.39*△ 3.89±0.45*△ 9.69±0.35*△ 10.21±0.51*△25 1.59±0.27*△ 4.25±0.19*△ 8.57±0.63*△ 9.75±0.39*△组 别 genistein浓度
4 讨论
软骨细胞在体外培养过程中出现两种转归:一是继续维持表型,二是发生反分化。Tamamura等[3]通过测定II型胶原和蛋白多糖的变化,认为传代对细胞表型影响很大,国内张志光等[4]研究认为,在5代以内软骨细胞表型保持稳定,但这可能与实验动物的年龄、细胞接种的密度以及培养的条件相关。本实验观察到三代以内的软骨细胞活性较强,三代以后的细胞逐渐出现反分化。本实验发现第二代软骨细胞活性较高,是理想的实验细胞,所以我们选用第二代软骨细胞作为实验对象。
自1997年Stadler[5]首先报道兔关节软骨细胞能产生NO以来,人们开始研究NO与关节软骨之间的相互关系;并发现NO在风湿性关节炎、骨关节炎的软骨及关节液中含量明显升高,且具有重要的病理生理作用。NO在人体内以相对特异的方式控制多种细胞生理功能,一方面,NO通过鸟苷酸途径及多种非鸟苷酸依赖性途径影响基因转录、翻译及翻译后加工;另一方面,NO是一种细胞毒性分子,可造成组织损伤[6]。软骨细胞在受到LPS刺激下,合成高浓度的NO,可增加关节软骨中胶原酶和金属蛋白酶(MMPS)的活性[7],促进蛋白聚糖及胶原的裂解,引起OA关节软骨细胞异常凋亡[8]。因此,研究如何减少关节内NO的产生,成为预防、治疗骨关节炎的一个途径。
蛋白酪氨酸激酶(PTK)是蛋白磷酸化激酶家族中重要的成员之一,在炎症、肿瘤等疾病的一系列细胞活动信号转导途径中起着重要作用。PTK处于整个细胞信号传导途径的上游部分,通过磷酸化底物蛋白的酪氨酸残基而使其激活,参与多条信号途径。资料表明,蛋白酪氨酸激酶的信号转导通路在软骨细胞产生NO方面起着重要的作用[9],其可能是通过核因子-KB(NF-KB)参与一氧化氮合酶(iNOS)的基因调控[10],达到调控NO水平的作用。
有研究发现,体外培养的大鼠软骨细胞表达盘状结构域受体2(DDR2),DDR2是一类特殊的受体型PTK[11],广泛分布于人体的多种组织,DDR2的表达水平与基质金属蛋白酶(MMPS)的表达成正相关[12],在骨关节炎中DDR2的表达明显升高,这些都提示蛋白酪氨酸激酶在骨关节炎症的发病机制中可能存在重要作用。本实验使用的genistein是第一个天然的多靶点的受体酪氨酸激酶抑制剂,常用于肿瘤细胞的信号传导机制研究中,对多种蛋白的酪氨酸激酶活性具有抑制作用。实验结果显示,空白对照组关节软骨细胞不产生NO,LPS刺激组表达较高浓度的NO,LPS+不同浓度genistein干预组,则部分抑制NO产生,且与genistein呈现一定的浓度和时间相关性。结合文献报道LPS能通过诱导iNOS表达,合成高浓度NO,推测genistein抑制NO产生的作用可能是通过抑制iNOS表达而实现[13],且抑制程度与genistein浓度和干预时间相关。
[1]Aigner T,McKenna L.Molecular pathology and pathobiology of osteoarthritic cartilage Cell[J].Mol Life Sci,2002,(59):5-18.
[2]Green LC.Analysis of nitrate,nitrite,and nitrate in biological fluids[J].Anal Bio Chem,1982,126:131-138.
[3]Tamamura Y,Iwamato M.Rapid phenotypic changes in passaged articular chondrocyte ubpopulation[J].Clin Calcium,2004,14(7):15.
[4]张志光,郑卫平,苏凯,等.兔关节软骨细胞的分离培养和形态学特征[J].中山大学学报(医学科学版),2004,25(1):63.
[5] Stadler J,Stefanovic RM,Billiar TR.Articular chondrocytes synthesize nitric oxide in response to cytokines and lipopolysaccharide[J].Immunol,1991,147:3915-3920.
[6]钟慈声,孙安阳.一氧化氮的生物医学[M].上海:上海医科大学出版社,1997:15-16.
[7] Karan A,KaranMA,Vural P,et al.Synovial fluid nitric oxide levels in patients with knee osteoarthritis[J].Clin Rheumatol,2003,22(6):397-399.
[8]彭丹,孙材江,周江南.一氧化氮在实验性骨关节炎软骨细胞中的凋亡作用[J].中华风湿病学杂志,2000,4(4):232-234.
[9] Yu Geng,Maier R,Lotz M.Tyrosine kinases are involved with the expression of inducible nitric oxide synthase in human articular chondrocytes[J].Cell Physiol,1995,163:545-554.
[10] Criscavage BS,Wilk S,Ignarro I.Inhibitors of the prolea-some pathway interfere with induction of nitric oxide synthase in macrophageby blocking activation of transcription factor NF-kappa B[J].Proc Natl Acad,1996,93:3308-3312.
[11] Vogel W.Discoidin domain receptors :structural relations and functional implications[J].FASEB,1999,13:77-82.
[12] Jicun W,Houshan L,Xinping L,et al.Functional analysis of discoidin domain receptor 2 in Synovial fibroblasts in rheumatoid arthritis[J].Arthritis Autoimm,2002,19:161.
[13] Lin Xu,Haibing Peng,Dongying Wu,et al.Activation of the discoidin domain receptor 2 induces expression of matrix metalloproteinase 13 associated with osteoarthritis in mice[J].Bio Chem,2005,280(1):548-555.
