开腹及超声引导下深植入法和浅植入法建立兔肝VX2肿瘤模型的比较
2011-05-31陈松旺周云孟凡荣赵美丽
陈松旺,周云,孟凡荣,赵美丽
南京医科大学附属南京第一医院超声科,江苏 南京 210006
兔VX2肝癌模型的建立,常用开腹与超声引导下穿刺接种法,穿刺法较开腹接种法损伤小、并发症少,被国内大多数研究者采用。本研究采用开腹和超声引导下深植入法和浅植入法建立兔肝VX2肿瘤模型,比较2种接种方法的肿瘤接种成功率和异位种植率,寻找更为合适的超声引导下穿刺种植建模方法。
1 资料与方法
1.1 实验动物及材料
选取健康新西兰白兔80只(南京医科大学动物中心提供),体重2.0~2.5kg,雌雄不限。兔VX2肿瘤组织由东南大学医学院提供。组织块接种采用14G穿刺针(日本八光),组织块悬液接种采用18G穿刺针(日本八光)。3%戊巴比妥钠1mL/kg,耳缘静脉注射麻醉。明胶海绵(南京金陵制药厂生产)预先剪碎备用,每块大小1mm3。Philips HDI5000 型彩色多普勒超声诊断仪,探头频率为5~12MHz。
1.2 荷瘤兔制作方法
将冻存的VX2肿瘤组织块复苏后,在超净台内用PBS液冲洗组织块3遍,用眼科剪将组织块剪成大小约1mm3的瘤粒,用配有18G针头的1mL注射器抽吸1mL瘤粒悬浮液,注入兔后腿外侧肌肉内,2周后于接种部位可扪及实质性包块,即制成荷瘤兔。第1只荷瘤兔制作成功后,可取其部分瘤组织,按上述方法制作第2只荷瘤兔。
1.3 肿瘤组织块及组织块悬液制备
取荷瘤兔1只,瘤块所在侧大腿部位备皮消毒,耳缘静脉注射3%戊巴比妥钠(1mL/kg)麻醉后,剪开并分离局部皮肤及皮下组织,剥离肿瘤,将肿瘤完整取出。
1.3.1 肿瘤组织块的制备
用眼科剪将肿瘤边缘灰白色鱼肉样组织,剪成约1mm×1mm×3mm大小的瘤块备用。
1.3.2 肿瘤组织块悬液的制备
用眼科剪将肿瘤组织块剪成大小约1mm3的微块,用18G的穿刺针接上1mL注射器抽吸带有肿瘤组织块和细胞悬液的生理盐水约1mL备用。
1.4 肿瘤肝内接种方法
健康新西兰大白兔80只,随机分为开腹组及超声组(每组40只)。开腹组及超声组再分为组织块组20只(其中,浅植入法10只,深植入法10只)。
肿瘤接种方法如下:
1.4.1 肿瘤组织块组
实验兔术前禁食8h以上,麻醉成功后,仰卧位固定于兔台上,手术常规剪毛,消毒铺巾。开腹组:自剑突下偏左侧切开20mm的切口,钝性分离后,暴露肝脏。用生理盐水湿纱布轻柔地将兔肝左叶拉出体外,14G穿刺针穿入预设深度肝左叶实质内,固定针鞘,拔出针芯,用眼科镊夹将1块剪碎的瘤块放入针鞘内,用平头针芯将瘤块推入肝内,重复2~3次;再用平头针芯将1块明胶海绵推入肝内,重复1~2次,确定接种成功后拔出穿刺针,局部压迫片刻止血,确认无出血后回纳肝脏。切口缝合后碘伏消毒,待兔苏醒后送回兔笼观察。超声组:不需开腹,超声扫查兔左肝,确定穿刺点,在超声引导下用14G穿刺针穿入预设深度肝左叶实质内,固定针鞘,拔出针芯,以下操作同上。种植结束后退出穿刺针。
1.4.2 肿瘤组织块悬液组
操作同1.4.1,抽取肿瘤组织块悬液1mL,开腹及超声导引下穿刺,将悬液注入预设深度肝左叶实质内。
接种完成后,连续3d肌注青霉素5万U/kg,庆大霉素2.5mg/kg(或 0.25 万 U/kg )。
1.4.3 肿瘤种植深度预设
浅植入组:穿刺针穿刺进入兔肝左叶深度≤20mm。深植入组:穿刺针穿刺进入兔肝左叶深度>20mm。
1.5 观察指标
各组分别于接种术后第1周、2周、3周行超声检查,对兔肝肿瘤的形态、大小、内部回声及瘤体血供进行观察,并于3周后处死动物,剖腹观察肿瘤在肝内生长情况及腹腔和腹壁异位种植情况。剖开肿瘤,用10%甲醛溶液固定,常规HE染色观察肿瘤的组织学特征。
1.6 统计学分析
采用SPSS 11.5统计软件包对数据进行分析处理, 计量资料用均数±标准差(±S)表示,两两比较用t检验。各组异位种植率的比较,用x2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 肿瘤肝内接种生长及异位种植
2.1.1 肿瘤肝内接种生长
本实验80只兔,开腹及超声引导下造模,接种后超声观察均可见肿瘤生长,成模率均为100%。
2.1.2 异位种植
组织块深植入组:开腹组及超声组均无异位种植。组织块浅植入组:开腹组无异位种植,超声组1例腹腔种植。组织块悬液深植入组:开腹组无异位种植,超声组2例腹腔种植。组织块悬液浅植入组:开腹组2例腹腔种植;超声组5例腹腔种植,其中1例同时腹腔和腹壁种植。腹腔种植兔腹腔内可见血性腹水。经x2检验:超声组组织块悬液浅植入法较开腹组组织块深植入法和浅植入法、组织块悬液组深植入法,超声组组织块深植入法异位种植率高(P<0.05),余组间异位种植率无统计学差异(P>0.05),见表1。
2.2 接种后肝内肿瘤大小
3周后超声测量肿瘤大小,并进行统计学分析。结果显示:开腹组及超声组组织块组肿瘤体积明显大于组织块悬液组。组织块组肿瘤大小明显大于组织块悬液组。组织块深植入组肿瘤大小与浅植入组比较,无统计学差异。组织块悬液深植入组肿瘤大小与浅植入组比较无统计学差异,见表1。
2.3 肿瘤的超声检查
超声检查兔肝左叶或异位种植的腹腔或腹壁,可探及圆形或类圆形低至中等回声结节, 无包膜,边界欠清楚,周边无低回声晕。当肿瘤内出现部分坏死时,可见部分无回声区(如图1所示)。彩色多普勒检查,可见肿瘤周边及内部血流信号,以周边血供为主,中央血供少,呈星点状、短条状,频谱多普勒可引出动脉样血流信号及静脉样血流信号(如图2所示)。
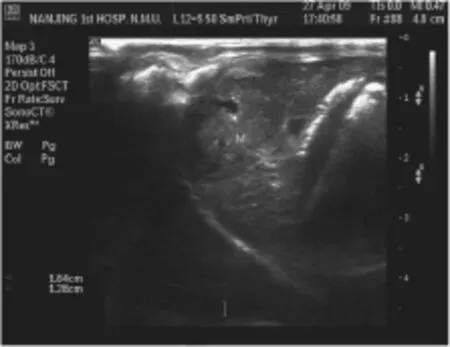
图1 种植兔肝左叶肿瘤二维图像
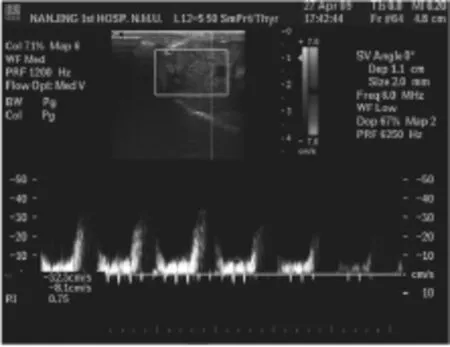
图2 兔肝左叶肿瘤彩色及频谱多普勒图像
2.4 肿瘤的肉眼及病理特点
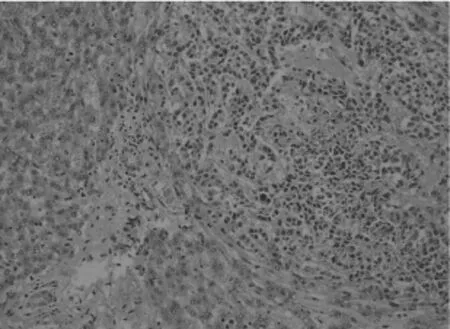
图3 兔肝左叶肿瘤病理(低倍镜下:10×)
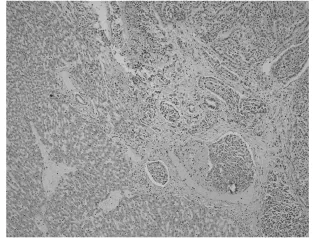
图4 兔肝左叶肿瘤病理(高倍镜下:40×)

表1 组织块组与组织块悬液组
肿瘤在肝实质内呈结节状,无包膜。肿瘤结节呈灰白色,鱼肉样,质硬,其内可见丰富的供瘤血管。光镜下:低倍镜下正常肝组织内见多灶浸润性癌巢,与正常肝实质分界清楚(如图3所示)。高倍镜下瘤细胞呈条索状或腺样排列,细胞呈多边形,胞质较丰富,核圆形或卵圆形,异型明显并可见核分裂象,瘤组织间坏死明显(如图4所示)。
3 讨论
3.1 兔VX2肝癌动物模型
兔VX2肝癌动物模型肿瘤细胞株起源于Shope病毒诱发的兔乳头状瘤衍生的鳞癌,经过72次移植传代后正式建立株,命名为VX2[1]。它可接种在兔的肝脏、肾脏、肌肉等处。病理学上肿块为实体瘤,浸润性生长,血供丰富,可见巨大肿块并瘤周子灶形成,类似于巨块型肝癌。该模型制作简便易行,价格相对低廉,实验周期短[2]。该模型类似人的肝细胞肝癌,常将其用于肝癌诊断、治疗的基础研究[3-4]。
3.2 兔VX2肝癌接种
兔VX2肝癌接种方法主要有瘤细胞悬液接种法和开腹瘤块包埋接种法[5-6]。早期多采用细胞悬液法制作VX2肿瘤模型,但其费用高、费时、费力、种植成功率低,易发生转移和针道种植。开腹瘤组织块种植法虽然其方法简单、成瘤率高、模型性质稳定,但每次接种耗费时间较长,实验动物受手术创伤较大,易发生术后感染、粘连、肿瘤坏死。
本实验结果显示,超声引导下穿刺组织块法及组织块悬液法接种肿瘤,方法简便、可行,创伤小,接种肿瘤成功率高,可取代剖腹手术肝肿瘤接种。但该方法在接种时以超声引导下组织块法深植入法为首选,其次为超声引导下组织块浅植入法及超声引导下组织块悬液法深植入法,不推荐使用超声引导下组织块悬液法植入法。组织块法与组织块悬液法相比,组织块组肿瘤明显大于组织块悬液组。分析其原因可能是植入的组织块悬液由于注射器推注的压力,部分液体逆流到腹腔或腹壁,含瘤细胞的悬液不能全部聚集于肝左叶穿刺部位,同时组织块悬液经稀释后细胞数减少,导致穿刺部位瘤细胞总量及聚集范围变少。
3.3 异位种植发生的原因
肿瘤种植成功的判断:在肝内接种部位出现肿瘤生长,无邻近器官、腹腔及腹壁种植者视为该肿瘤原位种植成功。不论肝内接种部位有无发现肿瘤,在邻近肝脏的其他脏器、腹壁或腹腔内出现肿瘤生长者则视为该接种肿瘤异位种植。本研究中,开腹组组织块悬液浅植入组、超声组组织块浅植入组及组织块悬液深浅植入组都出现了异位种植。异位种植的原因[7-8]:① 经穿刺针道逆流渗漏出的肿瘤细胞流到腹腔或腹壁;② 穿刺接种过程中穿刺针及针芯将肿瘤组织块及液体带出肝组织至腹腔或腹壁;③ 穿刺种植点离肝叶表面较浅,组织块及其液体被挤出肝组织到腹腔或腹壁。
3.4 超声引导下穿刺方法选择
本研究表明,开腹法及超声法接种肿瘤与肿瘤原位种植成功率没有差别。但开腹接种方法兔损伤大,并发症较多,而超声引导下接种,方法简单,创伤小,并发症少。根据本研究结果显示,超声引导下穿刺组织块及组织块悬液接种制作兔肝VX2肿瘤,组织块植入法生长的肿瘤体积大于组织块悬液法,组织块深植入法未出现异位种植。所以,依据本研究结论,推荐超声引导下穿刺组织块深植入法种植肿瘤。
[1]Okada M,Kudo S,Miyazaki O, et al.Antitumoral efficacy and pharmacokinetic p roperties of p irarubicin upon hepatic intra2arterial injection in the rabbit VX2 tumourmodel[J].Br J Cancer,1995,71(3): 518-524.
[2]Paeng JC, Jeong JM, Yoon CJ, et al. Lip iodol solution of 188 Re2HDD as a new therapeutic agent for transhepatic arterial embolization in livercancer: p reclinical study in a rabbit liver cancermodel[J].J NuclMed, 2003,44(12):2033-2038.
[3]王晓东,任军,杨仁杰,等.VX2活细胞数与兔肝癌模型成功率及成瘤时间的关系[J].现代肿瘤医学,2005,13(5):589-591.
[4]吴文娟,崔慧先,李海涛,等.兔VX2肝癌模型的建立及超声观察[J].中华超声影像学杂志.2005,14(2):147-150.
[5]Lin WY,Chen J,Lin Y.Implantation of VX2 carcinoma into t he liver of rabbit s:a comparison of three direct-injection met hods[J].Vet MedSci,2002,64(7):649-652.
[6]Yoon CJ,Chung JW,Park J H,et al.Transcat heter arterial chemoembolization wit h paclitaxel2lipiodol solution in rabbit VX2 liver tumor[J]. Radiology,2003,229(1):126-131.
[7]王晓玲,等.肝血管瘤成像诊断的对比分析[J].中国医疗设备,2010,25(12):132-134.
[8]范义,刘静华,胡卫东,等.兔VX2肝癌模型制作方法的改进[J].中华临床医师杂志(电子版),2008,2(9):1038-1044.
