细柱五加叶中抗HMGB1总三萜活性物质的闪式提取工艺
2011-05-29刘向前郑礼胜翁柳娜邹方卉李丽丽
刘向前 ,郑礼胜,翁柳娜,邹方卉,李丽丽
(1. 中南大学 化学化工学院,湖南 长沙,410083;2. 湖南中医药大学 药学院,湖南 长沙,410208)
五加科五加属植物大都具有很强和广泛的药食用价值,如滋补、抗风湿、抗应激、抗疲劳、抗肿瘤等作用,中、日、韩三国都已把它列入各自国家的药典中,临床用于治疗风湿痹痛、腰膝软弱等病症[1-6]。倪娜等[6-7]对细柱五加叶中的三萜类成分进行了系统研究,分离出了多个lupane型三萜成分,并对它们进行了抗 HMGB1活性筛选,结果显示,五加苷元acankoreanogenin A和五加皂苷acankoreoside A均有较强的抗HMGB1活性,有望成为一种抗HMGB1新药。二次通用旋转试验设计是正交回归组合设计的一种,它克服了二次回归预测值的方差强烈地依赖于实验点在因子空间中的位置这个缺点,可由预测值直接寻找最优区域;采用回归旋转设计实验方法,使在与实验中心点距离相等的点上具有相同的方差,消除了回归系数间的相关性,从而使实验次数大大缩减,计算简便,易于得到多因素的较优组合及变化趋势。由于其具有准确性高、综合性好、系统性强、信息量大等优点,被广泛应用于生产试验和科学试验[8-10]。我国有丰富的细柱五加资源,为新药开发提供了充足的资源保障,但目前尚无其叶中三萜成分的提取工艺和定量研究报道。本文作者采用闪式提取法,通过二次通用旋转实验设计优化其工艺,并确定了UV法测定提取物中总三萜成分含量的条件。
1 材料与方法
1.1 材料、试剂与仪器
材料为细柱五加叶,2008年11月采自湖南,经鉴定为细柱五加(Acanthopanax gracilistylus W. W.Smith)叶,阴干。标本存于中南大学制药工程系标本室。
试剂为五加皂苷、五加苷元对照品,由本研究室自制,经1D和2D-NMR等光谱鉴定后,HPLC测定其含量>99.0%,甲醇、乙醇、NaHCO3均为分析纯。
仪器为:JHBE-20A型闪式提取器(北京金鼐科技有限公司生产),752型紫外可见分光光度计(上海光谱仪器有限公司生产),TG328A型物理天平(湘仪天平仪器厂生产),DZF-6020型真空干燥箱(上海精密仪器实验设备有限公司生产),202-0型电热恒温干燥箱。
1.2 实验方法
1.2.1 提取方法
取细柱五加叶8.0 g,剪成小块(直径<5.0 mm),加提取剂适量,闪式提取[11-12],抽滤,回收溶剂,浓缩,干燥,得干膏。对水分含量进行测定[1],计算干膏得率。
采用三因子五水平二次通用旋转实验设计[13-14]安排实验,所选因素及水平见表 1。实验方案及结果见表2。
1.2.2 总三萜成分的测定
(1) 波长选择。取五加皂苷和五加苷元对照品各10 mg,精密称定,分别置于100 mL容量瓶中,加适量饱和NaHCO3溶液[15],超声溶解,定容,摇匀,得皂苷和苷元对照品的饱和 NaHCO3溶液。以饱和NaHCO3溶液为空白样,在190~400 nm波长下扫描,皂苷和苷元最大吸收波长分别为218和214 nm。但在饱和NaHCO3溶液中皂苷比苷元更易溶解,且溶液较稳定,故选择五加皂苷为测定用的对照品,检测波长为218 nm。
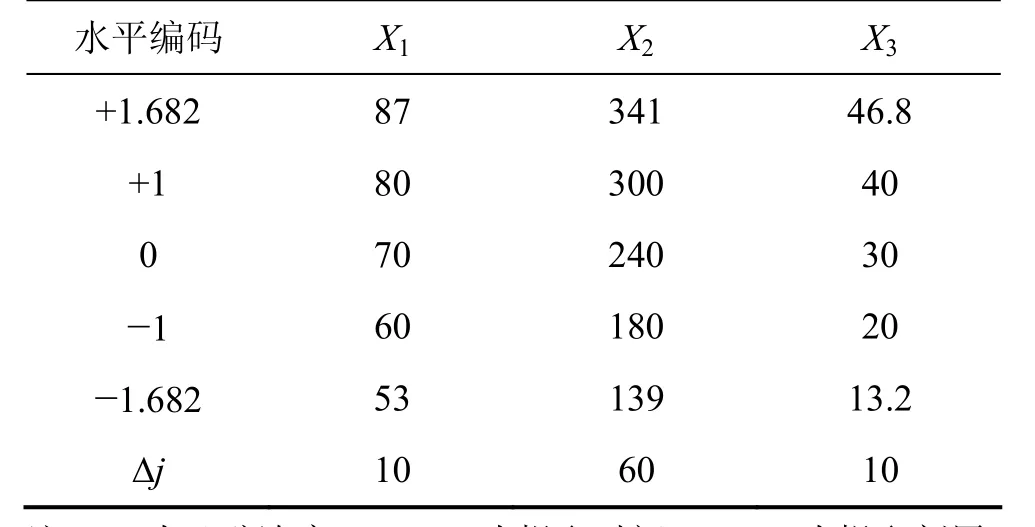
表1 因素水平表Table 1 Factors and coded levels
(2) 对照品溶液的配制。取五加皂苷对照品 10 mg,精密称定,置于100 mL容量瓶中,饱和NaHCO3溶液溶解,定容,摇匀,即得五加皂苷对照品溶液,并测得它的紫外光谱,见图1。
(3) 供试品溶液的配制。取1.2.1项下的样品干膏0.1 g左右,精密称定,加适量饱和NaHCO3溶液,超声溶解,冷却,定容至100 mL,并测得它的紫外光谱,见图2。
(4) 标准曲线的绘制。分别精密移取五加皂苷对照品溶液1,2,3,4,5,6,7 mL于7只10 mL容量瓶中,饱和NaHCO3溶液定容,测定218 nm处吸光度。五加皂苷对照品溶液的标准曲线如图3所示。
从图3可见:在0.01~0.07 g/L范围内,五加皂苷浓度与吸光度成线性,拟合曲线Y=12.275X+0.042 14,相关系数为R=0.999 6。
(5) 精密度实验。取五加皂苷对照品溶液,稀释2.5倍,以饱和NaHCO3溶液做空白样,218 nm下测定其吸光度,重复5次;相对标准偏差RSD为0.67%,表明仪器精密度高。
(6) 重现性实验
取表2中16号样品5份,配制供试品溶液;以饱和NaHCO3溶液做空白样,在波长为218 nm下分别测定其吸光度,RSD为1.22%,表明该方法可靠。
(7) 稳定性实验。取表2中16号样品配制供试品溶液;以饱和NaHCO3溶液做空白样,在波长为218 nm下每隔1.5 h测量1次吸光度,共5次,RSD为0.74%,表明样品在6 h内稳定,满足含量检测要求。
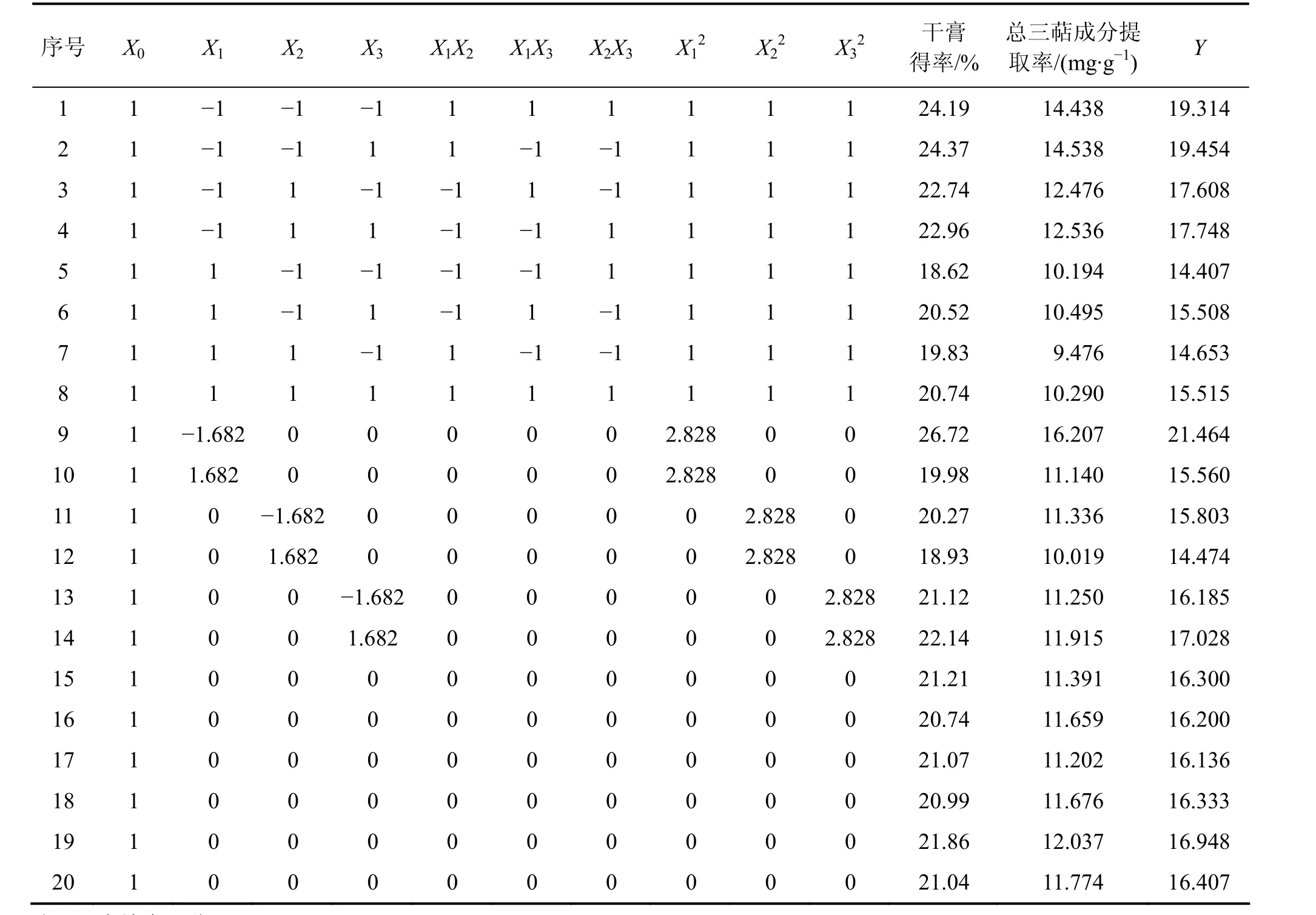
表2 三因素二次通用旋转实验设计及结果Table 2 Three-factor second order rotation combination experimental design and results
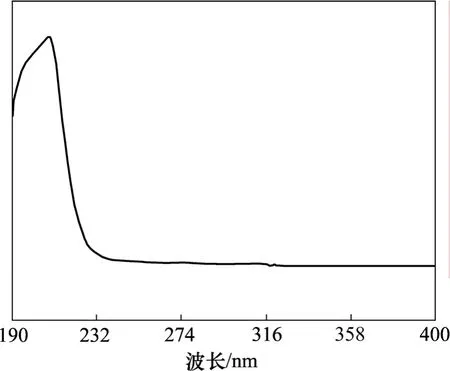
图1 五加皂苷对照品的紫外光谱Fig.1 UV spectrum of standard acankoreoside A
(8) 加样回收实验。取表2中17号样品0.05 g左右5份,精密称定,分别加入一定量的五加皂苷标准品,配制供试品溶液;以饱和NaHCO3溶液做空白样,218 nm下分别测定吸光度,计算总皂苷含量,并计算出回收率为98.2%,RSD为1.23%,表明该方法回收率较高。
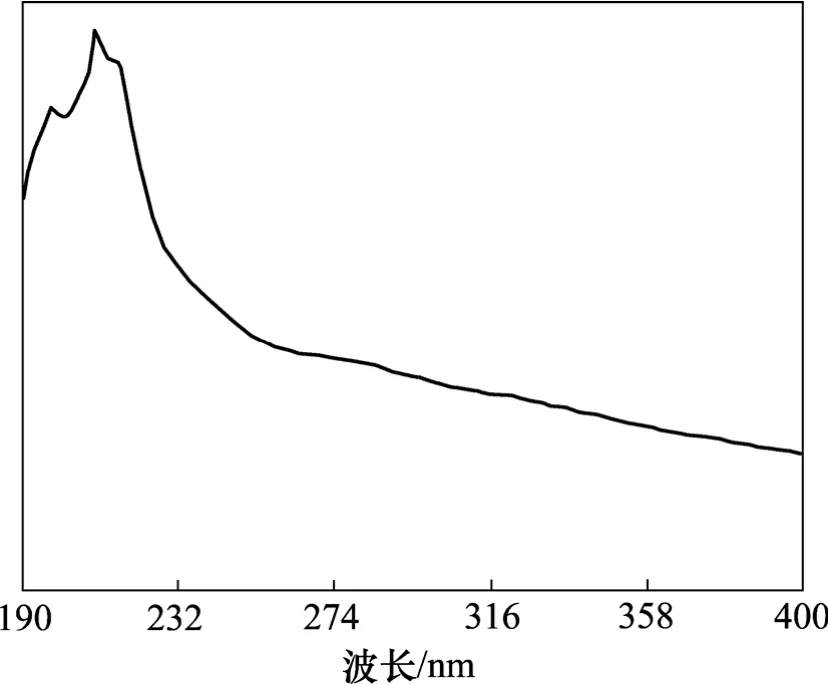
图2 样品中五加皂苷的紫外光谱Fig.2 UV spectrum of acankoreoside A in sample
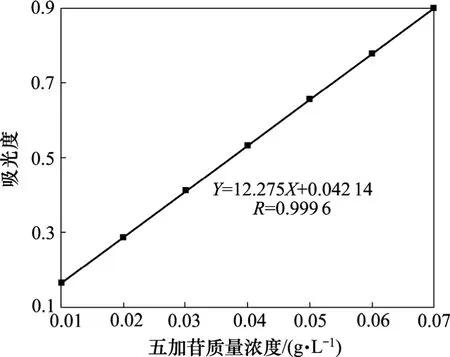
图3 五加皂苷的标准曲线Fig.3 Calibration curve of acankoreoside A
(9) 总三萜成分提取率的测定。制备供试品溶液;以饱和NaHCO3溶液做空白样,测定218 nm下各样品的吸光度,根据标准曲线计算总三萜成分浓度;再根据干膏量,计算出总三萜成分提取率。
2 结果与分析
2.1 回归模型的建立及显著性检验
三因素二次通用旋转实验设计及结果见表2。
以综合评分Y为因变量,3因素Xi的编码值为自变量,对实验所得数据(见表2)进行多元分析,得回归方程:
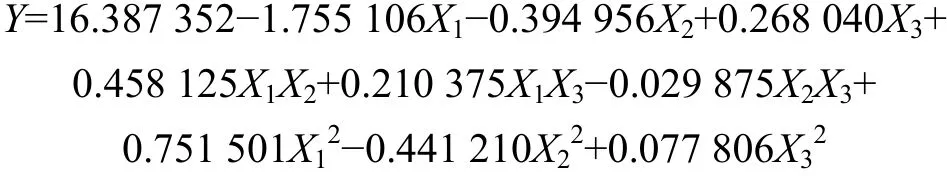
对上述方程及各因素的方差分析见表3。
由表 3可以看出:失拟检验 F1=-0.125 07<F0.05(5,5)=5.05,差异不显著,说明未控制因素对实验结果干扰很小,拟合不足被否定;拟合检验 F2=165.301 55>F0.01(9,10)=4.95,达到极显著水平;复相关系数R2=0.993 3,校正复相关系数Radj2=0.987 3,均说明该方程与实际情况拟合良好,正确反映了综合评分与乙醇浓度、提取时间和提取剂用量与五加叶质量之比的关系。
各实验因子的偏回归系数的检验结果表明:X1,X2,X3,X1X2,X12,X22,X32的偏回归系数均达到极显著水平,这些因素对综合评分的影响极显著,而且不是简单的线性关系;交互项X2X3未达到显著水平,但由于各系数间具有相关性,微弱的交互项原则上不能删除,因此,方程不能简化[16]。
2.2 主因子效应分析
由于回归模型本身已经过无量纲编码代换,其偏回归系数已经标准化,故可直接从其绝对值来判断各因子对目标函数的相对重要性,即一次项系数的绝对值可反映3因素对综合评分的影响程度,由回归方程可知3因素的影响程度从大到小依次为:乙醇浓度,提取时间,提取剂用量与五加叶质量之比。
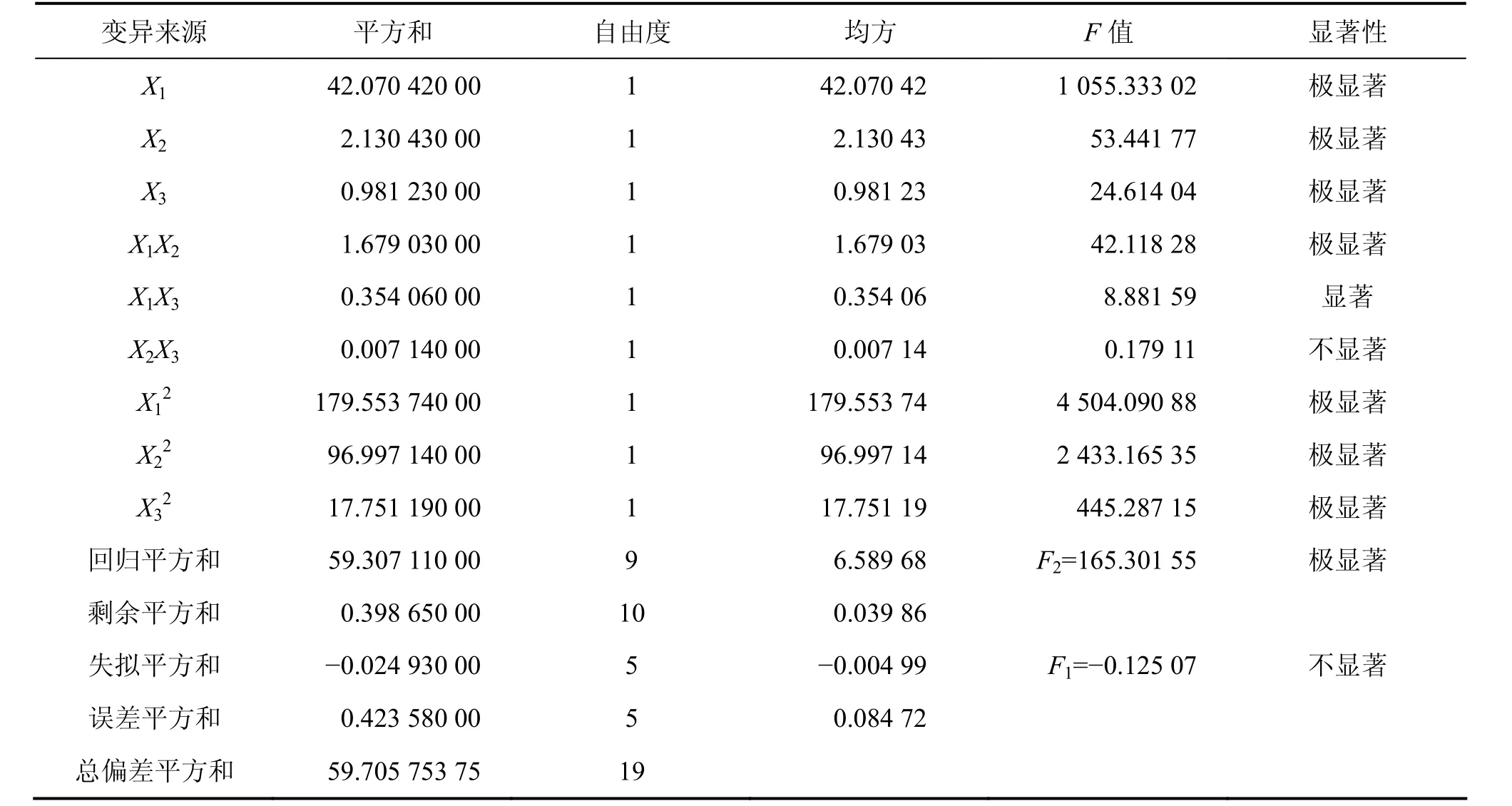
表3 试验结果方差分析表Table 3 Analysis of mean square deviation for experiment data
2.3 单因子效应及其边际效应分析
分别将回归方程中的2个变量固定在零水平,进行降维分析,即可得到3个以其中1个因素为决策变量的偏回归模型:
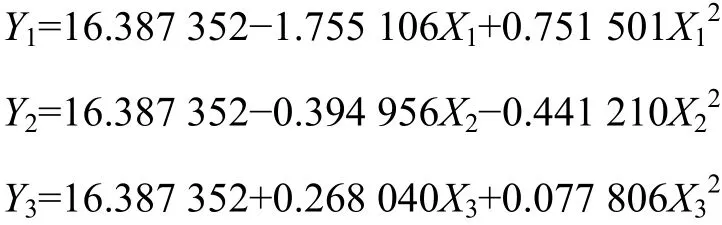
根据单因子效应方程作图,得到单因子效应曲线(图 4)。经计算,当 X1=-1.682,X2=-0.4476,X3=1.682,即乙醇浓度为53%,提取时间为213 s,提取剂用量与五加叶质量之比为46.8时,各单因素对综合评分的影响最大,最大值分别为 Y1max=21.465,Y2max=16.476,Y3max=17.058。
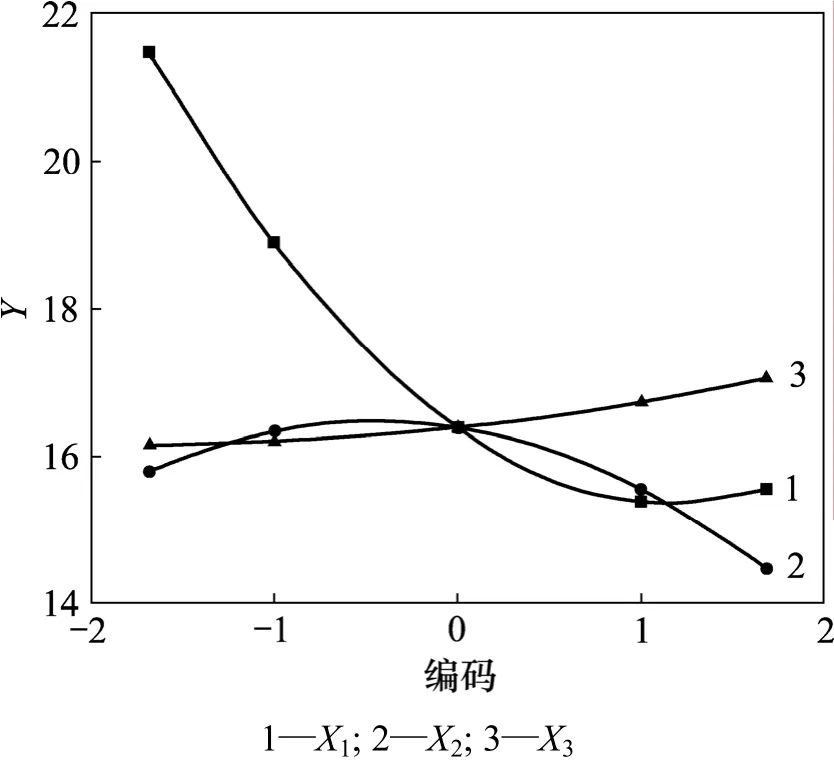
图4 单因子效应曲线Fig.4 Single factor utility curves
对单因子效应方程求一阶偏导数,得到单因子边际效应方程。单因子边际效应方程反映了综合评分随不同因子编码值的变化速率。单因子效应方程为:

根据单因子边际效应方程可以得到单因子边际效应曲线(图5)。由图5可知,3条曲线斜率的绝对值依次为:X1>X2>X3,说明乙醇浓度的变化对综合评分的影响最大,提取时间次之,提取剂用量与五加叶质量之比最小,与主因子效应分析结果一致。
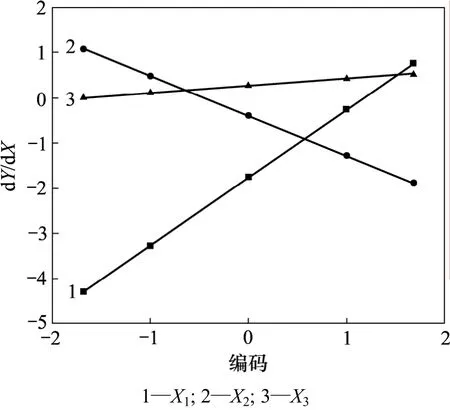
图5 单因子边际效应曲线Fig.5 Marginal utility curves
2.4 因子的交互效应分析
为了观察2个因素同时对综合评分的影响,可以进行降维分析。令其中1个因素的水平为0,就可得到另外2个因素对综合评分影响的二元二次方程:

根据方程分别绘制响应面三维图和等高线图,结果如图6~11所示。
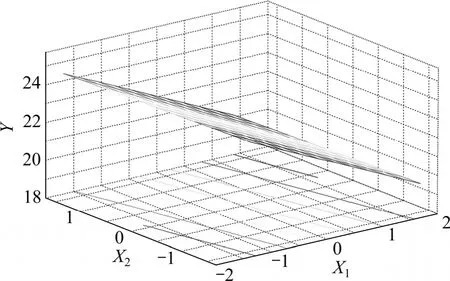
图6 乙醇浓度和提取时间响应面图Fig.6 Response of surface of alcohol level and extraction time
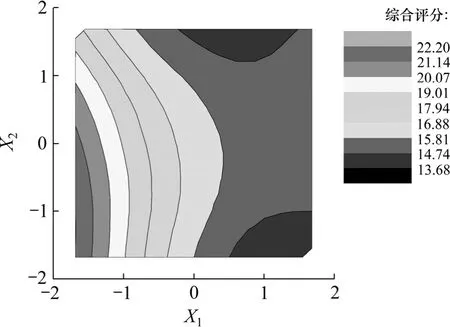
图7 乙醇浓度和提取时间等高线图Fig.7 Contour line of alcohol level and extraction time
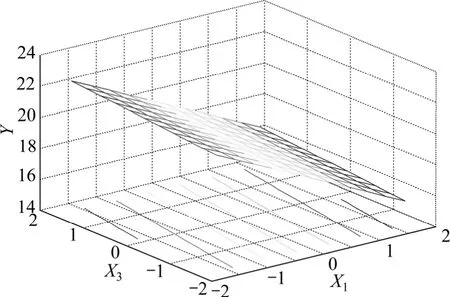
图8 乙醇浓度和提取剂用量与五加叶质量之比响应面图Fig.8 Response of surface of alcohol level and extracting agent concentration
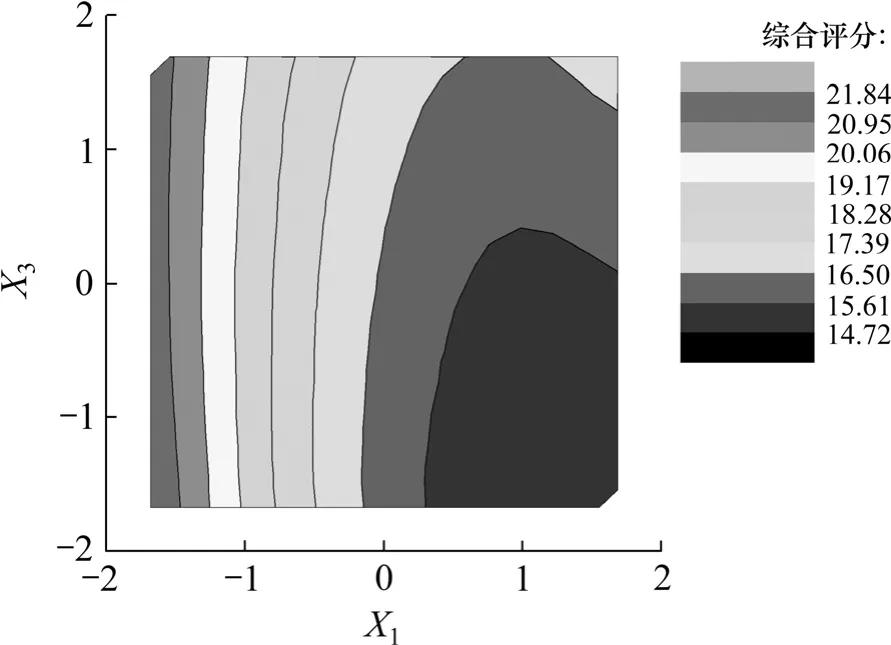
图9 乙醇浓度和提取剂用量与五加叶质量之比等高线图Fig.9 Contour line of alcohol level and extracting agent concentration
图6 和图7反映了乙醇浓度X1和提取时间X2之间的交互作用。当 X2处于编码值范围内时,Y随 X1的减小而显著增大;当X1处于低编码值范围内时,Y随X2的减小也呈增大趋势;因此,乙醇浓度和提取时间两者具有显著协同作用。
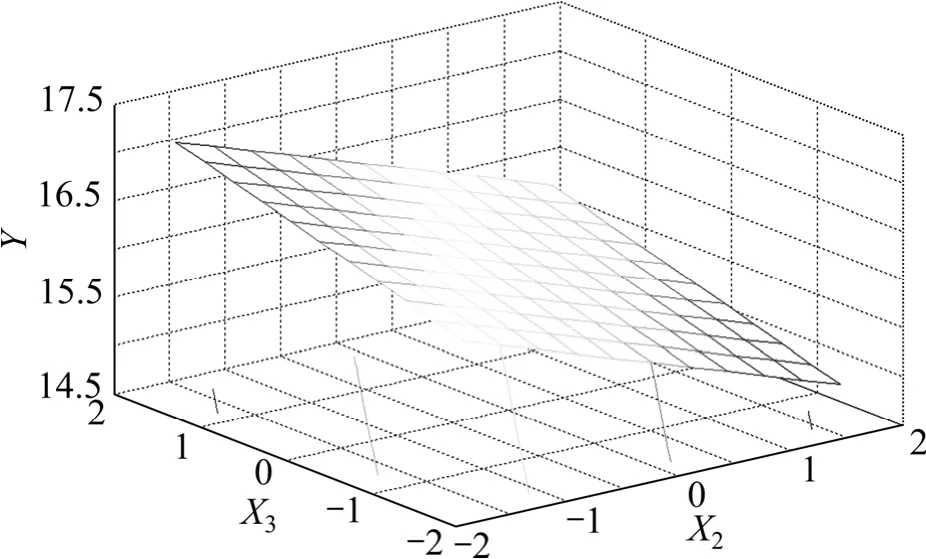
图10 提取时间和提取剂用量与五加叶质量之比响应面图Fig.10 Response of surface of extraction time and extracting agent concentration
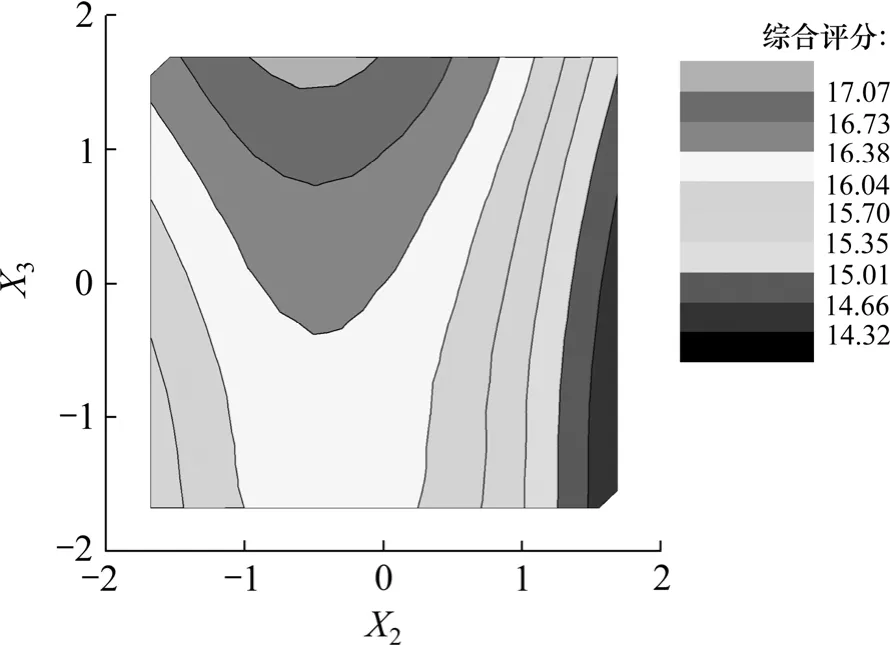
图11 提取时间和提取剂用量与五加叶质量之比等高线图Fig.11 Contour line of extraction time and extracting agent concentration
图8 和图9反映了乙醇浓度X1和提取剂用量与五加叶质量之比 X3的交互作用。当X3处于编码值范围内时,Y随X1的减小而显著增大;当X1处于较低编码值范围内时,Y随X3的减小只有微弱变化;因此,乙醇浓度和提取剂用量与五加叶质量之比两者之间的协同作用不明显。
图10和图11反映了提取时间X2和提取剂用量与五加叶质量之比 X3的交互作用。由于交互项 X2X3未达到显著水平,故不进行具体讨论。
2.5 数学模型寻优
利用回归方程,在试验约束区域内(-1.682≤X1≤1.682,-1.682≤X2≤1.682,-1.682≤X3≤1.682),取步长为0.116,通过MATLAB编程,进行计算机模拟仿真选优(实验次数N=30),得到27 000套方案的模拟结果,从中筛选出综合评分≥22.000的组合方案326套,占1.21%,Xi的频率分布解析见表4。
由表4可以看出,当X1为-1.682,X2=-1.278 3~-0.927 1,X3=-0.558 4~0.408 2时,综合评分有95%的可能性高于22.000。此时,相应的解码值为:乙醇浓度为53%,提取时间为163.3~184.4 s,提取剂用量与五加叶质量之比为24.4~34.1。
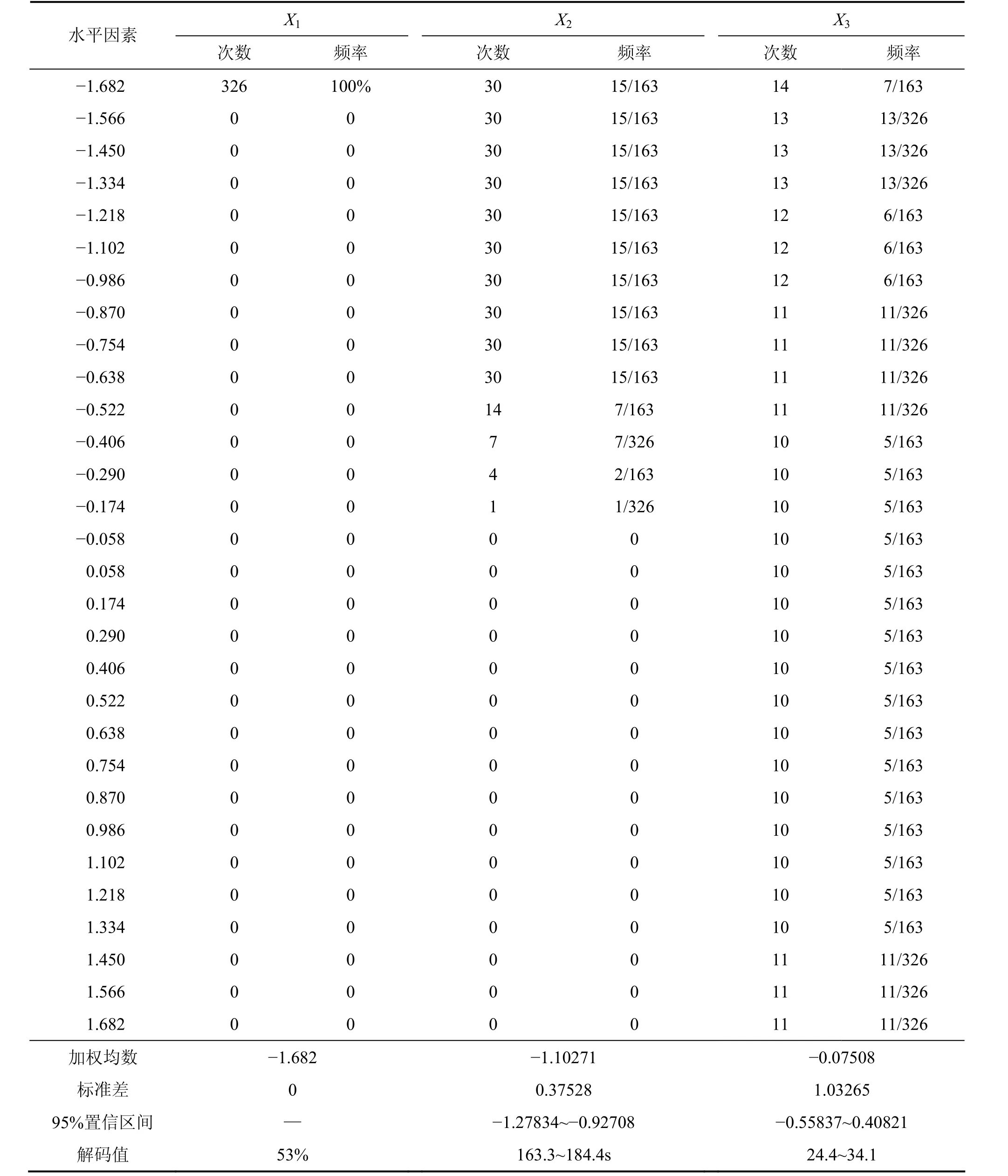
表4 综合评分≥22.000的优化提取方案中Xi取值频率分布Table 4 Probability distribution of Xi in combined application
2.6 最佳工艺参数的确定与回归模型的验证
考虑到可操作性及贴近实际工业化生产,将最优提取条件定为:乙醇浓度53%,提取时间175 s,提取剂用量与五加叶质量之比为30 mL/g。
为验证上述优选出来的工艺,按数据分析得出的最优提取条件进行验证实验,结果如表5所示。
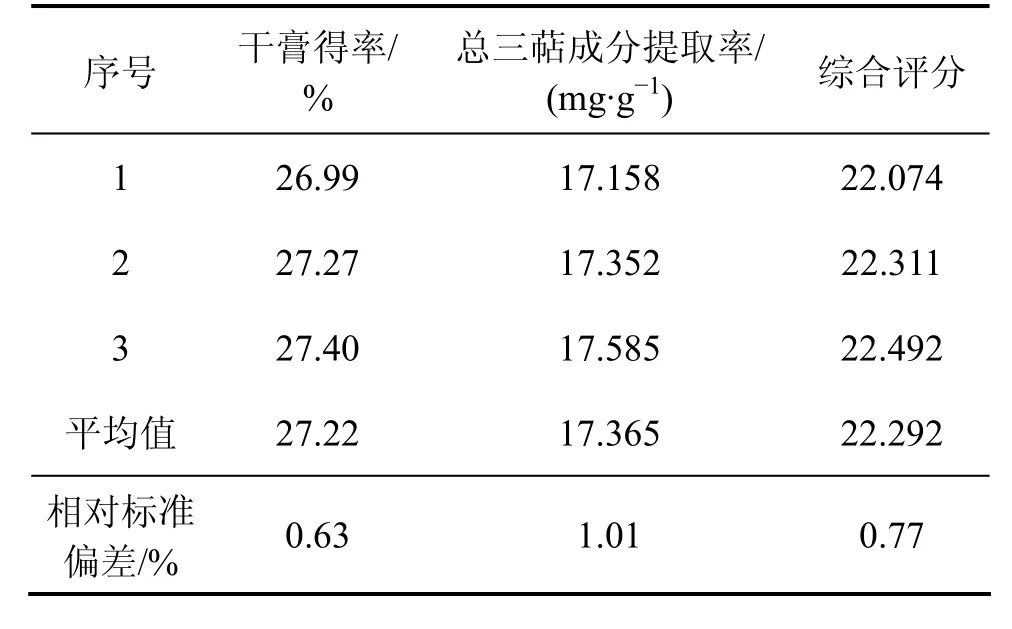
表5 最佳工艺验证实验结果Table 5 Confirmatory experiment result of the best technique
由表5可知:该工艺的综合评分为22.292,RSD=0.77%。与表 2实验结果相比,该工艺的综合评分高于优化实验中的任何一组,且该工艺稳定,重现性好,操作简单、省时。
3 讨论
闪式提取法是中药提取领域的一项新技术,其原理是在适当溶剂存在下,利用高速机械剪切力和搅拌力,迅速破坏植物细胞组织,使组织细胞内部的化学成分(或有效成分)与溶剂充分接触,使有效成分快速溶解转移,在很短时间内达到内外溶解平衡,然后过滤即可。其所用时间仅为常规回流提取的数十至数百分之一,而且避免了不耐热成分的破坏,且收率高,操作简便,节约溶剂和能源[11-12]。
在溶剂和波长的选择中,分别考察了甲醇法和NaHCO3饱和溶液法[15]。结果发现:甲醇法波长扫描后得到的是倒峰,没有出现特定吸收峰,故不能选择甲醇作为测定细柱五加叶中三萜类物质的溶剂;在NaHCO3饱和溶液中,五加皂苷的最大吸收峰(218 nm)与其苷元的(214 nm)非常接近,不能同时或分别测定它们的含量,只能测定三萜成分的总含量。研究表明,叶中皂苷含量远大于苷元含量[6],皂苷在饱和NaHCO3溶液中比苷元易溶,且溶液较稳定,故选择五加皂苷为测定用的对照品,检测波长为218 nm。
4 结论
(1) 采用闪式提取法提取细柱五加叶中三萜成分,并用二次通用旋转实验设计优化其提取工艺,结果得到最佳工艺如下:乙醇浓度为53%,提取剂用量与五加叶质量之比为30 mL/g,提取时间为175 s。验证实验结果表明:该工艺稳定,重现性好,操作简单、省时。
(2) 确定了 UV法测定细柱五加叶及其提取物中总三萜成分的方法为以五加皂苷为对照品,饱和NaHCO3溶液为溶剂,218 nm为最适波长。该方法稳定可靠,易于操作,可用于细柱五加叶、五加皮以及其同属植物中总三萜成分含量的测定。
[1] 中华人民共和国药典委员会. 中华人民共和国药典: 一部[M].北京: 化学工业出版社, 2010: 192-193.Committee of Chinese Pharmacopeia. Chinese pharmacopeia: Ⅰ[M]. Beijing: Chemical Industry Press, 2010: 192-193.
[2] Chau C F, Wu S H. The development of regulations of Chinese herbal medicines for both medicinal and food uses[J]. Trends in Food Science & Technology, 2006, 17(6): 313-323.
[3] 咸丽娜, 李振麟, 钱士辉. 细柱五加茎中的一个新的贝壳杉烷型二萜苷[J]. 中草药, 2010, 41(11): 1761-1763.XIAN Li-na, LI Zhen-lin, QIAN Shi-hui. One new ent-kaurane glycoside from stems of Acanthopanax gracilistylus[J]. Chinese Traditional and Herbal Drugs, 2010, 41(11): 1761-1763.
[4] 倪娜, 刘向前. 五加科五加属植物的研究进展[J]. 中草药,2006, 37(12): 1895-1900.NI Na, LIU Xiang-qian. Advances in studies on plants of Acanthopanax Miq. in Araliaceae[J]. Chinese Traditional and Herbal Drugs, 2006, 37(12): 1895-1900.
[5] 李志峰, 杨金火, 张武岗, 等. 刺五加的化学成分研究[J]. 中草药, 2011, 42(5): 852-855.LI Zhi-feng, YANG Jin-huo, ZHANG Wu-gang, et al. Chemical constituents from Acanthopanax senticosus[J]. Chinese Traditional and Herbal Drugs, 2011, 42(5): 852-855.
[6] 倪娜. 细柱五加叶及其同属植物活性成分研究[D]. 长沙: 中南大学化学与化工学院, 2008: 3-37.NI Na. Studies on the active ingredient from the leaves of Acanthopanax gracilistylus W.W.Smith and Acanthopanax Miq.Plants[D]. Changsha: Central South University. School of Chemistry and Chemical Engineering, 2008: 3-37.
[7] LIU Xiang-qian, Chang S Y, Yook C S. Lupane-triterpenoids from the leaves of Acanthopanax gracilistylus[J]. Journal of Lanzhou University: Natural Sciences, 2006, 42(4): 86-91.
[8] 刘红波, 陆刚, 边宽江. 几种实验设计方法的比较[J]. 安徽农业科学, 2007, 35(36): 11738-11739.LIU Hong-bo, LU Gang, BIAN Kuan-jiang. Comparison among several methods of experimental design[J]. Journal of Anhui Agricultural Science, 2007, 35(36): 11738-11739.
[9] 郑礼胜. 京尼平苷的酶解工艺及其产物的降糖活性研究[D].长沙: 中南大学化学与化工学院, 2010: 36-46.ZHENG Li-sheng. Enzymatic hydrolysis of geniposide and hypoglycemic activity of its product[D]. Changsha: Central South University. School of Chemistry and Chemical Engineering, 2010: 36-46.
[10] 李永强, 杨士花, 毕晓菲, 等. 二次通用旋转试验设计优化三角梅红色素提取工艺的研究[J]. 中国食品添加剂, 2010(5):68-72.LI Yong-qiang, YANG Shi-hua, BI Xiao-fei, et al. Study on optimizing the extraction of Bougainvillea Spectabilis willd red pigment by the quadratic general rotary design[J]. China Food Additives, 2010(5): 68-72.
[11] 刘延泽. 植物组织破碎提取法及闪式提取器的创制与实践[J].中国天然药物, 2007, 5(6): 401-407.LIU Yan-ze. Principle and practice of smashing tissue extraction and herbal blitzkrieg extractor[J]. Chin J Nat Med, 2007, 5(6):401-407.
[12] 贺石麟, 牛景霞, 倪艳. 淫羊藿中淫羊藿苷和总黄酮的闪式提取工艺[J]. 中国实验方剂学杂志, 2011, 17(8): 38-40.HE Shi-lin, NIU Jing-xia, NI Yan. Study on flash-type extraction process for total flavonoids and leariin from Herba Epimedii[J].Chinese Journal of Experimental Traditional Medical Formulae,2011, 17(8): 38-40.
[13] 潘丽军, 陈锦权. 试验设计与数据处理[M]. 南京: 东南大学出版社, 2008: 232-237.PAN Li-yun, CHEN Jin-quan. Experiment design and data processing[M]. Nanjing: Southeastern University Press, 2008:232-237.
[14] Montgomery D C. 实验设计与分析[M]. 傅珏生, 张健, 王振羽, 等译. 北京: 人民邮电出版社, 2009: 319-343.Montgomery D C. Design and analysis of experiments[M]. FU Jue-sheng, ZHANG Jian, WANG Zhen-yu, et al, trans. Beijing:Posts & Telecom Press, 2009: 319-343.
[15] 黄书铭, 杨新林, 黄建, 等. 紫外分光光度法快速测定灵芝样品中三萜类化合物的含量[J]. 北京理工大学学报, 2004, 24(6):555-558.HUANG Shu-ming, YANG Xin-lin, HUANG Jian, et al. Method for the rapid quantification of triterpenoids in Ganoderma Lucidum by ultraviolet spectrometry[J]. Transactions of Beijing Institute of Technology, 2004, 24(6): 555-558.
[16] 卢恩双, 宋世德, 郭满才. 回归通用旋转设计的几个问题[J].西北农林科技大学学报: 自然科学版, 2002, 30(5): 110-113,120.LU En-shuang, SONG Shi-de, GUO Man-cai. Problems in second-order regression general rotation analysis[J]. Journal of Northwest Sci-Tech University of Agriculture and Forestry:Natural Science Edition, 2002, 30(5): 110-113, 120.
