百草枯中毒大鼠肺TGF-β1和c-Jun的表达及姜黄素的干预作用
2011-05-25吴伟刘莹胡明于淼淼
吴伟,刘莹,胡明,于淼淼
(1.中国医科大学附属第一医院急诊科,沈阳 110001;2.天津医科大学总医院急诊科,天津 300000;3.北京306医院急诊科,北京100101;4.辽宁省肿瘤医院重症监护病房,沈阳 110001)
百草枯(paraquat,PQ)是目前世界范围内广泛使用的除草剂,化学名称为 1,1′-二甲基-4,4′-联吡啶二氯化物。其毒性高,服用PQ自杀的患者死亡率达73.4%。大剂量PQ中毒者可在短期内出现多脏器功能障碍,这是PQ中毒患者早期死亡的主要原因[1],而度过急性期的患者多死于肺纤维化[2]。PQ中毒致肺纤维化的机制尚未阐明,迄今仍无特效治疗药物。姜黄素(curcumin)具有抗炎、抗氧化、抗肿瘤等药理作用。近期研究发现它有抗纤维化作用,可减轻博来霉素和胺碘酮所致肺纤维化、减少肺组织胶原沉积[3]。本文通过观察姜黄素减轻PQ中毒大鼠肺间质纤维化,探讨其作用机制。
1 材料与方法
1.1 实验材料
8周龄清洁级Wistar雄性大鼠80只,体质量200~300 g,购自中国医科大学实验动物中心。PQ 20%水溶液(商品名克无踪),购自先正达南通作物保护有限公司。原癌c-jun基因抗体、转化生长因子β1(transforming growth factor-β1,TGF-β1)抗体,购自美国SANTA CRUZ公司。SP-9001免疫组化试剂盒,购自北京中杉金桥生物技术有限公司。羟脯氨酸(hydroxyproline,HYP)测试盒,购自南京建成生物工程研究所。姜黄素(货号C1386),购自美国Sigma-Aldrich公司。
1.2 实验方法和步骤
1.2.1 实验动物分组:将80只大鼠饲养1周后,随机分为PQ中毒组(PQ组)和姜黄素干预组(PC组),每组40只。PQ组和PC组动物按观察时点(1、3、7、14和21 d)分成5个亚组。在相同条件下饲养,自由进食水。
1.2.2 动物模型的建立:20%PQ溶液蒸馏水稀释20倍,配置成浓度为10 mg/ml溶液,避光保存。姜黄素用玉米油混悬,配置成100 mg/ml浓度的混悬液。造模前,各组大鼠禁食水10 h。PQ组和PC组大鼠按50 mg/kg一次性灌胃染毒[4]。灌胃给药途中未有呕吐、抽搐或未完全灌入所需药量等情况。灌胃后2 h,PC 组大鼠按 200 mg·kg-1·d-1给予姜黄素 1 次腹腔内注射,PQ组大鼠按体质量给予相应体积生理盐水腹腔内注射,最长给药时间21 d。每日上午固定时间给药。造模后,各组动物饲养条件如前,每日上午固定时间测定动物体质量。观察动物进食、进水、排泄情况,有无精神反应迟钝、毛蓬松、毛色黯淡、鼠尾紫绀、呼吸困难及干湿啰音、攻击性降低、死亡等情况。在灌胃后1、3、7、14和21 d,各组到达各自观察终点的实验动物称质量。
1.2.3 麻醉及取材:10%水合氯醛300 mg/kg腹腔麻醉。麻醉充分后将大鼠仰卧于鼠台上固定,开胸,完整取出两侧肺组织,观察肺组织颜色、质地、有无出血及梗死灶等大体病理变化。生理盐水清洗后滤纸吸干表面水分,称量肺湿质量,计算肺系数,肺系数=肺质量(mg)/体质量(g)。右肺叶4%多聚甲醛固定,用于检测 TGF-β1、c-Jun及 HE 染色、Masson染色,左肺叶液氮速冻后置于-80°C冰箱保存用以检测HYP。
1.2.4 肺部组织学检查:取固定的肺组织,常规脱水、透明、浸蜡、石蜡包埋、连续切片备用(HE染色、Masson染色、免疫组织化学染色)。Masson染色结果判定以呈绿色(或蓝色)为胶原纤维,用病理图像分析仪进行灰度面积扫描,取阳性面积百分比作为肺纤维化程度的半定量参数。
1.2.5 肺组织HYP测定:采用样本碱水解法。
1.2.6 肺组织TGF-β1及c-Jun表达的免疫组化染色及半定量分析:TGF-β1免疫组化结果以胞质出现棕色或棕黄色为阳性,c-Jun免疫组化结果以胞质及胞核出现棕色或棕黄色为阳性。在200倍镜下用图像分析系统测量其光密度,每张切片随机检测5个视野,然后计算出平均光密度(mean optical density,MOD)值,以 MOD 作为 TGF-β1、c-Jun 表达水平半定量参数。
1.3 统计学分析
所有数据采用SPSS12.0软件进行统计处理。计量资料以x±s表示,两组间均数比较采用t检验,多组间均数比较采用单因素方差分析,两组间率的比较用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 实验动物一般情况观察结果
PQ组动物在一次性灌胃染毒后30 min~2 h逐渐出现中毒反应,出现呼吸急促、进食进水量减少或不进食水、精神反应差、行为灵敏度降低、行动协调性差、攻击性低、少动、毛蓬松、毛色污秽、鼠尾发绀、口鼻可见血性分泌物、腹泻等表现。中毒表现以1~3 d最明显。实验动物均出现体质量下降或不增,甚至部分动物在1~3 d可闻及较明显的干湿啰音。PC组动物染毒后中毒反应较PQ组明显减轻,进食水较正常,体质量下降不明显,未见腹泻及口鼻出血,精神好,反应较灵敏,毛色较洁净,较少出现呼吸急促、鼠尾发绀等表现。
2.2 动物的生存率差异
21 d后,PQ组动物生存率为35%,PC组生存率为67%,经χ2检验两组生存率的差异有统计学意义(χ2=6.040,df=1,P<0.05)。
2.3 动物的肺组织病理学表现
2.3.1 大体组织观察:PQ组1 d肺组织色红、充血、肿胀、弹性差,肺叶可见弥漫性出血点或大块出血梗死灶;3 d肺组织色暗红,质硬,肝样变,亦可见弥漫性出血或梗死灶,部分动物可见胸腔积液;7 d可见肺脏肿胀减轻,颜色变浅,可见散在出血点、片状透明样变;14 d肺脏呈灰白色,肿胀基本消退,有斑点状陈旧出血点;21 d双肺苍白,肺弹性差,硬度增加,表面有索条状凹沟,可见小囊形成。PC组各时点肉眼变化与PQ组相近,但程度较轻;1 d时肺组织轻度充血,色粉红,体积略增大,部分可见点状出血灶;3 d肺组织肿胀较轻,色稍暗,部分可见弥漫性出血点或片状梗死灶,未见胸腔积液;7 d双肺淡红,体积稍增大,表面散在出血点;14 d双肺淡红,局部可见陈旧出血点;21 d双肺体积无明显改变,硬度稍增加,表面较光滑,部分可见散在小结节。
2.3.2 肺系数:PQ组与PC组比较,肺系数的差异无统计学意义(P>0.05)。见表1。
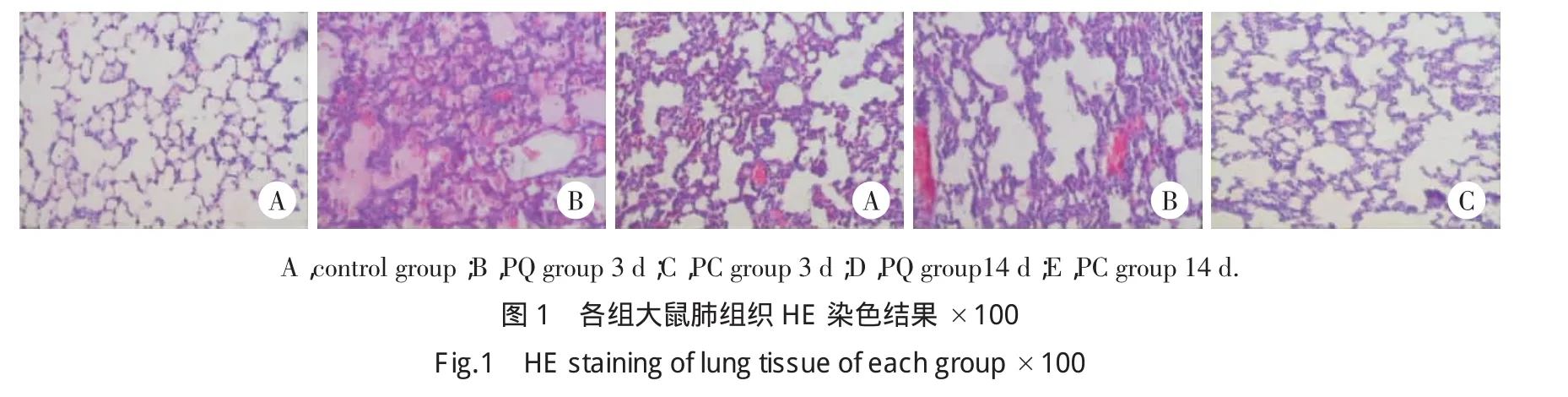
2.3.3 HE染色光镜下病理表现:PQ组染毒后1 d可见肺泡壁毛细血管扩张、充血,气管及血管周围有不同程度的水肿,肺内小灶状或大片状炎性细胞浸润;3 d肺间质和肺泡水肿达高峰,部分肺泡腔充满粉染均质水肿液,部分有透明膜形成,弥漫性肺出血,肺泡腔塌陷,肺泡腔内大量游离的中性粒细胞和巨噬细胞;7 d肺泡炎性表现较前有所减轻,但仍有出血及水肿,可以见到成纤维细胞;14 d成纤维细胞增生,肺泡间隔明显增宽,有胶原沉积及斑片状的纤维化改变;21 d病变范围弥散,大量肺泡结构萎陷、破坏,大量胶原沉积,肺泡间隔以及部分肺泡腔被胶原和纤维蛋白占据,偶见部分残存的肺泡腔过度膨胀,出现代偿性肺气肿。PC组各时点病理变化较PQ组相似,但程度较轻;1 d时可见肺泡壁毛细血管充血,肺内小灶状炎性细胞浸润,肺组织结构较正常;3 d部分肺组织可见水肿液,肺泡腔内可见出血及炎细胞浸润,周围较多正常肺组织;7 d见陈旧出血灶,炎细胞少,可见成纤维细胞;14和21 d少量肺泡萎陷,可见胶原沉积,周围较多正常肺组织。见图1。
2.3.4 肺组织Masson染色:在支气管周围及肺泡间隔区可见蓝染胶原。1、3、7 d PQ组无明显胶原增生,与PC组比较Masson染色阳性面积百分比(蓝染胶原面积/组织整体面积)的差异无统计学意义(P>0.05)。14和21 d PQ组蓝染胶原沉积明显增多,与PC组比较Masson染色阳性面积百分比差异有统计学意义(P<0.05)。见图 2,表 1。

2.4 肺组织HYP含量测定结果
PC组与PQ组相比HYP含量减少,14和21 d两组差异有统计学意义(P<0.05,P<0.01)。见表1。
2.5 肺组织TGF-β1免疫组化结果及半定量分析
中毒7 d后TGF-β1的MOD值显著增高,PQ组14 d TGF-β1达峰值。PQ与PC组比较,14 d和21 d两组的差异有统计学意义(P<0.01)。见图3,表1。
2.6 肺组织c-Jun免疫组化结果及半定量分析
1、3、7 d两组大鼠肺组织内c-Jun的MOD明显增高,14 d后明显回降。3和7 d PC组肺组织内c-Jun MOD值较PQ组降低,但差异无统计学意义(P>0.05)。见图 4,表 1。
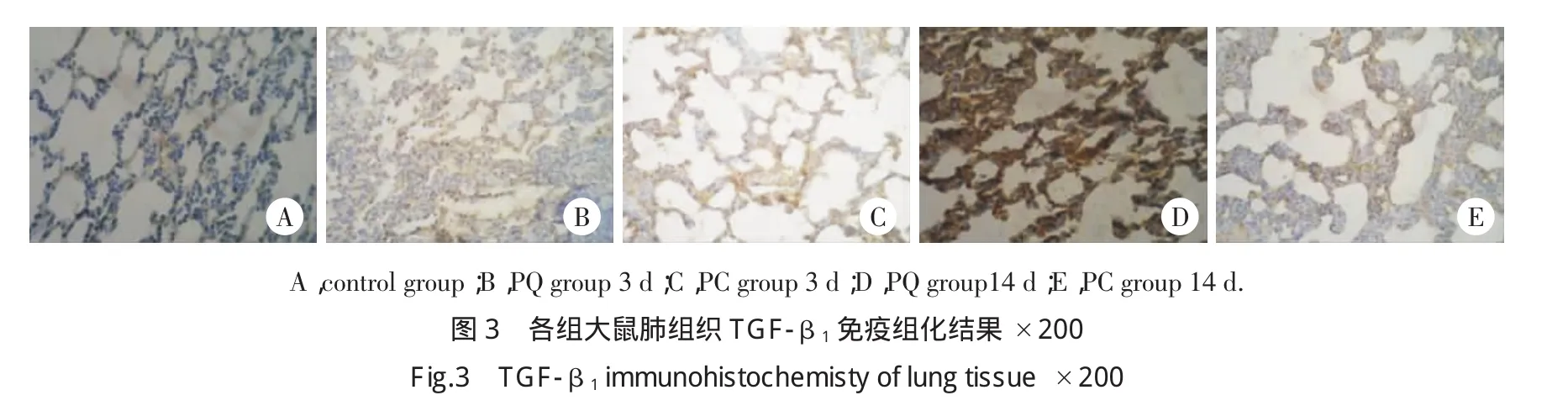
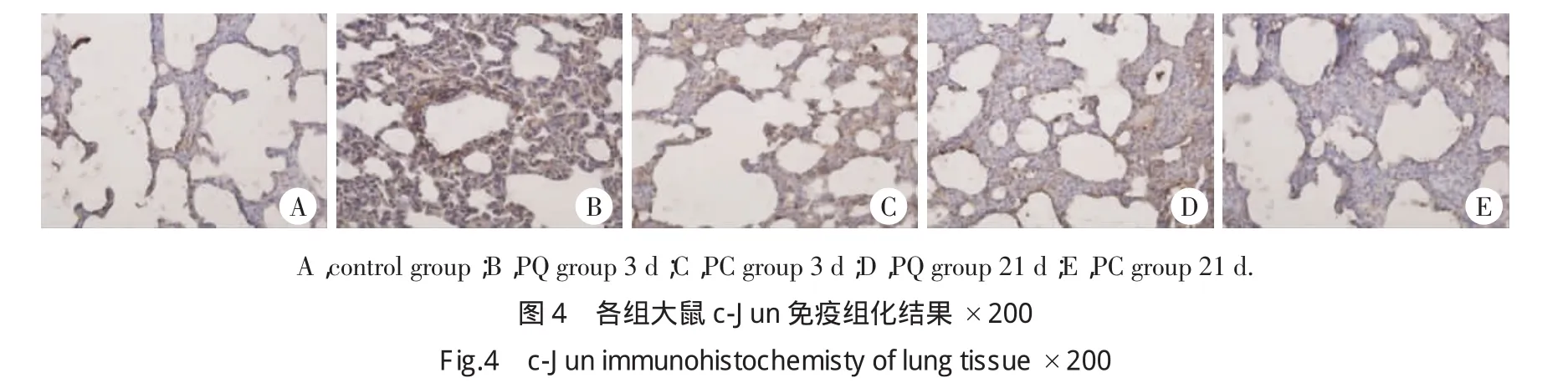
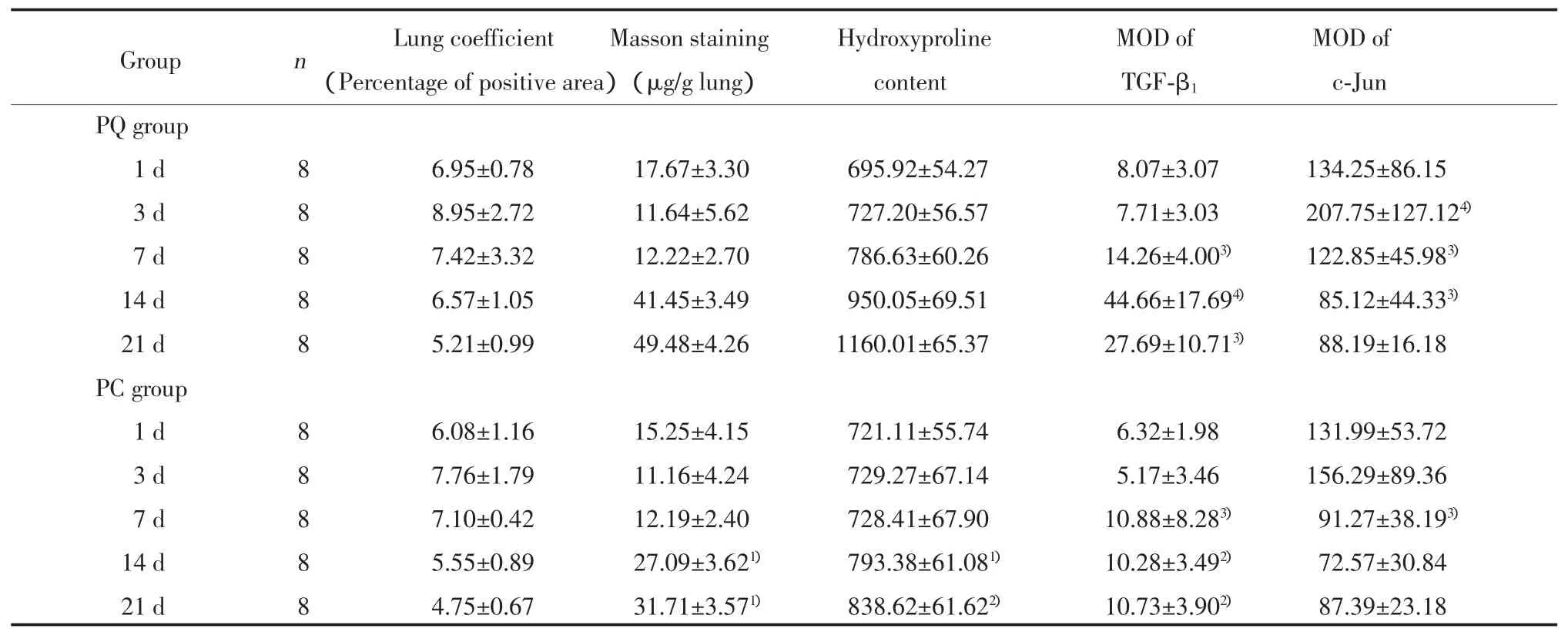
表1 各组大鼠肺系数、Masson染色、HYP含量、TGF-β1和c-Jun的比较(x±s)Tab.1 The lung index,Masson staining,HYP,TGF-β1,and c-Jun expression(x±s)
3 讨论
PQ 20%水溶液口服入血后,约有50%分布集中于肺组织,所致弥漫性肺泡损伤最为突出。急性肺损伤早期出现炎性反应和修复过程同时存在不均一性特征。PQ进入机体后产生氧自由基,损伤毛细血管内皮细胞、肺泡上皮细胞,使肺泡表面活性物质减少或失活,肺泡壁的完整性被破坏,肺泡腔内堆积大量的炎性渗出物[5]。动物实验PQ致肺损伤的演变过程可分为染毒后1~7 d,肺泡炎、肺水肿、肺出血;7~14 d,水肿消减后修复机化;21 d以后,明显纤维疤痕形成[6]。本实验采用 Hemmati[4]的方法,取 1、3、7、14和21 d五个观察时点。染毒后大鼠可出现体质量下降、呼吸急促、鼠尾紫绀等表现。肉眼观察PQ组大鼠1和7 d肺脏明显肿胀,颜色晦暗,散在点片状淤斑、出血点;14 d肺脏呈灰白色,肿胀基本消退,有斑点或斑片状实变灶形成;21 d双肺苍白,肺弹性差、硬度增加。光镜下PQ组大鼠肺组织1和7 d内表现为肺泡炎性改变明显,可见肺泡间隔水肿增厚,结构破坏,肺泡腔及间质内可见大量炎性细胞浸润,伴有水肿和出血;14 d肺泡炎有所减轻,但仍有出血及水肿,成纤维细胞增生,肺间隔明显增宽,有胶原沉积及斑片状的纤维化改变;21 d肺泡炎较前减轻,炎性细胞减少,大量肺泡结构萎陷、破坏,大量胶原沉积在新生的毛细血管周围。说明PQ中毒肺损伤1周内以肺泡炎为主,2周后出现肺纤维化。
近年来,人们逐渐把PQ致肺纤维化机制从病变部位细胞成分的变化转移到由各种细胞释放的各种生物活性分子上来。在参与肺纤维化的细胞因子网络中,TGF-β被公认为纤维化形成与发展的启动枢纽。TGF-β1促肺纤维化主要是通过促肺成纤维细胞的活化、增殖、转化作用和调控细胞外基质合成作用。本研究结果显示,PQ组损伤区的肺泡壁巨噬细胞、浸润的炎细胞、平滑肌细胞、内皮细胞及肺泡上皮细胞均有TGF-β1表达;且TGF-β1表达从染毒后即开始升高,14 d左右达峰值,并且PQ组大鼠肺组织在14 d后肺泡间隔变厚、胶原沉积已明显,肺纤维化初步形成,再结合TGF-β1的功能,这也与肺纤维化的形成时间相吻合。TGF-β1属于被激活的激活蛋白 1(activator protein-1,AP-1)调控下游基因转录的应答基因,即AP-1促进TGF-β1表达使Ⅰ型胶原mRNA的转录和分泌增加[7]。PQ肺组织中AP-1的亚基c-Jun的表达水平及变化趋势,可以初步反映PQ肺组织中的AP-1的表达情况。本研究结果显示,PQ染毒后肺损伤区的肺泡巨噬细胞、浸润的炎细胞、成纤维细胞、内皮细胞及肺泡上皮细胞胞浆及胞核中均有阳性表达。结合染毒组大鼠肺组织c-Jun的MOD值从1 d起即升高,3 d达峰值,14 d时降低表达水平,推测在PQ肺损伤/肺纤维化情况下AP-1被激活,并在较早期参与调控TGF-β1的表达。
早期应用姜黄素可以减轻肺纤维化程度,对肺纤维化具有预防作用。Venkaesan等[8]发现姜黄素可降低PQ中毒大鼠支气管肺泡灌洗液内蛋白含量,减轻PQ对肺组织的损害,降低PQ中毒大鼠的死亡率。本研究发现,PC组较同时点PQ组肺系数值小,但差异无统计学意义,说明其干预PQ中毒大鼠肺水肿作用不明显。PC组HE染色成纤维细胞增殖、肺泡萎陷、胶原沉积的情况相对较轻;Masson染色结果14 d时PC组肺纤维化程度较PQ组轻;HYP含量14 d后明显低于PQ组,说明姜黄素明显减轻PQ肺纤维化的程度。从治疗14 d开始PC组TGF-β1表达水平明显低于PQ组,差异有统计学意义。说明姜黄素干预性治疗PQ中毒大鼠,通过降低TGF-β1的过度表达抑制其促进细胞外基质沉积、阻止肺纤维化形成,这是姜黄素发挥其抗肺纤维化作用重要机制之一。姜黄素能明显减轻肺炎性反应,降低肺组织中TNF-α及TGF-β1水平,因为不仅抑制核因子κB,也抑制了一种与炎性反应及纤维化都密切相关的核转录因子AP-1的活化,从而下调了一系列与纤维重构相关基因。Kang等[9]认为,姜黄素通过抑制胶原基因转录,下调胶原mRNA来抑制胶原的沉积。Ammon等[10]认为姜黄素抗纤维化的作用可能只是它抗氧化损伤作用的结果,它通过减轻肺组织炎性反应和巨噬细胞的活化,减轻氧化应激和胶原沉积。Gaedeke等[11]利用TGF-β活化VRK49F大鼠肾成纤维细胞研究发现,姜黄素可通过抑制TGF-β与其膜受体TGF-βⅡ受体(TβRⅡ)的结合,阻碍SMAD磷酸化;抑制转录因子c-Jun和NF-κB活性,下调TβRⅡmRNA的表达,进而下调TGF-β对肾成纤维细胞致纤维活化活性的诱导。本研究PC组c-Jun升高,表达水平虽较同时点PQ组低,但无统计学差异,显示姜黄素对PQ肺组织中c-Jun表达无明显抑制。结果不排除实验样本量或其他客观实验条件造成的结果,需要进一步研究。
[1]Yamamoto I,Saito T,Harunari N,et al.Correlating the severity of paraquat poisoning with specific hemodynamic and oxygen metabolismvariables[J].Crit Care Med,2000,28(6):1877-1883.
[2]Yamashita M.A long-term follow-up of lung function in survivors of paraquat poisoning[J].Hum Exp Toxicol,2000,19(2):99-103.
[3]Punithavathi D,Venkatesan N,Babu M.Curcumin inhibition of bleomycin-induced pulmonary fibrosis in rats[J].Br JPharmacol,2000,131(2):169-172.
[4]Hemmati AA,Nazari Z,Motlagh ME,et al.The role of sodium cromolyn in treatment of paraquat-induced pulmonary fibrosisin rat[J].Pharmacol Res,2002,46(3):229-234.
[5]Nakamura T,Ushiyama C,Shimada N,et al.Changes in concentrations of type IV collagen and tissue inhibitor of metalloproteinase-1 in patients with paraquat poisoning [J].J Appl Toxicol,2001,21(6):445-447.
[6]李少岩,李洪洋,郑志仁,等.PQ所致大鼠弥漫性肺损伤的病理特点[J].华西医科大学学报,1994,34(3):337-340.
[7]胡永斌,曾庆富,冯德云,等.激活蛋白1调控TGF-β1诱导的人肺成纤维细胞Ⅰ型胶原的分泌[J].中南大学学报,2007,32(5):776-781.
[8]Venkaesan N.Pulmonary protective effects of curcumin against paraquat toxicity[J].Life Sciences,2002,66(2):21-28.
[9]Kang HC,Nan JX,Park PH,et al.Curcumin inhibitscollagen synthesis and hepatic stellate cell activation in-vivo and in-vitro [J].J Pharm Pharmacol,2002,54(1):119-126.
[10]Ammon HP,Wahl MA.Pharmacology of Curcumalonga[J].Planta Med,1991,57(1):1-7.
[11]Gaedeke J,Noble NA,Border WA.Curcumin blocksmultiplesitesof the TGF-betasignalingcascadein renal cells[J].Kidney Int,2004,66(1):112-120.
