孕激素对子宫内膜癌Ishikawa细胞TGF-β1、TβR1表达的影响
2011-05-25王改华刘贵鹏
王改华,刘贵鹏
(中国医科大学附属盛京医院妇产科,沈阳 110004)
子宫内膜癌是严重威胁女性生命及生活质量的生殖系统常见恶性肿瘤,而随着发病年龄的年轻化以及对生育的不同要求,保留生育能力的非手术治疗方案已成为患者的迫切需要。自从孕激素作为一种有效的抑制子宫内膜癌细胞生长的激素类常用药物应用于临床,多年来取得显著疗效,但其作用机制目前仍不明确。近年来肿瘤分子生物学研究表明,转化生长因子β(TGF-β)家族与子宫内膜癌的发生、发展密切相关[1]。目前,大量证据证明TGF-β作为一种癌症抑制因子发挥着重要的作用,而且,利用该通路的抑制制剂可能对癌症的化学预防和治疗具有实用性。我们通过观察孕酮(MPA)对人子宫内膜高分化腺癌 Ishikawa细胞内 TGF-β1及其受体TβR1蛋白表达的影响,探讨孕激素治疗子宫内膜腺癌的机制。
1 材料与方法
1.1 材料
1.1.1 细胞来源:子宫内膜癌内膜高分化腺癌Ishikawa细胞(ER、PR均为阳性)来自北京大学病理生理教研室。
1.1.2 主要试剂:DMEM高糖培养基为Hyclone公司产品;胎牛血清为天津灏洋生物技术有限公司产品;DMSO、四甲基偶氮唑蓝(MTT)、醋酸甲羟孕酮(MPA)为美国Sigma公司产品。MPA用DMSO溶解配成母液,浓度为20 mg/ml,-20℃储存。取MPA母液用不含胎牛血清的DMEM高糖培养液稀释成相应浓度后0.22μm过滤器过滤除菌,4℃保存备用。培养液中DMSO终浓度不超过0.1%;鼠抗人TGF-β1/TβR1单克隆抗体为Santa公司产品;Annexin VFITC试剂盒为北京四正柏生物科技有限公司产品;SP试剂盒、DAB显色试剂为北京中杉公司产品。其他常规试剂为标准分析纯。
1.2 方法
1.2.1 细胞常规培养:常规方法复苏子宫内膜高分化腺癌细胞株Ishikawa。将冻存的Ishikawa细胞接种于100 mL培养瓶中。用含有10%胎牛血清的DMEM高糖培养基(加入100U/mL青霉素、100μg/mL链霉素),在37℃、5%CO2饱和湿度的培养箱中对Ishikawa细胞进行培养,使其贴壁生长。待细胞生长至80%以上融合后用0.25%胰蛋白酶消化,传代细胞。
1.2.2 MTT法检测MPA对细胞增殖活性影响:取对数生长期子宫内膜癌Ishikawa细胞,经0.25%胰酶消化后用含5%胎牛血清的DMEM高糖培养基制备成单细胞悬液,以每孔(5~8)×104个细胞密度接种于96孔细胞培养板,每孔体积为100μL,在37℃、5%CO2的饱和水汽培养箱中培养过夜。将标本随机分两组,即实验组和对照组。
细胞贴壁后,实验组分别更换为含不同浓度MPA (2.5 μg/mL、5 μg/mL、10 μg/mL、15 μg/mL、20μg/mL)的培养液,对照组加入含相应浓度DMSO的培养液,加药后每孔体积为200μL。同时以只加培养液不加细胞的空白孔作为调零孔。分别在培养24、48、72 h 后每孔加入新鲜配制的 MTT(5 mg/mL)20μL。继续孵育4 h后,吸去上清,每孔加入DMSO 150μL终止反应。震荡10 min,使紫蓝色结晶物充分溶解后,用酶标仪测490 nm波长吸光度(OD490),并计算不同浓度梯度的MPA在乜用不同旖间段时对Ishikawa细胞生长的抑制率:抑制率=(对照组OD 490-实验组OD490)/对照组0D490。本实验每个浓度莾5个复孔,实验重复3次。
1.2.3 FACScan法检测MPA对细胞凋亡率的影响:取生长期的IsHikawa细胞,细胞以5×105/mL接种,并随机设阴性对照组和实验组。待细胞贴壁甞长后,实验组更换为含不同浓度MPA(5μg/mL、10μg/mL、20μg/mL)的培养液,对照组加入含相应浓度DMSO的培养液。分别培养72 h后收集各组细胞至离心管中,1 500 r/min离心5 min,用冷PBS洗涤离心2次。加入100μL Binding Buffer和FITC标记的AnnexinV-FITC(20μg/mL)10μL,室温避光 30 min。再加入PI(50μg/mL)5μL,避光反应5 min后,加入400μL Binding Buffer,立即用FACScan进行流式细胞术定量检测(一般不超过1 h)。实验重复3次,取平均值。
1.2.4 Ishikawa 细胞 TGF-β1、TβR1 蛋白表达的测定:取对数生长期的Ishikawa细胞,以1×105mL的细胞密度接种于孔内置无菌盖玻片的6孔板上内,置于37℃、5%CO2培养箱中孵育,待细胞贴壁后再加入经无血清培养液稀释的药物MPA,药物(浓度分别为5/10/20μg/mL)和细胞共同培养72 h。采用链霉菌抗生物素蛋白过氧化物酶连接法(SP法),实验步骤按试剂盒说明书进行。DAB染色,苏木精复染。采用显微图像分析法,以平均积分光密度值(iOD)为指标对实验结果进行系统分析。
1.3 统计学分析
计量资料以x±s表示,两组间比较采用t检验,多组间比较采用方差分析,利用SPSS17.0进行计算。
2 结果
2.1 MPA对子宫内膜癌Ishikawa细胞增殖的影响
2.1.1 细胞形态及生长抑制作用:在MPA的作用下,对照组(不加MPA)Ishikawa细胞在培养72 h后,细胞约99%融合长满瓶壁。而实验组Ishikawa细胞则出现抑制作用(图1),且随着作用浓度及时间的增加,抑制作用逐渐增强。
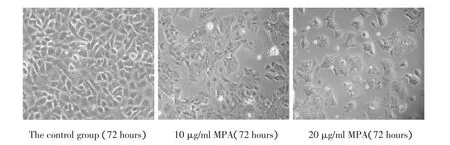
图1 不同MPA浓度作用72 h对Ishikawa细胞增殖的抑制作用Fig.1 Inhibition of MPAon proliferation of Ishikawa cells at different concentration after 72 hours treatments
2.1.2 MPA对Ishikawa细胞增殖的抑制作用:经MPA的不同浓度、时间作用之后,Ishikawa细胞的增殖出现抑制作用(P<0.01),抑制率与时间、MPA剂量正相关(P<0.05)。MPA作用浓度为15μg/mL,作用72 h时细胞生长出现半抑制(表1)。

表1 不同MPA药物浓度与作用时间对人子宫内膜癌系Ishikawa细胞生长的抑制(x±s,n=3)Tab.1 Growth inhibition of Ishikawa ells after MPA treatments at different concentrations and for varied times(x±s,n=3)
2.2 MPA对Ishikawa细胞凋亡率的影响
与对照组相比,MPA组Ishikawa细胞早期及晚期凋亡增加,凋亡率明显高于正常组(P<0.01)(表2)。
2.3 MPA 对 Ishikawa细胞 TGF-β1、TβR1蛋白表达的影响
TGF-β1、TβR1 蛋白阳性染色位于细胞质,以细胞胞质出现棕黄色颗粒为阳性信号。TGF-β1、在Ishikawa细胞中有强表达,经MPA作用72 h后,TGF-β1的表达明显下调(P<0.01)(表 3,图 3)。TβR1在Ishikawa细胞中表达较弱,经MPA处理72 h后,TβR1的表达则出现了明显的上调(P<0.01)。(表 3,图 4)。

表2 不同浓度MPA对人子宫内膜癌系Ishikawa细胞凋亡率的影响(x±s,n=3)Fig.2 Effects of MPAon apoptotic rate of Ishikawa cells at different concentrations(x±s,n=3)
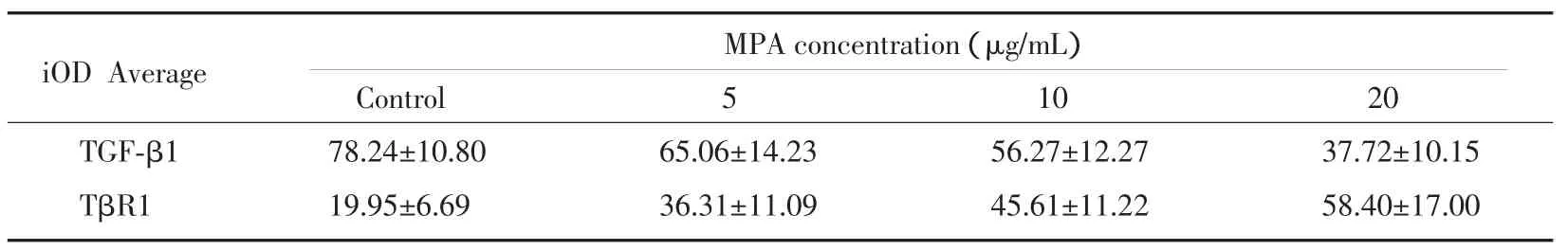
表3 MPA对Ishikawa细胞TGF-β1、TβR1蛋白表达的影响(x±s,n=30)Tab.3 Effect of MPA on TGF-β1,TβR1 protein of Ishikawa(x±s,n=30)

图3 免疫组化法检测TGF-β1的表达 ×400Fig.3 Expression of TGF-β1 by immunocytochemistry×400

图4 免疫组化法检测TβR1的表达 ×400Fig.4 Expression of TβR1 by immunocytochemistry×400
3 讨论
近年来肿瘤分子生物学研究表明,TGF-β家族与肿瘤的发生、发展关系密切,其中任任何一个环节的异常,都可能使细胞逃避TGF-β介导的生长抑制效应[2]。在人体内主要发挥作用的是TGF-β1,TGF-β1信号对肿瘤的作用是既有正向效应又有负向的双重效应[3]。TGF-β1作为肿瘤抑制基因和癌基因的双重角色存在。
TGF-β1的生物学作用是由其受体直接介导的,在人类肿瘤中,TGF-β1的过度表达与肿瘤的发展、转移、血管生成和恶化程度相关,而TGFβ1丧失对肿瘤细胞生长的负性调控作用与TβR表达的下降或缺如有关[4]。大量子宫内膜癌的研究资料中表明,在子宫内膜癌细胞及基质中存在TGF-β1及其受体TβR1的异常表达,TGF-β1在子宫内膜癌细胞中表达普遍增高,而其受体的表达则普遍性降低[5]。在正常的生理条件下,TGF-β1通过调控子宫内膜细胞周期,抑制细胞增殖,诱导细胞凋亡抑制肿瘤的发生;但在特定的情况下,如TβR基因突变或其下游蛋白(Smads蛋白)功能的丧失,使细胞失去了对TGF-β1诱导的生长抑制和凋亡信号的敏感性,细胞的生长失去调控,诱发细胞突变,导致癌变的发生。随着肿瘤的进展,子宫内膜癌细胞摆脱了TGF-β1的抑制作用,反被TGF-β1刺激而生长,导致肿瘤的浸润、转移[6]。因此,利用该通路的抑制剂可能对子宫内膜癌的化学预防和治疗具有实用性。
有研究表明,孕激素用于治疗子宫内膜癌的成功率可达到57%~75%[7]。尽管孕激素用于治疗子宫内膜癌已有40多年的历史,但其作用机制目前并不清楚。本实验对子宫内膜高分化腺癌Ishikawa细胞系体外培养发现,孕激素呈剂量及时间依赖性抑制Ishikawa细胞的增殖,FCM分析显示,于对数生长期的Ishikawa细胞悬液中加入孕激素作用后,Ishikawa细胞凋亡率增加。采用免疫细胞化学法检测到TGF-β1在子宫内膜癌Ishikawa细胞中呈现高表达,而TβR1在Ishikawa细胞中则呈现出低表达状态。当孕激素作用于Ishikawa细胞后,其TGF-β1蛋白表达明显下调,而TβR1蛋白的表达则明显上调。这一发现表明孕激素可抑制TGF-β1蛋白的表达,相反可促进TβR1蛋白的表达。由此推测,孕激素可通过对TGF-β1、TβR1表达的调节,达到抑制细胞增殖、诱导细胞凋亡的目的,从而发挥孕激素的抗癌作用,有助于从蛋白质水平了解孕激素治疗子宫内膜癌的作用机制。
TGF-β作为治疗子宫内膜癌的靶点之一,调节凋亡抑制蛋白TGF-β1、TβR1蛋白的表达,也可能是MPA调节子宫内膜癌高分化腺癌细胞凋亡的机制之一。但是,其具体的作用机制仍需要进一步的研究证实。
[1]Brian B,Moses HL.TGF-β and cancer[J].Cytokine& Growth Factor Reviews,2006,17(1-2):29-40.
[2]Glasgow E,Mishra L.Transforming growth factor-β signaling and ubiquitinators in cancer[J].Endocrine-Related Cancer,2008,15(1):59-72.
[3]Blobe GC,Schiemann WP,Lodish HF.Role of transforming growth factorβ in human disease [J].New Eng JMed,2000,342(18):1350-1358.
[4]Attisano L,Wrana JL.Signal transduction by the TGF-beta super family[J].Science,2002,296(5 573):1646-1647.
[5]Piestrzeniewicz-Ulanska D,Brys M,Semczuk A,et al.TGF-β signaling is disrupted inendometrioid-type endometrial carcinomas[J].Gynecol Oncol,2004,95(1):173-180.
[6]Komiyama s,Aoki D,Komlyama M,et a1.Local activation of TGF-betal at endometriosissites[J].JReprod Med,2007,52(4):306-312.
[7]连丽娟,郎景和,郭丽娟,等.妇科肿瘤学[M].2版,北京:人民卫生出版社,2006:468.
