辛伐他汀对 THP-1巨噬细胞源性泡沫细胞胆固醇代谢和 SR-A表达的影响
2011-05-23李晨光罗俊生霍小川
李晨光,罗俊生,冯 旭,霍小川,关 宁
(辽宁医学院附属第一医院,辽宁锦州 121001)
动脉粥样硬化(AS)是一个复杂的病理过程,巨噬细胞源性泡沫细胞的形成是其显著特征[1]。清道夫受体介导的氧化型低密度脂蛋白(ox-LDL)的蓄积是 AS发生、发展中泡沫细胞形成的关键[2]。研究表明,他汀类药物除具有显著的降脂作用外,还具有独特的心血管防治作用,如改善内皮细胞功能、抗炎、抑制 LDL的氧化修饰、抑制清道夫受体表达等[3]。然而关于他汀类药物对清道夫受体介导的THP-1巨噬细胞脂质蓄积的影响及机制仍不甚明确。2010年 6~12月,我们观察了不同浓度辛伐他汀对人单核源性巨噬细胞泡沫化的影响,并对此类药物的抗 AS机理进行了初步探讨。现报告如下。
1 材料与方法
1.1 材料 THP-1单核巨噬细胞株(中国科学院上海细胞生物学研究所),胎牛血清、RPMI 1640培养基(美国 GIBCO公司),ox-LDL(北京协生生物科技有限公司),油红 O和佛波酯(PMA)(Sigma公司);淋巴细胞分离液(天津市灏洋生物公司),辛伐他汀(辉瑞制药),BCA蛋白含量测定试剂(北京 Applygen基因技术有限公司);SR-A羊抗人和 β-actin兔抗人一抗,辣根过氧化物酶标记驴抗羊和羊抗兔二抗(Santa Cruz公司)。其他试剂均为进口或国产分析纯。
1.2 方法
1.2.1 细胞的培养及实验分组 THP-1细胞生长于含 10%灭活新生胎牛血清、1×108U/L青霉素的RPMI 1640完全培养基中,置 37℃、5%CO2饱和湿度培养箱内培养。每次实验前用 150 nmol/L PMA孵育 24 h,使其诱导分化为巨噬细胞。在每次实验前将巨噬细胞密度调整为 1×106个 /孔,加入 6孔培养板中。实验细胞分为 5组,即对照组、ox-LDL组、辛伐他汀按浓度分低中高 3组(1、10、100μmol/L组)。ox-LDL组加入 ox-LDL(终浓度为 100 mg/L)处理 24 h;辛伐他汀处理组按不同浓度辛伐他汀处理巨噬细胞 2 h后,加入 ox-LDL(终浓度为 100 mg/L)处理 24 h,诱导巨噬细胞泡沫化;对照组不予处理。
1.2.2 SR-A蛋白的检测 采用 Western blot法。上述各组细胞经 24 h处理后用细胞刮刀收集至 EP管内。用 TBS漂洗后加入 RIPA缓冲液(1%NP-40、0.5%脱氧胆酸钠、1%SDS、0.1%PMSF)裂解细胞,考马斯亮蓝法测定蛋白质浓度。加热变性,SDS聚丙烯酰胺凝胶电泳、转膜,5%脱脂奶粉封闭过夜,加入 1∶200 SR-A羊抗人一抗,杂交 2 h。TBST洗膜后加入 1∶15 000驴抗羊二抗 ,温育 1 h,TBST洗膜后进行 BCIP/NBT显色,采用 Chemi-genius凝胶成像系统分析目的蛋白的表达量。人 β-actin作为内参,一抗是 1∶500兔抗人 β-actin抗体,二抗是1∶15 000羊抗兔二抗。
1.2.3 油红 O染色和脂质染色的半定量分析 将贴壁的巨噬细胞以 PBS冲冼3次,放在 4℃、10%甲醛中固定 10 min,用油红 O染色、水冼 5 min,60%异丙醇中放置 5 min,新过滤的油红 O染色 10 min,60%异丙醇分化 5 min,水洗 5 min,Mayer氏苯木精明矾染液染色 5 min,1%HCl分色及反蓝后,水洗 5 min并照相。按 Wada方法[4]进行脂质染色的半定量分析,即根据细胞脂滴的面积进行细胞分类。如果细胞脂滴的面积小于细胞核的面积记为“-”,细胞脂滴的面积等于或大于细胞核的面积记为“+”,此即为油红 O染色细胞,每孔随机计数一个视野(×400)的细胞。
1.2.4 高效液相色谱分析(HPLC) 待细胞处理结束后,弃去培养基,PBS洗 3遍,加入 1 ml生理盐水重新稀释细胞,反复冻融,冰浴中超声裂解细胞。高效液相色谱法参照 Cullen等[5,6]的方法,测定细胞游离胆固醇(FC)和胆固醇酯(CE)的含量。胆固醇用外标法峰面积定性定量。色谱条件为色谱柱:C18;流动相 ∶异丙醇 ∶正庚烷 ∶乙腈 (35∶12∶52,v/v),非梯度洗脱;流速:1 ml/min;检测波长:210 nm,检测到第 8分钟;柱温:20℃。用 CE酶水解 CE得TC量,以 HPLC测定胆固醇并定量,以 TC量减去FC量代表CE量。
1.3 统计学方法 采用 SPSS13.0统计软件,结果以±s表示,两组间比较采用 t检验及方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 各组油红 O染色阳性细胞变化 ox-LDL诱导24 h后,油红 O染色结果显示:正常对照组细胞形态呈椭圆形或不规则形状,油红 O染色阳性细胞少,细胞核蓝染,胞质略显红色;ox-LDL诱导组阳性细胞遍布,胞质大量红染,细胞核蓝染,且细胞体积部分增大,细胞呈圆形或不规则形。通过比较阳性细胞数量可以看出,阳性细胞率由(8.65±1.40)%增加到(86.70±0.89)%;HPLC检测结果显示:ox-LDL诱导组的 CE与 TC之比大于 60%。以上结果说明巨噬细胞泡沫化效果明显。见表1。
表1 不同浓度辛伐他汀处理后巨噬细胞油红 O染色阳性细胞的相对含量(%,±s)
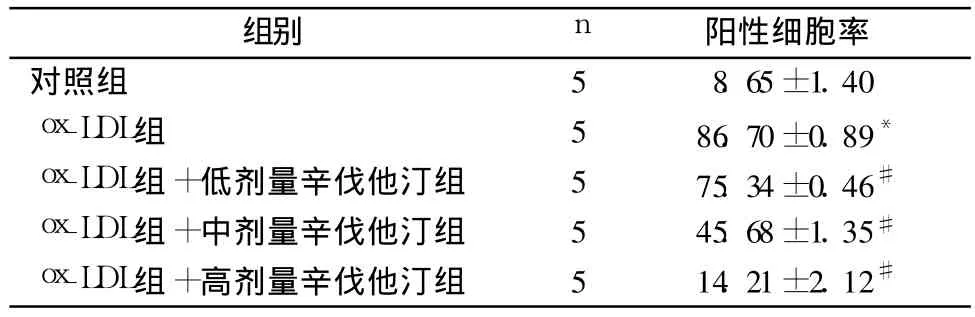
表1 不同浓度辛伐他汀处理后巨噬细胞油红 O染色阳性细胞的相对含量(%,±s)
注:与对照组比较,*P<0.01;与 ox-LDL组比较,#P<0.01
组别 n 阳性细胞率对照组 5 8.65±1.40 ox-LDL组 5 86.70±0.89*ox-LDL组 +低剂量辛伐他汀组 5 75.34±0.46#ox-LDL组 +中剂量辛伐他汀组 5 45.68±1.35#ox-LDL组 +高剂量辛伐他汀组 5 14.21±2.12#
2.2 辛伐他汀处理后细胞内 CE变化的量效关系辛伐他汀处理后,油红 O染色阳性细胞比例明显减少。当药物浓度在 100μmol/L时,阳性细胞比例接近正常细胞。HPLC检测结果显示,CE/TC值随着辛伐他汀浓度的增加而降低,由(64.34±0.86)%降至(24.21±1.16)%(P<0.01),说明辛伐他汀预处理细胞可以减少 CE在细胞内聚集,有效抑制细胞泡沫化。见表2。
表2 不同浓度辛伐他汀处理后细胞中CE/TC的变化(%,±s)
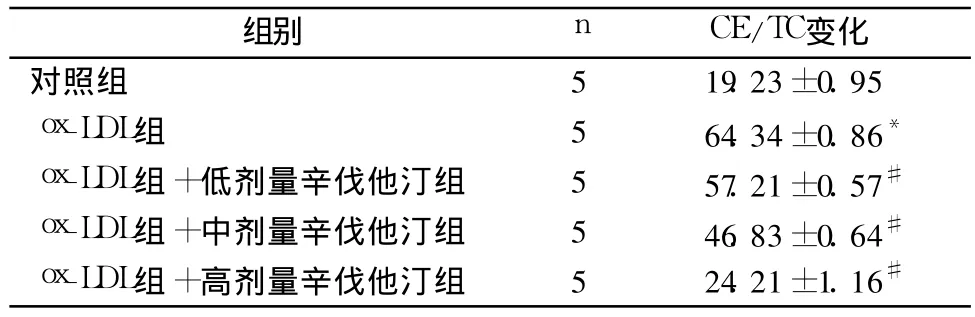
表2 不同浓度辛伐他汀处理后细胞中CE/TC的变化(%,±s)
注:与对照组比较,*P<0.01;与 ox-LDL组比较,#P<0.01
组别 n CE/TC变化对照组 5 19.23±0.95 ox-LDL组 5 64.34±0.86*ox-LDL组 +低剂量辛伐他汀组 5 57.21±0.57#ox-LDL组 +中剂量辛伐他汀组 5 46.83±0.64#ox-LDL组 +高剂量辛伐他汀组 5 24.21±1.16#
2.3 细胞 SR-A蛋白表达的情况 通过 Western blot检测显示,对照组细胞中 SR-A蛋白表达量较少(0.82±0.23),当巨噬细胞经 ox-LDL诱导分化成泡沫细胞过程中,SR-A蛋白水平(1.96±0.42)显著上调(P<0.01)。经辛伐他汀处理后,SR-A蛋白的表达量值随着辛伐他汀浓度的增加而降低,当浓度降到 100μmol/L,SR-A蛋白表达水平(0.79±0.12)接近正常巨噬细胞。见图1。

图1 SR-A蛋白表达量
3 讨论
巨噬细胞源性泡沫细胞的形成是一个多环节的复杂过程。一方面,巨噬细胞对 LDL起修饰作用。巨噬细胞通过细胞内多种酶(如脂肪氧化酶)和活性氧(如超氧负离子)作用于 LDL而产生一定程度的氧化修饰。巨噬细胞大量吞噬被自身细胞核金属离子修饰的 LDL,表现出一定的泡沫化倾向[7,8]。另一方面,巨噬细胞通过清道夫受体,CD36受体或其他受体的作用,对 ox-LDL的大量吞噬促成了巨噬细胞源性泡沫细胞的形成[9]。本实验用 ox-LDL孵育巨噬细胞,当终浓度为 100 mg/L时,泡沫化效果较好,泡沫化率接近 90%。
SR-A是一种跨膜糖蛋白受体,主要表达于巨噬细胞、血管平滑肌细胞和内皮细胞,ox-LDL作为一种重要的配体与之结合后,在 AS的发生、发展中发挥重要作用。巨噬细胞吞噬脂质转变为泡沫细胞是早期 AS形成过程中的关键环节,SR-A是巨噬细胞膜上的糖蛋白,其不受细胞内胆固醇的负反馈调节,能无限制地吸收细胞外的脂质进入细胞内,使巨噬细胞转变为泡沫细胞[10]。本研究显示,在 ox-LDL刺激巨噬细胞 24 h后形成的泡沫细胞中,SR-A蛋白表达含量增加,提示 ox-LDL对 SR-A受体表达的影响可能是通过增强 SR-A基因转录实现的,即通过促进受体表达量来增强对其自身的结合和摄取。
他汀类药物是目前临床上应用最为广泛的调脂药物,既可以降低血低密度脂蛋白胆固醇水平,也可以明显减少冠状动脉心脏病等心血管疾病的发病率和死亡率,从而奠定了他汀类药物在动脉粥样硬化防治中的重要地位。大量的临床和基础研究证实,他汀类药物的临床意义除了调脂作用,还能发挥多种非胆固醇依赖的直接生物学效应,包括抗炎、改善血管内皮细胞功能、抑制平滑肌增殖、稳定斑块等。其中抗炎作用对抑制动脉粥样硬化的形成、降低心血管事件的发生率具有重要意义。本实验采用 ox-LDL处理人 THP-1单核源性巨噬细胞建立泡沫细胞模型,采用不同浓度的辛伐他汀进行干预。结果显示,辛伐他汀处理泡沫细胞后,油红 O染色提示细胞内脂滴较对照组明显减少,细胞内的 CE显著减少,CE/TC值随着辛伐他汀浓度的增加而降低(P<0.01),说明辛伐他汀预处理细胞可以减少 CE在细胞内聚集,有效抑制细胞泡沫化,且 SR-A蛋白表达量随辛伐他汀浓度增高而降低。
综上所述,辛伐他汀的抗 AS作用除已知的调脂作用外,还与抑制清道夫受体 SR-A表达、降低巨噬细胞摄取胆固醇、抑制巨噬细胞泡沫化有关。
[1]De Boer OJ,van der Wal AC,Becker AE.Atherosclerosis,inflammation,and infection[J].J Pathol,2000,190(3):237-243.
[2]Lam MC,Tan KC,Lam KS.Glyeoxidized low-density lipoprotein regulates the expression of scavenger receptors in THP-1 macrophages[J].Atherosclerosis,2004,177(2):313-320.
[3]Raja SG,Dreyfus GD.Statins:much more than just a lipid-lowering therapy[J].Indian Heart J,2004,56(3):204-209.
[4]Wada Y,Sugiyama A,Yamamoto T,et al.Lipid accumulation in smooth muscle cells under LDL loading is independent of LDL receptor pathway and enhanced by hypoxic conditions[J].Arterioscler Thromb Vasc Biol,2002,22(10):1712-1719.
[5]Cullen P,Fobker M,Tegelkamp K,et al.An improved method for qualification of cholesterol and cholesterol esters in human monocytederived macrophages by high performance liquid chromatography with identification of unassigned cholesteryl esters species by means of secondary ion mass spectrometry[J].JLipid Res,1997,38(2):401-409.
[6]王佐,李全忠,杨向东,等.高效液相色谱分析氧化型低密度脂蛋白处理 U937细胞内胆固醇及胆固醇酯[J].中国动脉粥样硬杂志,1998,6(4):317-320.
[7]Heinecke JW,Rosen H,Chait A.Iron and copper promotemodification of low density lipoprotein by human arterial smooth muscle cells in culture[J].JClin Invest,1984,74(5):1890-1894.
[8]McNally AK,Chisolm GM 3rd,Morel DW,et al.Activated human monocytes oxidize low-density lipoprotein by a lipoxygenase-dependent pathway[J].J Immunol,1990,145(1):254-259.
[9]Parthasarathy S,Printz DJ,Boyd D,et al.Macrophage oxidation of low density lipoprotein generates a modified form recognized by the scavenger receptor[J].Arteriosclerosis,1986,6(5):505-510.
[10]Svensson L,Noren K,Wiklund O,et al.Inhibitory effects of N-acetylcysteine on scavenger receptor class A expression in human macrophages[J].J Intern Med,2002,251(5):437-446.
