高葡萄糖诱导的胰岛 β细胞 NIT-1细胞凋亡的拉曼光谱变化
2011-05-23李争明黄庶识邝晓聪
李争明,刘 红*,黄庶识,荣 曦,邝晓聪
(1广西医科大学第一附属医院,南宁 530021;2广西科学院;3广西医科大学)
拉曼光谱技术是一种新的研究凋亡细胞内物质结构和含量变化的有效手段。近年利用其分析研究人肺癌 A549细胞及胃癌细胞的凋亡已有报道[1],但对胰岛β细胞凋亡的研究鲜见报道。2010年4~9月,我们观察了随着细胞凋亡率的增加拉曼光谱的变化情况,并探讨了拉曼光谱在正常与高糖诱导后凋亡的 NIT-1细胞的差别。现报告如下。
1 材料与方法
1.1 细胞培养及分组 将 NIT-1细胞(β细胞株NIT-1细胞来源于 NOD小鼠,由广西医科大学夏宁教授惠赠)培养于含 15%胎牛血清、1×105U/L青霉素和 100 mg/L链霉素的葡萄糖浓度为 11.1 mmol/L RPMI 1640培养基中,细胞在相对湿度为95%、37℃、5%CO2的环境中单层生长,每隔 2~3 d换液;4~5 d传代,取对数生长期的细胞进行实验。根据不同葡萄糖浓度及不同培养时间对 NIT-1细胞分组,处理前细胞即对数生长期细胞为 NG0;对数生长期细胞消化、计数,以 1×105/ml密度接种,培养 24 h后分为:NG1(正常浓度葡萄糖培养第 2天)、NG2(正常浓度葡萄糖培养第 4天)、HG1(高糖培养第 2天)、HG2(高糖培养第 4天)、HG3(高糖培养第 4天漂浮在培养基中的细胞)。每组重复 6个样本。
1.2 流式细胞仪检测凋亡 收集按上述分组处理的各组细胞,细胞染色及流式细胞仪测定细胞的凋亡率,具体操作步骤严格按试剂盒说明书进行。(Annexin V-FITC细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司)。
1.3 细胞拉曼光谱的测定 为了获得单个细胞的整体光谱,采用激光点动态扫描模式,激光点在一个周期内分别向 X轴横向和 Y轴纵向运动,扫描频率被设定为 1 Hz,以 20 mW激发功率和 30 s曝光时间进行光谱采集。从各组细胞中随机选取一部分用于拉曼光谱的检测。检测流程:加样,随机选取视野,视野中每个细胞均检测,PI染色法区分死亡细胞并舍弃,重复以上操作直到获得 50个非死亡细胞的数据。
1.4 统计学方法 采用 SPSS13.0统计软件,结果以±s表示,多组间均数比较采用方差分析,并用SNK法做两两比较。光谱数据经过背景扣除、平滑、基线校正、归一化、峰面积计算(峰面积:峰最高点的前 4个与后4个拉曼位移的强度之和)等处理,以光谱峰面积作为计量资料,数据呈非正态分布,以中位数表示,多组间差异比较采用 Kruskal-Wallis法进行非参数检验。P≤0.05为差异有统计学意义。
2 结果
2.1 各组细胞凋亡率的比较 见表1。
表1 各组 NIT-1细胞凋亡率的比较(%,±s)
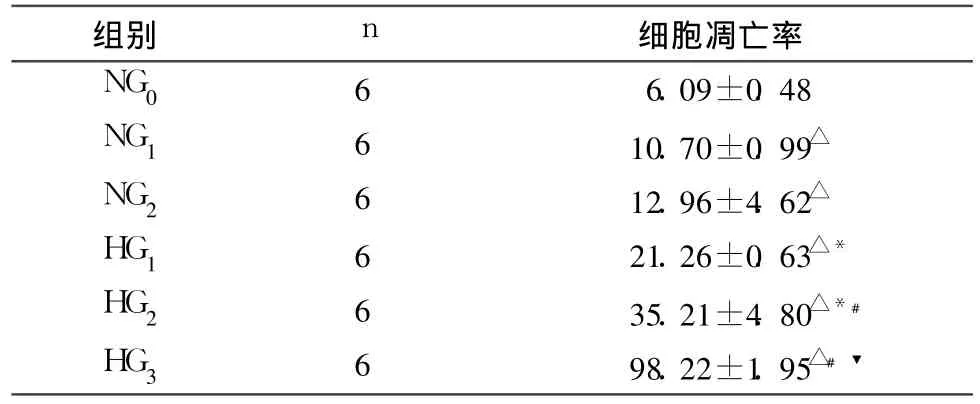
表1 各组 NIT-1细胞凋亡率的比较(%,±s)
注:HG1与 NG1、HG2与 NG2比较,*P<0.01;与 NG0组比较,△P<0.01;与 HG1组比较,﹟ P<0.01;与 HG2比较,▼ P<0.01
组别 n 细胞凋亡率NG0 6 6.09±0.48 NG1 6 10.70±0.99△NG2 6 12.96±4.62△HG1 6 21.26±0.63△*HG2 6 35.21±4.80△*﹟HG3 6 98.22±1.95△﹟▼
2.2 细胞拉曼光谱的变化情况 比较 714/cm、781/cm、1 001/cm、1 086/cm、1 337/cm、1 447/cm、1 655/cm各峰的峰面积后发现,随着高糖培养时间的延长、细胞凋亡率的增加 1 001/cm峰(指认苯丙氨酸[2])和 1 337/cm峰(指认腺嘌呤[2])峰面积呈降低的趋势(P<0.05)。见图1、2。
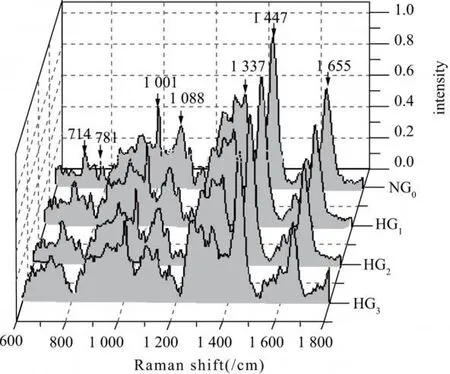
图1 各组随着凋亡率的增加平均光谱变化情况
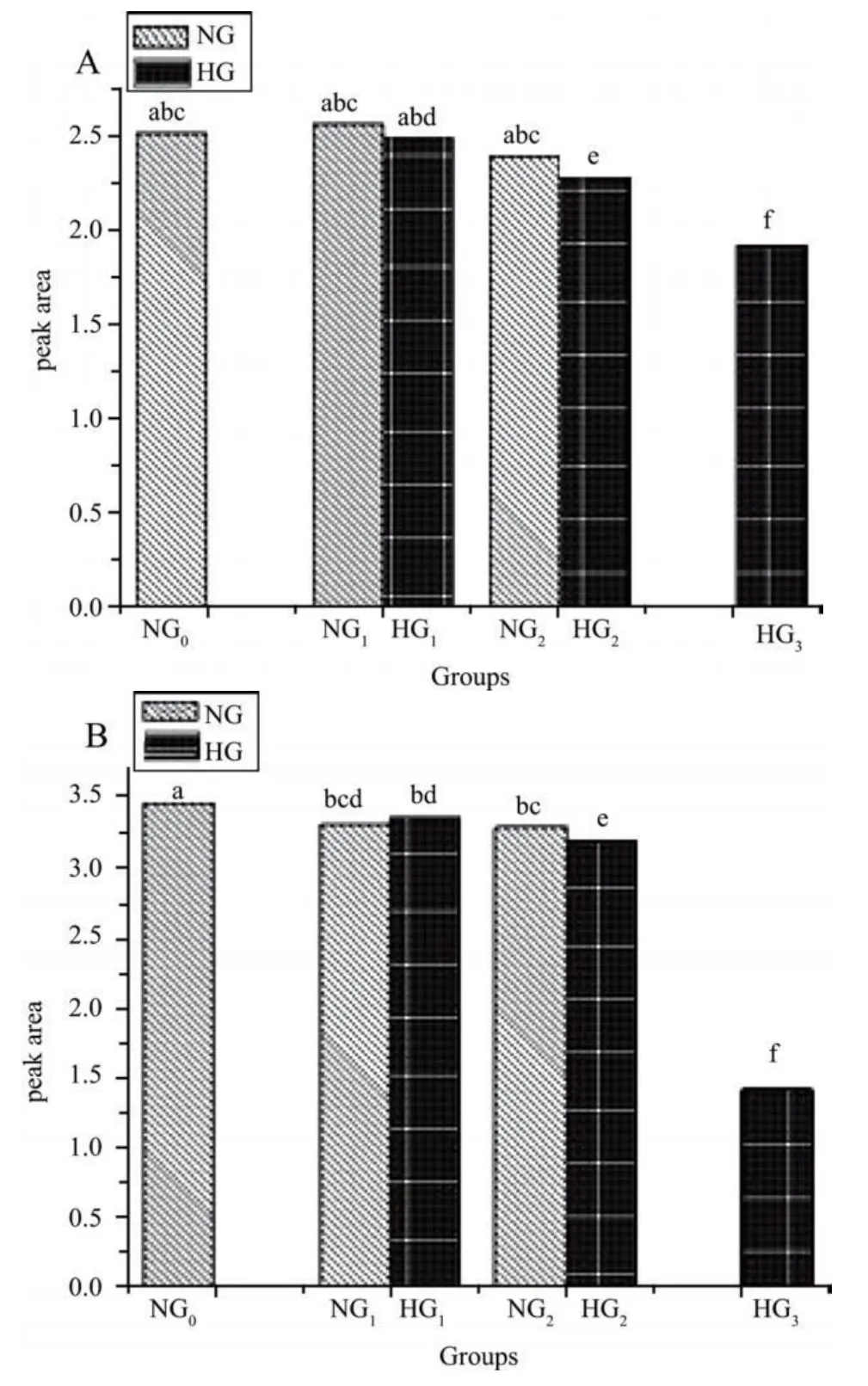
图2 各组 1 001/cm与 1 337/cm峰峰面积比较
3 讨论
拉曼光谱信息从入射光与样品分子对入射光振动频率的差别中得到,光谱的振动频率是原子团和化学键的特性[2],因此分析拉曼光谱可以获得相应原子团与化学键的构象及含量的相关信息,现已成为物理、生物医学等跨学科领域研究和检测的重要方法[3,4]。拉曼谱线强度正比于散射中心的数目,亦即光谱峰面积的大小正比于其指认物质含量的多少[5,6]。1 001/cm与 1 337/cm峰峰面积分别代表蛋白质及核苷酸的含量[2]。本研究 1 001/cm与1 337/cm峰峰面积总体上随着凋亡率的增加而降低,表明细胞内蛋白质及 DNA的含量随着凋亡率的增加而不断降低,与 Notingher等[1]研究一致,也与目前对凋亡的认识是一致的。
细胞发生凋亡时半胱氨酸蛋白酶家族的成员被水解激活,活化的酶又可以催化其他底物蛋白的水解,凋亡细胞膜通透性增高,细胞内蛋白质可以从细胞膜漏出,造成细胞内蛋白质含量的降低。细胞凋亡时,内源性的核酸内切酶被激活,在核小体的连接处将 DNA切断为 200 bp整数倍的小片段,凋亡晚期 DNA降解加剧,并且细胞膜通透性更高,降解的核酸就通过细胞膜扩散到细胞外,因此核酸碱基的含量也会下降。至于具体哪些蛋白质、DNA发生上述变化,还需要借助其他分子生物学手段进一步分析确认。高糖诱导 β细胞凋亡,促凋亡蛋白如 Bax、Bim、Puma、TXNIP、p53等表达会增加[7,8],同时凋亡的细胞因为蛋白质的水解使蛋白质含量下降;高糖还可以刺激 β细胞分泌胰岛素。凋亡细胞内除有DNA降解断裂外还有促凋亡蛋白基因合成,同时高糖刺激胰岛素合成分泌,胰岛素基因的合成也会增加。高糖培养第 2天与相应的正常对照组及处理前组 1 001/cm峰峰面积无统计学差异,高糖培养第 2天与相应的对照组 1 337/cm峰峰面积也无统计学差异,但凋亡率却有统计学差异。本研究测定的样本包括正常与凋亡细胞,考虑由上述原因造成蛋白质及 DNA减少与增加的量相平衡时差别就不能显现出来。处理前与正常糖浓度培养第 2天及第 4天的凋亡率差异并不大,但 1 337/cm峰面积有差异,考虑与对数生长期细胞内 DNA的含量较其他生长阶段多及拉曼光谱灵敏度高有关。本研究高糖除可以诱导胰岛 β细胞凋亡外,短期的高糖还会刺激其分泌胰岛素,使得光谱的变化复杂化,若想观察凋亡β细胞光谱动态的变化,也许使用对细胞仅有致凋亡作用的药物来研究或对同一细胞从凋亡开始到凋亡结束整个过程进行实时检测会好一些。
三磷酸腺苷(ATP)由腺嘌呤和三个磷酸分子组成,Szkudelshi等[9]认为链脲佐菌素是通过耗竭细胞内 ATP,使大量反应性氧簇产生从而对 β细胞产生损伤作用。梁燕玲等[10]发现凋亡细胞内 ATP的含量较正常细胞低,且凋亡率越高其含量越低。Faradji等[11]发现重组腺病毒转染后高表达 GLUT2/GK的 β细胞凋亡率随着葡萄糖浓度的增加而增加,同时伴随着 ATP的减少。本研究代表细胞内腺嘌呤含量的 1 337/cm峰峰面积随着凋亡率的增加而降低,推测高糖有可能通过干扰细胞内的腺嘌呤核苷酸代谢而诱导细胞凋亡。腺嘌呤参与 ATP的组成,那么改善胰岛 β细胞能量代谢,细胞的凋亡能否得到改善有待进一步研究。
综上所述,激光光镊拉曼光谱系统能反映凋亡细胞内蛋白质与核苷酸含量的变化,高糖有可能通过干扰细胞内腺嘌呤核苷酸代谢来诱导细胞凋亡,实验中拉曼光谱的变化具体由何种蛋白质或核苷酸所贡献,仍需要进一步研究。拉曼光谱能提供生物细胞内物质变化的丰富信息,有可能成为一种新的研究凋亡细胞内物质结构和含量改变的有效手段。
[1]Notingher I,Verrier S,Haque S,et al.Spectroscopic study of human lung epithelial cells(A549)in culture:living cellsversus dead cells[J].Biopolymers,2003,72(4):230-240.
[2]许以明.激光拉曼光谱仪[M].北京:科学出版社,1987:69-85.
[3]Bird B,Miljkovic M,Romeo MJ,et al.Infrared micro-spectral imaging:distinction of tissue types in axillary lymph node histology[J].BMCClin Pathol,2008,8:8.
[4]Matthaus C,Chernenko T,Newmark JA,et al.Label-freedetection of mitochondrial distribution in cells by nonresonant Raman microspectroscopy[J].Biophys J,2007,93(2):668-673.
[5]Brunner H,Sussner H.Raman scattering of native and thermally denatured lysozyme[J].Biochim Biophys Acta,1972,271(1):16-22.
[6]Xu YM,Zhang ZY,Zhao KJ,et al.Molecular mechanism of high energy proton radiation-Raman spectroscopic character of mirocosmic damage in the space structure of DNA[J].Sci China B,1993,36(11):1325-1332.
[7]Mckenzie MD,Jamieson E,Jansen ES,et al.Glucose induces pancreatic islet cell apoptosis that requires the BH3-only proteins bim and puma and Multi-BH domain protein bax[J].Diabetes,2010,59(3):644-652.
[8]Chen J,Saxena G,Mangrue IN,etal.Thioredoxin-interacting protein a critical link between glucose toxicity and beta-cell apoptosis[J].Diabetes,2008,57(4):938-944.
[9]Szkudelshi T.The mechanism of alloxan and streptozotocin action in B cells of the rat pancreas[J].Physiol Res,2001,50(6):537-546.
[10]梁燕玲,张苏明,许康,等.短暂脑缺血再灌流后 ATP含量变化与细胞凋亡的关系[J].脑与神经疾病杂志,2005,13(2):120-122.
[11]Faradji RN,Havari E,Chen Q,et al.Glucose-induced toxicity in insulin-producing pituitary cellsthat coexpress GLUT2 and glucokinase[J].JBiol Chem,2001,276(39):36695-36702.
