润肤消炎洗剂对特应性皮炎皮损定植金黄色葡萄球菌影响的体内外实验研究
2011-05-16陈达灿陈淑慧丁常清
林 颖,梁 洁,陈达灿,陈淑慧,丁常清
特应性皮炎 (AD)的发病与遗传因素、免疫功能紊乱和皮肤屏障功能障碍密切相关,变应原、感染可诱发和加重AD。大量研究表明,金黄色葡萄球菌 (金葡菌)感染参与AD发病,激发皮肤炎症并由微生物的产物释放大量炎症因子使皮肤炎症持续发展[1]。润肤消炎洗剂是陈达灿教授在长期临床实践中总结的外用治疗AD的中药验方,疗效确切。本研究通过体内外实验探讨润肤消炎洗剂对AD皮损定植金葡菌的影响,以初步探讨该药的作用机制。
1 资料与方法
1.1 一般资料 选取2009年5月—2010年5月广东省中医院皮肤科门诊AD患者23例,诊断标准采用Hanifin和Rajika AD诊断标准[2];纳入存在左右对称分布的皮损,且皮损严重程度积分差值<2分,知情同意的患者;排除:近2周内曾服用糖皮质激素、免疫抑制剂、抗生素者,应用糖皮质激素、钙调磷酸酶抑制剂、抗生素外用药物治疗者,以及合并严重内科疾病、依从性差而未能完成试验的患者。23例患者中,男13例,女10例;年龄11个月~27岁,平均10.5岁;病程1个月~27年,平均6.75年。
1.2 方法
1.2.1 润肤消炎洗剂对AD靶皮损和对照皮损金葡菌定植密度影响的研究 采用简单随机化方法,应用Excel 2003软件产生统一的随机数字,按照纳入的先后顺序获得相应的随机数字,左侧 (或右侧)上肢 (或下肢)的典型皮损作为治疗组靶皮损,对侧相应皮损则作为对照组皮损。治疗组靶皮损以润肤消炎免煎中药洗剂外洗或湿敷,中药免煎颗粒加入沸水1 000 ml或2 000 ml(根据免煎颗粒的数量),搅拌药物至完全溶解,待中药溶液水温下降至20℃以下外洗治疗侧皮损 (有渗液皮疹时以药液湿敷15 min),15 min/次,2次/d,14 d为1个疗程。对照侧皮损不给予治疗。检测治疗前后治疗组靶皮损和对照组皮损中金葡菌的定植密度。
1.2.1.1 皮损取材和细菌培养方法 取材时点:治疗前 (第0天)和治疗后 (第14天)。取材部位:同一操作者尽量保持治疗前后取材部位一致。取材方法:将75%乙醇消毒后的直径2 cm(面积4 cm2)镂空的方形标准规格胶片置于治疗组靶皮损和对照组皮损上,在镂空处反复用经无菌0.9%氯化钠注射液浸湿的无菌棉签擦拭 (横向、纵向和斜向各10次),避免擦到镂空的范围以外,最后一次擦拭前尽可能使棉签干燥,以便收集到更多的细菌。然后将棉签投入4 ml 0.9%氯化钠注射液中,反复震荡80次,用接种环取1环 (5μl)接种于羊血琼脂平皿培养基中,在35℃有氧环境下培养24 h。对于不能立即送检的标本,一般可保存在4℃冰箱,1 d内接种。
1.2.1.2 细菌鉴定方法 根据菌落形态,选取金黄色有透明溶血环的菌落行革兰染色,涂片镜检为革兰染色阳性球菌葡萄状排列,进一步行细菌鉴定,采用法国生物-梅里埃公司生产的VITEK2细菌鉴定仪。记录所有分离出的金葡菌菌落数,以公式计算每平方厘米的菌落数,从而测量出皮损处金葡菌定植密度。皮损表面微生物密度 (CFU/cm2)=每平皿菌落数×800/4。
1.2.2 润肤消炎洗剂对金葡菌体外抑菌活性的研究
1.2.2.1 实验材料 (1)主要仪器:超净工作台 (苏州华科净化设备有限公司),恒温摇床培养箱 (型号:ZHWY-2102C,上海智城分析仪器制造有限公司),压力蒸气消毒器(型号:SG41.280,上海医用核子仪器厂),Mueller-Hinton琼脂 (广东环凯微生物科技有限公司),9 cm细菌培养皿 (货号:TCD1009,广州洁特生物过滤制品有限公司),天平 (上海精密仪器有限公司天平仪器厂),照相机 (型号:DSCT50,SONY公司生产),以及锥形瓶、烧杯、玻棒、EP管、吸头、水浴锅、酒精灯、纱布等常用耗材。 (2)主要试剂、质控菌株:金葡菌标准株及耐甲氧西林金葡菌 (MRSA,均购自广州市红十字会医院细菌室),金银花等中药免煎颗粒 (相当于中药饮片10 g等,由江阴天江药业有限公司提供,由广东省中医院购进),胰化蛋白胨 (tryptone)、酵母提取物 (yesat estract)、蒸馏水、氢氧化钠 (NaOH)、pH试纸、无菌0.9%氯化钠注射液等 (均由南方医科大学中医药学院馈赠)。1.2.2.2 中药药液制备 将金银花等中药免煎颗粒按含生药1 g/ml浓度比例加入蒸馏水,搅拌药物至完全溶解,配成1:1浓度的中药药液,以纱布滤过,放入无菌烧杯中密封,置于4℃冰箱保存备用。
1.2.2.3 LB(Luria Bertani)液体培养基制备 取胰化蛋白胨10 g、酵母提取物5 g、氯化钠10 g,溶解在蒸馏水中,放入锥形瓶中,加1 mol的NaOH调节pH值至7.0,加蒸馏水至1 L,用牛皮纸封口,高压蒸气灭菌20 min,放入4℃冰箱中保存。
1.2.2.4 M-H琼脂平板培养基的制备 使用M-H琼脂,按商品说明书进行配制,pH 7.2~7.4。38 g培养基加入1 L纯净水溶解后高温灭菌,冷却至50℃左右,倒入直径90 mm平皿中,每块板厚度 (4.0±0.5)mm。琼脂凝固后用保鲜膜包裹密封,4℃冰箱中保存。
1.2.2.5 菌液制备、使用 将新鲜培养的标准金葡菌、MRSA单个菌落接种至3~5 ml LB培养液中,37℃振荡培养12 h左右,再按1∶100稀释再接种于LB培养基中,每个琼脂平板加入100μl菌液,用玻璃涂棒均匀涂布于琼脂平板表面。
1.2.2.6 药敏纸片的制作 纸片取滤纸,用普通的打孔器打成直径6 mm的圆形小纸片。取200片圆纸片放入清洁干燥的小瓶或小平皿中,以单层牛皮纸扎口或包扎。经15磅15~20 min高压灭菌后,置于37℃温箱或烘箱中数天,使完全干燥。按每张纸片饱和吸水量为0.01 ml计,将上述纸片加入配置好的不同浓度中药药液中,不时翻动,使滤纸片将药液均匀吸净,一般浸泡30 min即可。
1.2.2.7 贴药敏纸片的方法 用无菌镊子将纸片放于涂完菌液的琼脂平板表面并轻压,使纸片与培养基表面完全接触,一旦接触琼脂后不得再移动。9 cm平皿以4片为宜。每张纸片间距不少于24 mm,纸片中心距平皿边缘不少于15 mm。贴完纸片后记录每个平皿药敏纸片的名称。
1.2.2.8 结果判断 纸片贴完后,根据美国临床实验室标准化委员会 (NCCLS)要求,将平皿置于35℃恒温箱中培养24 h后读取药敏结果。24 h后将平板反转,置于暗色、无反光物体表面上判断。取直尺从平皿背面测量最接近的整数毫米数并记录,以药敏纸片周围没有肉眼可见生长物区域为抑菌圈,根据抑菌圈直径大小判断细菌对抗菌药的敏感性。有的菌株可出现蔓延生长、轻微生长,进入抑菌环,这些都不作为抑菌环的边缘。如果出现低浓度药物琼脂平板上不长而高浓度药物琼脂平板上生长现象,则应检查培养物纯度或重复试验。
1.2.2.9 对照组设置 阳性对照组为2%夫西地酸钠;阴性对照组为0.9%氯化钠注射液。
1.3 统计学方法 采用SPSS 11.0软件进行统计检验。金葡菌定植密度以)表示,两组间比较采用配对样本t检验。p<0.05为差异有统计学意义。
2 结果
2.1 润肤消炎洗剂对AD靶皮损和对照皮损金葡菌定植密度的影响
2.1.1 治疗前治疗组靶皮损和对照组皮损行金葡菌的鉴定,23例患者中检出金葡菌14例,占60.9%。因限定纳入治疗侧(治疗组)皮损和对照侧 (对照组)皮损严重程度积分差值<2分,故23例患者治疗侧和对照侧检出金葡菌具有一致性,即对照侧和治疗侧均检出或均无检出。
2.1.2 治疗前后治疗组靶皮损、对照组皮损金葡菌定植密度比较 治疗前两组的皮损金葡菌定植密度比较,差异无统计学意义 (P>0.05);治疗后治疗组靶皮损金葡菌定植密度显著低于对照组皮损,差异有统计学意义 (p<0.05,见表1)。
2.1.3 摄像 对本研究中检出细菌的AD患者治疗前后靶皮损细菌培养结果进行摄像,作为客观评价的可循依据。发现治疗2周后靶皮损金葡菌定植密度较治疗前明显下降 (见图1、2)。

表1 治疗前后治疗组靶皮损和对照组皮损金葡菌定植密度比较 (CFU/cm2)Table 1 The comparison of the staphylococcus aureus colonization density between the target lesions and control lesions before and after treatment
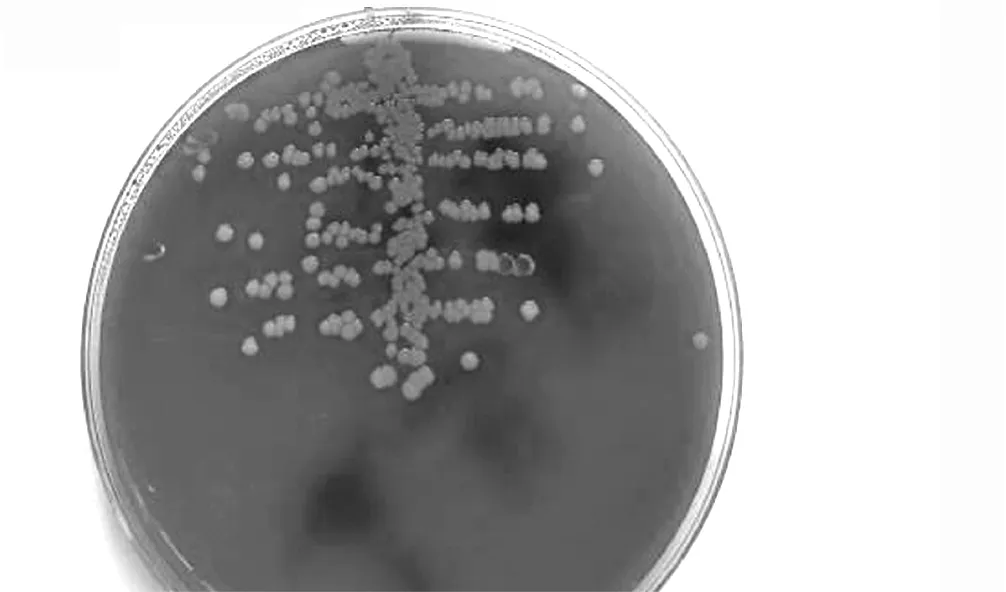
图1 治疗前靶皮损检出的金葡菌Figure 1 Staphylococcus aureus colonization density of the target lesions before treatment
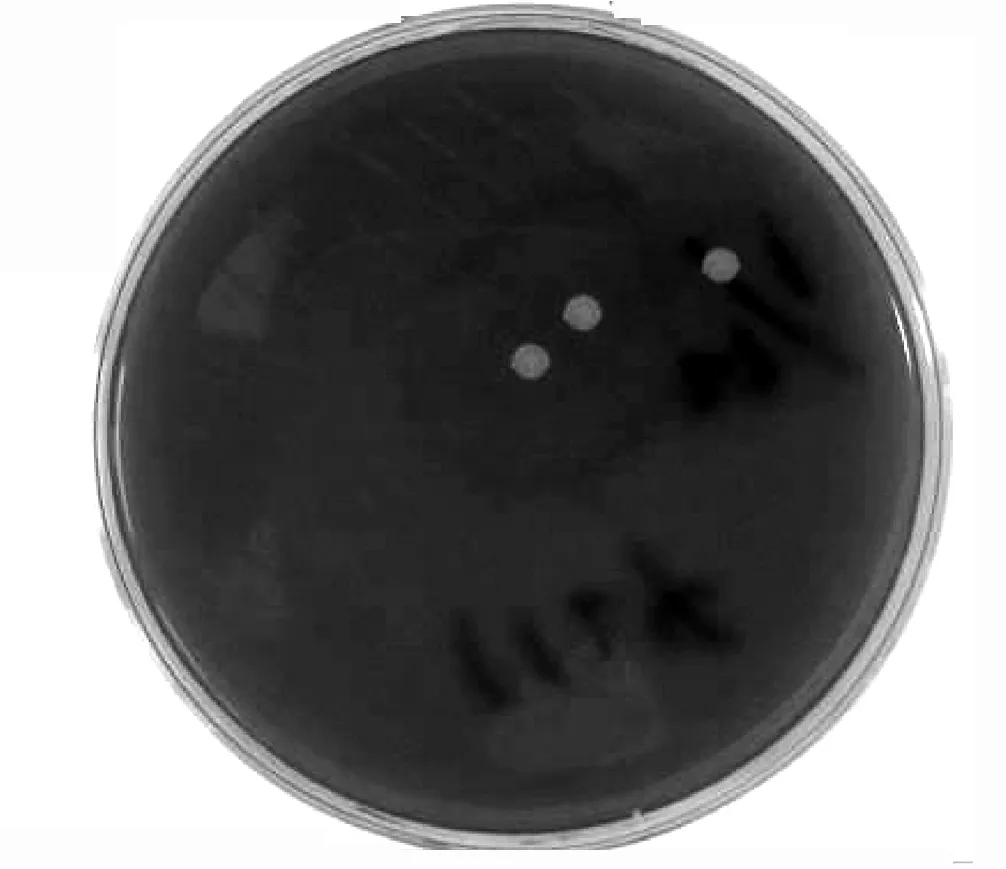
图2 治疗2周后靶皮损检出的金葡菌Figure 2 Staphylococcus aureus colonization density of the target lesions after treatment
2.2 润肤消炎洗剂对金葡菌体外抑菌活性的研究结果
2.2.1 润肤消炎洗剂对金葡菌体外抑菌情况 结果发现,阴性对照组无抑菌作用;润肤消炎洗剂 (中药浓度1 g/ml)对标准金葡菌和MRSA均具有抑菌作用,其抑菌作用与阳性对照组 (2%夫西地酸)的抑菌作用有显著差异,差异有统计学意义 (p<0.01,见表2);即润肤消炎洗剂组对MRSA抑菌作用较好,而阳性对照组则对标准金葡菌抑菌作用较好。
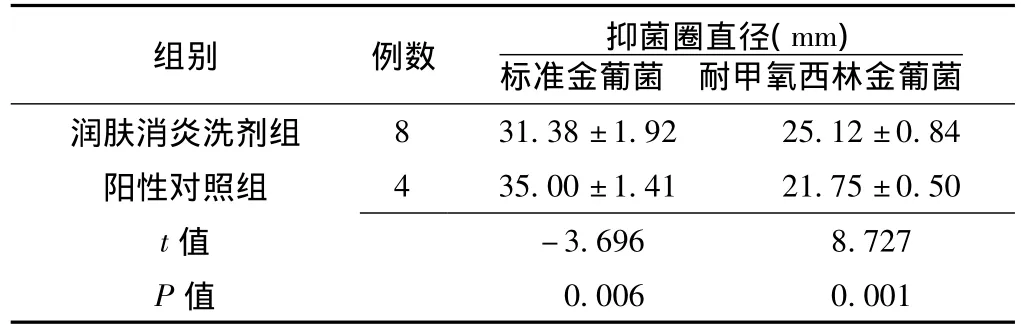
表2 润肤消炎洗剂对标准金葡菌和耐甲氧西林金葡菌的体外抑菌情况Table 2 The vitro bacteriostasis of anti-inflammatory moisturizing washing formula for the standard staphylococcus aureus and MRSA
2.2.2 摄像 对实验结果进行摄像,作为客观评价的可循依据。发现浓度1∶1的润肤消炎洗剂和2%夫西地酸对标准金葡菌及MRSA均有明显抑菌作用,药敏纸片周围可见边界清楚的透明抑菌环 (见图3~6)。
3 讨论
AD是一种与遗传相关的慢性复发性炎症性皮肤病,多发于儿童和青少年[3]。金葡菌与AD的发病、病情加重和复发关系密切,它不但使AD的临床过程复杂化,更损害皮肤的屏障功能,使皮肤感染持续和加重。金葡菌可产生多种肠毒素,尤其是金葡菌肠毒素 (SEA、SEB、SEC、SED)及中毒休克综合征毒素 (TSST)可作为超抗原,刺激T淋巴细胞和B淋巴细胞活化,促进特异IgE分泌,诱发和加重皮损[4]。
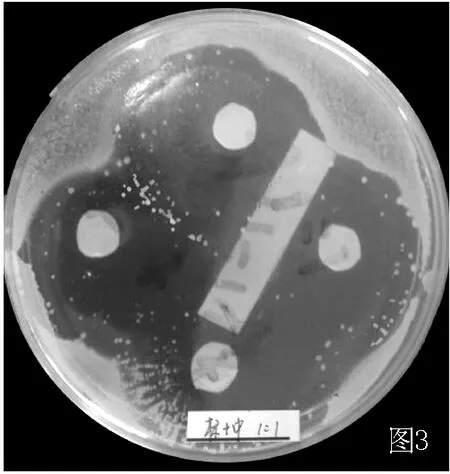
图3 润肤消炎洗剂 (浓度1∶1)对金葡菌的抑菌效果Figure 3 The bacteriostasis of the herbal washing formula(herbal concentration retain 1 g/ml)to standard staphylococcus aureus
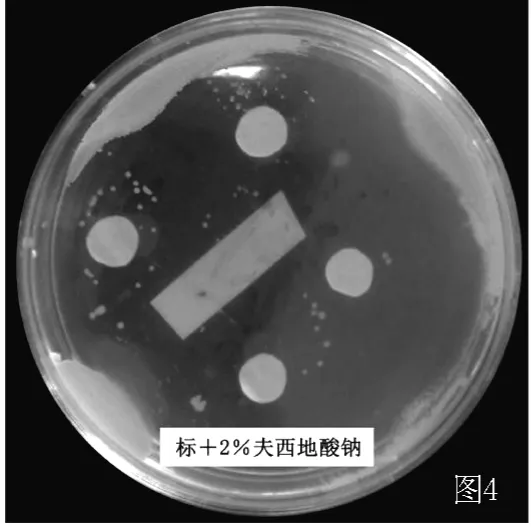
图4 2%夫西地酸钠对金葡菌的抑菌效果Figure 4 The bacteriostasis of 2%fusidic acid to standard staphylococcus aureus
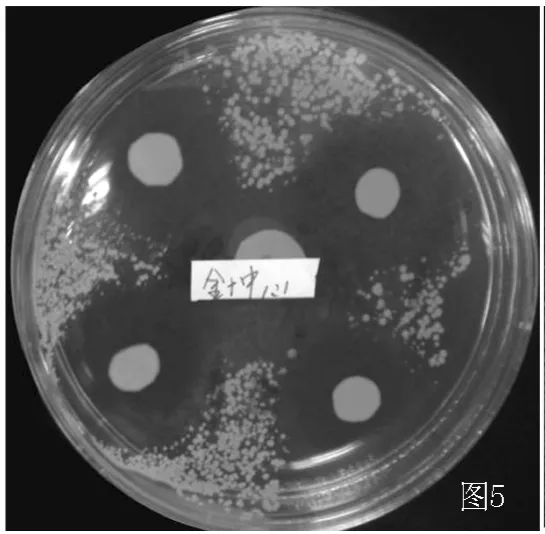
图5 润肤消炎洗剂 (浓度1∶1)对MRSA的抑菌效果Figure 5 The bacteriostasis of the herbal washing formula(herbal concentration retain 1 g/ml)to MRSA
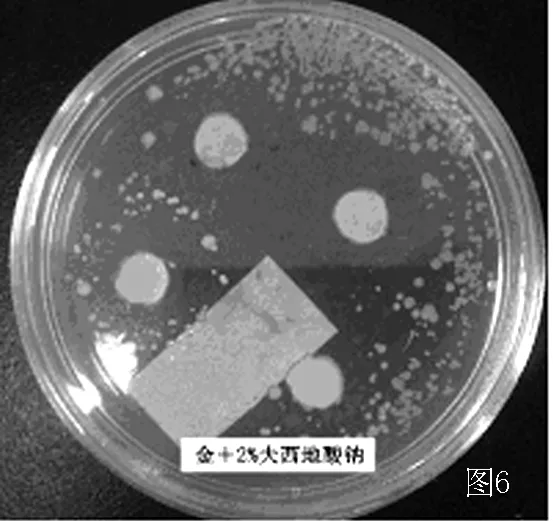
图6 2%夫西地酸钠对MRSA的抑菌效果Figure 6 The bacteriostasis of 2%fusidic acid to MRSA
润肤消炎洗剂为陈达灿教授在长期临床实践中总结的外用治疗AD的中药验方[5],以金银花等中药共奏润肤消炎止痒之功。本研究初步探讨了润肤消炎洗剂对AD皮损金葡菌定植密度的影响,发现用润肤消炎洗剂治疗后AD靶皮损金葡菌定植密度显著低于对照组皮损,表明润肤消炎洗剂能有效抑制AD皮肤金葡菌的定植和感染。此外,体外实验显示,润肤消炎洗剂对金葡菌标准株、MRSA的感染有着较好的抑菌作用。因此,抗炎、抑制金葡菌可能是润肤消炎洗剂起作用的主要机制之一。
1 郝飞,宋志强.特应性皮炎 [M].北京:人民军医出版社,2008:47-50.
2 赵辨.中国临床皮肤病学[M].南京:江苏科学技术出版社,2010:738.
3 韩雪松,岳利英,周向昭.特应性皮炎患儿外周血嗜酸粒细胞计数及其与血清IgE水平的关系[J].中国全科医学,2010,13(12):4011.
4 李邻峰.特应性皮炎[M].北京:北京大学医学出版社,2006:36-38.
5 林颖,黄楚君,朱海莉.陈达灿教授以中医外治法治疗特应性皮炎经验介绍 [J].新中医,2011,5(5):151-153.
