内皮祖细胞移植对犬心肌梗死后血管新生、心肌修复及心功能的影响*
2011-05-07陈图刚谭维羚马战清钟志英孙国锋周宇昕
陈图刚 谭维羚 马战清 钟志英 孙国锋 周宇昕
(南昌大学第四附属医院 江西南昌330003)
血管内皮祖细胞 (endothelial progenitor cells,EPCs)是血管内皮的前体细胞。新近研究表明血管内皮祖细胞不仅参与胚胎期的血管发育,也存在于成年机体的骨髓及外周血中,在成体血管新生中起重要作用[1]。在组织损伤、缺血或梗死灶中有骨髓来源的血管内皮祖细胞聚集,并在原位分化为成熟内皮细胞形成新的血管。这一重大发现为缺血性疾病的治疗提供了新的方法。本实验采用犬外周血血管内皮祖细胞体外扩增后,在超声引导下,经皮穿刺行心肌梗死犬心外膜下移植EPCs,观察其对急性心肌梗死后心肌再生及心功能改变的影响,并评价移植的效果及安全性,以探索促进组织或器官血管新生的新方法。
1 材料与方法
1.1 实验动物 成年雄性家犬麻醉后平卧于设有大型X线机手术台上,经右侧股动脉穿刺置入6F动脉鞘管,经股动脉弹丸式注入肝素钠2 500 U,后每隔1 h追加肝素钠1 250 U。用经塑型的冠脉指引导管行冠脉造影,造影后置入PTCA球囊导丝,在导丝指引下置入2.5 mm×20 mm球囊至前降支前中段交界处以4~6 atm打开球囊堵塞冠脉,造影示球囊远端血流中断。球囊保持充盈90 min,此间持续监测压力及电活动。术后每天肌肉注射青霉素160万U,持续3 d。
1.2 犬EPCs培养、鉴定
1.2.1 EPCs的采集、分离和培养 犬心肌梗死2周后,采用密度梯度离心法从外周血获得单个核细胞,将其接种在人纤维连接蛋白包被的培养板上。M199培养基(含20%胎牛血清、青霉素100 U/mL、链霉素100 U/mL)培养4 d,用PBS洗掉非贴壁细胞,换培养液继续培养至7 d,用PBS洗掉非贴壁细胞,贴壁细胞供实验用。
1.2.2 EPCs的 鉴 定 细胞与 acLDL-Dil(2.4 μg/mL)37℃下孵育1 h以检测EPCs对DiLDL的摄取。然后用2%多聚甲醛固定细胞10 min。固定后用 PBS浸洗,将FITC-UEA-Ⅰ(10 g/mL)加于上述标本于37℃下孵育1 h。激光共聚焦显微镜(laser scanning confocal microscope,LSCM,Leica)鉴定FITC-UEA-I和Dil-acLDL双染色阳性细胞为正在分化的EPCs,在倒置荧光显微镜下对每孔计数。细胞表型检测:用0.25%胰蛋白酶消化收集贴壁细胞并计数,将2×105贴壁细胞分别与PE标记的VEGFR-2、AC133和CD34单克隆抗体在4℃孵育30 min后,用PBS洗细胞2次,最后用300 μL PBS悬浮细胞后于流式细胞仪上检测。
1.3 实验分组及经皮穿刺行心肌梗死犬心外膜下移植EPCs 犬心肌梗死模型手术后4周,再次经肌肉注射氯胺酮(5 mg/kg)和速眠新(0.08 mL/kg)诱导麻醉,将动物平卧于动物实验台上,随机分成两组行细胞移植术,一组为对照组,注入2 mL生理盐水(n=6);另一组注入 2 mL EPCs(n=6)。左心前区皮肤消毒,铺无菌巾,二维超声心动图直引下,穿刺心外膜下心肌,监测电极显示ST段抬高,即注入细胞悬液0.2 mL,改变不同方向,每一点分别注射0.2 mL生理盐水或EPCs悬液,共10点。注射中均可见室性期前收缩及短阵室速,注射停止则期前收缩消失。
1.4 梗死心肌组织内微血管计算 梗死区心肌石蜡包埋的组织切片采用CD34免疫组化染色。CD34定位于内皮细胞胞浆,显示棕黄色或棕褐色,每份标本均选3个低倍视野(200×)、计数每个低倍视野的微血管数,取3个低倍视野微血管数为该份标本的平均微血管密度(MMVC)。
1.5 心肌梗死面积测量 移植后8周,开胸取出心脏,剪除双侧心房、右心室,沿左心室长轴由心尖到心底部做2 mm厚切片,共切5片。冲洗后,置于1%TTC溶液(以0.2M HCl,pH=7.8为缓冲液)中,37℃水浴箱中热浴15 min后,显示存活的心肌染成红色,坏死心肌为白色。用TJTY-400型多媒体彩色病理图文分析系统进行图像分析,该系统自动测量出每层的心肌梗死面积占总面积的百分比。每层梗死心肌的容积=每层面积×厚度(2 mm),将5张切片中每层梗死心肌容积相加即为整个心肌的梗死面积(%)。
1.6 超声心动图心功能检查 于细胞移植术1、2、4、8周后行超声心动图检查,测量左心室射血分数(LVEF)。
2 结果
2.1 梗死区心肌微血管数量(血管密度)检测 各个时段移植组梗死区血管密度明显高于对照组,且随着移植观察时间的延长,血管密度逐渐增加。见表1。
表1 两组梗死心肌血管密度比较 (±S) 个/视野

表1 两组梗死心肌血管密度比较 (±S) 个/视野
注:与对照组比较,*P <0.05,**P <0.01。
组别 1周 2周 4周 8周对照组 75.58±6.59 86.32±7.54 97.48±7.47 105.93±8.16内皮祖细91.13±8.65*111.65±13.76**129.87±15.31**141.46±15.86**胞移植组
2.2 心肌梗死面积测量 移植1、2、4、8周后梗死心肌面积明显小于对照组(P<0.01),且随移植观察时间的延长,梗死心肌面积逐渐减少。内皮祖细胞移植组梗死心肌瘢痕边缘毛细血管密度明显高于对照组。见表2。
表2 两组心肌梗死面积的比较 (±S) cm2
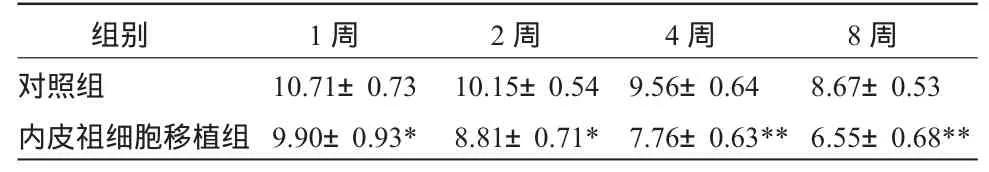
表2 两组心肌梗死面积的比较 (±S) cm2
注:与对照组比较,*P <0.05,**P <0.01。
组别 1周 2周 4周 8周对照组 10.71±0.73 10.15±0.54 9.56±0.64 8.67±0.53内皮祖细胞移植组 9.90±0.93* 8.81±0.71* 7.76±0.63**6.55±0.68**
2.3 左室射血分数 应用超声心动图检测心功能,内皮祖细胞移植组的左室射血分数较对照组明显提高(P<0.01),且随移植观察时间的延长,左室射血分数逐渐升高。见表3。
表3 两组LVEF比较 (±S)
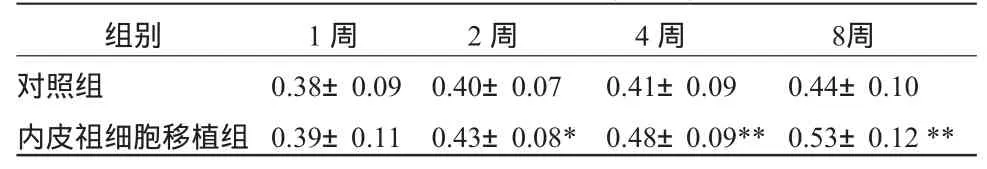
表3 两组LVEF比较 (±S)
注:与对照组比较,*P <0.05,**P <0.01。
组别 1周 2周 4周 8周对照组 0.38±0.09 0.40±0.07 0.41±0.09 0.44±0.10内皮祖细胞移植组 0.39±0.11 0.43±0.08* 0.48±0.09**0.53±0.12**
3 讨论
缺血性心脏病是临床常见的疾病,尽管经皮冠状动脉腔内成形术(PTCA)、冠状动脉旁路移植术(CABG)、激光心肌血运重建术等已得到广泛应用,但仍有部分患者不适合或无效,无法重建血运。近年来人们提出了血管形成(angiogenesis)治疗方法来重建血运。治疗性心肌血管新生(therapeutic angiogenesis)是指应用药物、基因治疗或其它治疗手段刺激心肌缺血区小血管生长和侧支循环形成,达到改善心肌缺血的目的[2]。这给冠心病,特别是不适宜PTCA、CABG,药物治疗效果又欠佳者带来希望。促进血管新生是治疗冠心病的理想方法,一般可通过以下四个途径达到目的:(1)局部应用促血管新生的多肽生长因子;(2)转染血管新生的基因;(3)开发心内膜的小通道,以增加从左室腔向心肌流向的血流通道;(4)局部血管应用干(祖)细胞[2~3]。
心血管疾病时血管新生主要发生在缺血性心血管病,此时其代偿主要靠侧枝循环的建立(collateral vessel recruitment)[4]。但是机体内源性侧枝循环的代偿是很有限的,极少能完全补偿因血管闭塞而造成之血流量减少,因此近年出现了促血管新生治疗或称治疗性血管新生[5~6]。本实验显示自体血管内皮祖细胞移植1、2、4、8周后梗死区血管密度高于对照组(P<0.01),且随移植观察时间的延长,血管密度逐渐增加。移植1、2、4、8周后梗死心肌面积明显小于对照组(P<0.01),且随移植观察时间的延长,梗死心肌面积逐渐减少。内皮祖细胞移植组梗死心肌瘢痕边缘毛细血管密度明显高于对照组。内皮祖细胞移植组的左室射血分数较对照组明显提高(P<0.01),且随移植观察时间的延长,左室射血分数逐渐升高。可见自体血管内皮祖细胞移植到心肌梗死犬缺血心肌后能分化为毛细血管内皮细胞,促进梗死后心肌血管新生及心肌修复,改善心功能。
[1]Gill M,Dias S,Hattori K,et al.Vascular trauma induces rapid but transient mobilization of VEGFR2(+)AC133(+)endothelial precursor cells[J].Circulation Research,2001,88:167-174
[2]Assmus B,Schachinger V,Teupe C,et al.Transplantation of progenitor cells and regeneration enhancement in acute myocardial infarction[J].Circulation,2002,106:3 009-3 017
[3]Beltrami AP,Barlucchi L,Torella D,et al.Adult cardiac stem cells are multipotent and support myocardial regeneration[J].Cell,2003,114:763-776
[4]Freedman SB,Isner JM.Therapeutic angiogenesis for ischemic cardiovascular disease[J].J Mol Cell Cardiol,2001,33:379-393
[5]Tateishi-Yuyama E,Matsubara H,Murohara T,et al.Therapeutic angiogenesis for patients with limb ischaemia by autologous transplantation of bone-marrow cells:a pilot study and a randomised controlled trial[J].Lancet,2002,360:427-435
[6]Okada M,Payne TR,Zheng B,et a1.Myogenic endothelial cells purified from human skeletal muscle improve cardiac function after transplantation into infarcted myocardium [J].J Am Coll Cardiol,2008,52(23):1 869-1 880
