可视嗅觉电子鼻设计及其对三甲胺的定量检测*
2011-05-06杨建华唐忠林陈立伟
侯 震,杨建华,唐忠林,陈立伟
(西北工业大学自动化学院,西安 710072)
三甲胺是一种具有鱼腥氨气味的有毒有害挥发气,对人类的嗅觉阈值为 510×10-12。三甲胺的存在及其浓度是评估肉类和鱼类食品质量的重要标准[1-2],是表征某些代谢缺陷疾病的气味标识[3],是环境恶臭污染控制的主要对象,是某些工农业生产质量控制的关键参数[4-5]。目前对三甲胺的检测方法主要包括气相色谱法,离子色谱法,质谱法等经典的仪器分析方法[6]和使用金属氧化物传感器[7-8],导电聚合物传感器[9]等作为气体敏感装置的电子鼻方法。经典的仪器方法技术成熟,有许多成功应用的案例,但使用起来费时费力成本高;基于电子鼻的方法方便快捷,前景广阔,但总的来说还是定性识别的多,定量检测的少,而且由于敏感原理的限制,在气体识别的分辨力和气体检测的灵敏度以及抗湿度干扰等方面还有待加强[10]。
本文介绍一种可用于对三甲胺进行定量检测的可视嗅觉电子鼻系统及方法。可视嗅觉电子鼻是对人类嗅觉的模拟,它用嗅觉仿生材料作为气味敏感单元,利用敏感单元阵列与气味分子接触前后颜色变化的“味纹”来识别和检测气体[11-12]。合理选择敏感材料,可视嗅觉电子鼻能通过结合能和选择性都很高的配位键,π-π键,以及氢键等分子间相互作用对配体分子,芳香族分子和含氢原子的极性分子敏感,在对不同气体的识别分辨力和对同种气体的检测灵敏度上有较大优势[10,13],其中前者也已经在我们前期的工作中得到了验证[14]。
1 可视嗅觉电子鼻检测装置的设计
1.1 气体敏感单元的设计
三甲胺是典型的配体分子,可以选用具有配位中心的卟啉和酞菁类化合物作为三甲胺敏感材料。卟啉和酞菁分子在可见光照射下产生 π-π*电子跃迁,在三甲胺分子的配位作用下,其前线轨道能级和对称简并度等发生不同程度的改变[15],使其吸收光谱改变,最终表现为颜色变化。选购了六种敏感材料并用溶液滴注的方法在反相硅胶板上制作了六点可视嗅觉敏感阵列[14]。为了方便平时的储存和避免实验过程中不同样本气体对检测装置的污染,设计了透明且密封的阵列封装盒。敏感阵列和封装盒一起组成可视嗅觉气体敏感单元,其实拍图像如图1所示。平时将封装盒中充满氮气密封后在 5℃条件下避光保存,使用时气体经盒体两侧的气管流经盒腔并与敏感阵列反应,从而防止实验气体对检测装置其它部位的污染。

图1 敏感阵列和阵列封装盒的实拍图像
1.2 颜色传感器的选择
可视嗅觉电子鼻通过测量气体敏感材料与气体反应前后的颜色变化来检测和识别气体,因此选择合适的颜色传感器非常重要。从仪器研制的角度出发,希望颜色传感器体积小巧便于集成、测量实时可以全自动操控、数据结构和接口简单便于在线处理。各种彩色 CCD和 CMOS图像传感器可以满足上述要求。分别对几款不同等级的 CCD和 CMOS图像传感器的颜色测量表现进行了测试,发现CMOS传感器的颜色测量值都存在较大的时间漂移现象,在测量的起始阶段表现尤为明显,而CCD传感器的表现则较为稳定。图 2为一款 24位消费级 CCD传感器与某款价格相当的工业级 CMOS传感器在 20 min内对一片反相硅胶板进行颜色测量的情况,三条曲线分别代表传感器的 RGB三个颜色通道在整个板平面的测量平均值并做了去时间平均处理。对 8位单通道量程,该 CCD传感器在 20min内颜色测量的波动范围在 ±0.5个单位以内。对 9种 NCS标准色的测量表明,该 CCD传感器对不同颜色的测量表现是一致的。因此本实验选用了此 CCD器件作为可视嗅觉颜色传感器。
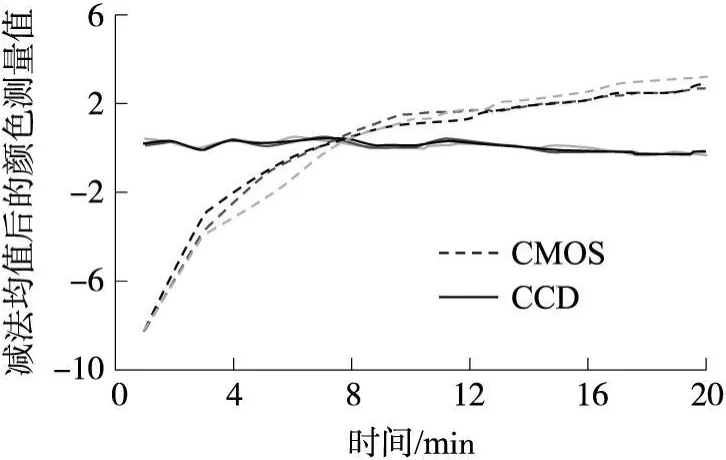
图2 CCD和CMOS图像传感器的颜色测量稳定性比较
1.3 照明光源的设计
照明光源是影响颜色测量的关键因素之一。根据卟啉和酞菁类的典型吸收光谱[13],本实验选用YAG荧光粉封装的白光 LED作为测色照明光源,其发射光谱与卟啉和酞菁的典型吸收光谱有较好的一致性。由于 LED光源具有较强的指向性,结合所设计的可视嗅觉检测装置的总体结构,设计了一种特殊的反光曲面并辅以适当的散光涂料,使 LED光源发出的光均匀地漫射在整个敏感单元的表面,并可以在观测条件下消除阵列封装盒透光表面的镜面反射。用一块干净反相硅胶板对光源照明的空间均匀性进行了测量。对应 6点敏感阵列的结构,将测试板分成 6块子区域,各子区域的颜色测量差值在一个单位以内。考虑到硅胶板本身的颜色不均匀,认为光源照明是比较均匀的,与 CCD测色的时间波动幅度相当。
2 可视嗅觉对三甲胺的定量检测实验
2.1 可视嗅觉电子鼻检测系统的设计
可视嗅觉电子鼻检测系统如图 3所示。流量计(LZB-3,银环流量)的量程为 60~600mL/min,微型真空泵(VM 8001-12V,成都锐意)的最大真空度为80 kPa,检测装置通过 USB接口与上位机通讯。通过三通阀切换样本气和氮气,通氮气的目的包括清洗气路和在进行敏感阵列的重复性实验时对阵列进行复原。检测装置底部设计有敏感单元的安装座,对每种气体样本分别用一个敏感单元进行检测。
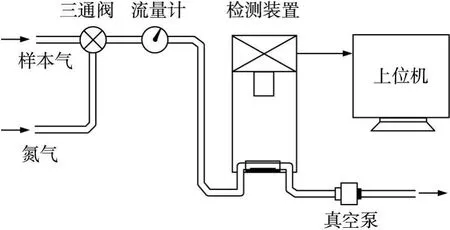
图3 可视嗅觉电子鼻检测系统
2.2 不同浓度样本气体的配置
使用气体采集袋静态配气法配置各种气体浓度。分析纯三甲胺水溶液购自陕西省化玻总站,气体采集袋(PL-S-5,美国 PL)为 5L标准 TEFLON采样袋,稀释气为高纯氮气。根据美国化学文摘社(CAS)颁布的安全标准(CAS Reg.No.75-50-3,2008,06)和我国恶臭污染物排放标准(GB14554-93),实验中配置的各种浓度样本为:170×10-6(接触 8 h可致命的最低浓度);51×10-6(接触 8 h可造成永久或重大伤害的最低浓度);25×10-6;8×10-6(接触 8 h以内会引起不适但不会造成严重伤害);2×10-6;500×10-9;125×10-9(我国恶臭标准规定的引起环境恶臭污染的浓度中间值);50×10-9(用以测试系统的检测灵敏度)。
2.3 实验方法
用高压氮气吹洗气路后,调节流量计和真空泵使气体流量保持在 200 mL/min。安装好气体敏感单元,把某种浓度的样本气袋和氮气袋分别接在可视嗅觉电子鼻检测系统的对应进气口上,调节三通阀,先通氮气 5 min,再通样本气体 6 min,接着通氮气 9 min,如是重复三个周期完成一次检测,其间每20 s拍照一幅。对每种浓度的样本气体分别用三个敏感单元进行三次检测。
3 结果与讨论
3.1 敏感元素对气体样本的颜色响应过程
本文对所有颜色测量值都进行了如下预处理:敏感阵列上各敏感元素的颜色用元素中心区域内200个像素的平均 RGB值表示,对一次测试全程的各敏感元素的各颜色通道的颜色测量值序列进行五点复合滤波处理,复合算法包括中值滤波和平均滤波。
对于配置的前 7个浓度,取某次检测的第 1个气体响应周期进行分析。阵列上某点敏感元素对这7种浓度三甲胺气体的颜色响应情况如图 4所示,图中横坐标表示 CCD传感器拍摄的图像帧序数,帧与帧间隔 20 s;纵坐标表示各帧上该敏感元素的颜色相对于第 15帧上该元素颜色的差值。由于卟啉和酞菁的可见光吸收带主要位于蓝绿光谱区,所选敏感元素的红色(R)通道对各种样本气体几乎没有颜色响应,故图中只给出了蓝色(B)通道(0水平坐标以下)和绿色(G)通道(0水平坐标以上)的响应值。从图 4可以看出,在三甲胺的作用下,所选敏感元素的蓝色通道值减小,绿色通道值增加,不同浓度下的颜色增减速率和幅度各不相同。对 25×10-6及以下浓度的三甲胺,在反应后再通氮气的 9 min内,该敏感元素颜色能够复原;对 51×10-6和 170×10-6的三甲胺,反应后再通氮气 9 min不能使敏感元素复原。该敏感元素对 25×10-6及以上浓度的分辨能力很强,对 8×10-6以下浓度的分辨能力逐渐减弱,其中绿色通道的分辨力要好于蓝色通道。其它敏感元素有类似的响应形式,但其颜色响应速率和幅度,可重复响应的浓度阈值和浓度分辨力等互有差别,它们的差异性响应构成了能对各种浓度三甲胺气体进行定量检测的颜色响应“味纹”。
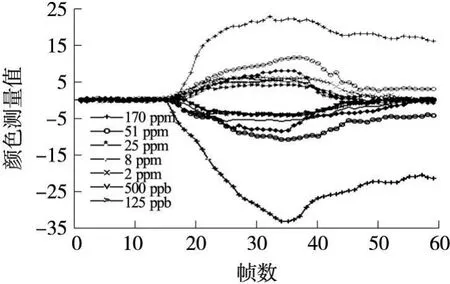
图4 某敏感元素对不同浓度样本气体反应的颜色变化过程
3.2 基于响应动态过程的特征提取
对于 6点敏感阵列,对测试气体的颜色响应共有 18个信号通道。对不同浓度的样本气体,在一个测试周期的后 15min内,这 18个颜色信号通道的变色速率,变色幅度和颜色回复情况等综合信息各不相同,可构成三甲胺浓度检测的颜色“味纹”。可用公式(1)提取可视嗅觉电子鼻对浓度为 x的三甲胺样本气的响应特征向量:
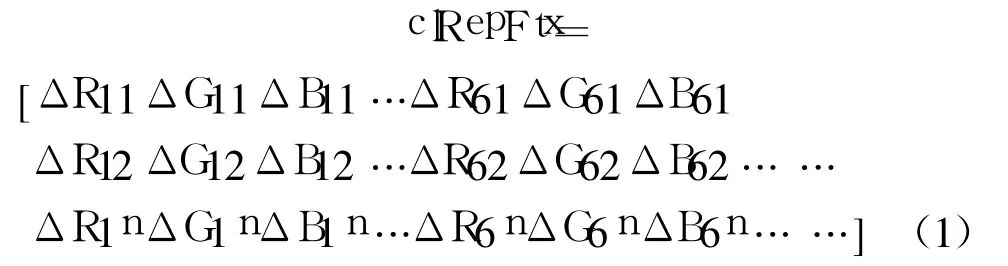
式(1)中,RGB代表各敏感元素的红绿蓝三个颜色通道。对各颜色通道,以 ΔRmn为例,m取值范围为从 1到 6,分别表示敏感阵列上的六个敏感元素;在第一个测试周期内 n的取值范围为从 1到45,为测试周期后 15 min内通三甲胺和通回复氮气后拍摄的第 16到第 60幅图与通三甲胺前第 15幅图的帧差值,帧间时间差为 20 s。以第 15幅图的颜色状态表示敏感阵列反应前的初始状态,这样ΔRmn表示敏感阵列上第 m个元素的红色通道在响应的第 20 s的值相对于初始值的差值。特征向量clRepFtx全景式地反应了各种浓度的三甲胺对可视嗅觉敏感阵列颜色的影响,可构成反应样本浓度的完备特征。
3.3 颜色响应特征的主成分分析
选用通三甲胺后的第 40 s,第 60 s和第 120 s构建特征向量,对应公式(1)中下标 n的取值为 1,3,6。这样对每次测试,可以得到一个 48维的特征向量,对前 7个浓度的总共 21次测试,可以得到一个48×21的特征矩阵。对该特征矩阵进行了主成分分析(PCA),求出各特征向量的主分量,并将各特征向量在第 2和第 3主分量上投影可得到图 5a所示的特征向量主成分得分图。从图 5a可以看出,可视嗅觉电子鼻对不同浓度三甲胺响应的特征向量在第2和第3主成分平面上的投影是线性可分的,表明所设计的可视嗅觉电子鼻能对这 7中不同浓度的三甲胺气体进行正确区分。在图 5a中,颜色响应模式相差很大的170×10-6和 125×10-9的投影点反而靠的比较近,这是因为这种反差能量主要集中在第一主分量,如图5b所示,在这里可视嗅觉电子鼻对 170×10-6浓度三甲胺的响应特征向量投影远离其它浓度,与图 4中的情况相一致。图 5b中的内嵌框图为去除 170×10-6映射后的第一和第二主分量得分图,可以清楚地看出各种浓度的三甲胺是线性可分的。
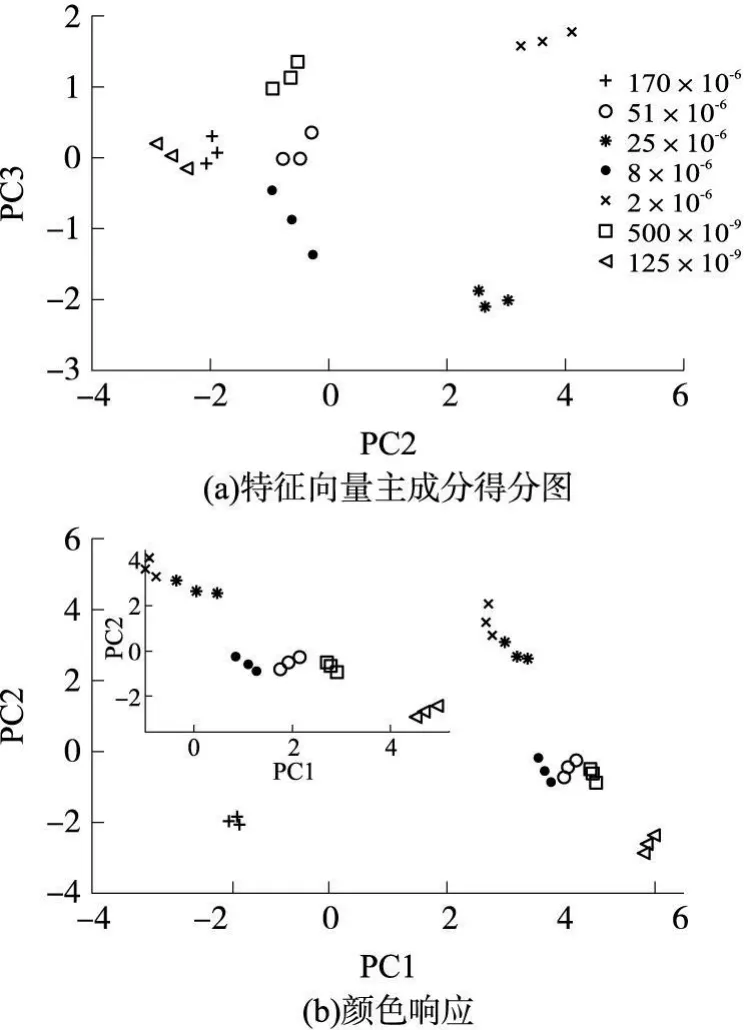
图5 可视嗅觉电子鼻对不同浓度三甲胺响应的特征向量主成分得分图
3.4 检测灵敏度和颜色响应的重复性
在实验程序设计中就可视嗅觉敏感单元对各种浓度三甲胺样本响应的重复性进行了测试,并用 50×10-9的浓度样本对系统的三甲胺检测灵敏度进行了检验。结果表明,就所进行的实验流程而言,可视嗅觉敏感单元对 25×10-6及以上浓度的三甲胺气体响应后不能通过 9min的氮气清洗复原,对 8×10-6及以下浓度的三甲胺气体可以重复检测。即使对 50×10-9的低浓度,所设计的可视嗅觉电子鼻也有明显的响应信号。对 8×10-6和 50×10-9,在一次检测的三个周期内,可视嗅觉敏感阵列上各敏感单元的所有 18个颜色通道相对于初始状态颜色改变值的绝对和如图 6所示。可见对于安全浓度以下的三甲胺气体,可以用同一片可视嗅觉敏感阵列进行重复检测,危险浓度会造成敏感阵列响应饱和与不可逆。50×10-9的检测灵敏度要高于现有的绝大多数三甲胺检测方法,而且就单纯的阈值检测来说,本文所介绍的系统能够达到比 50×10-9更低的检测限。
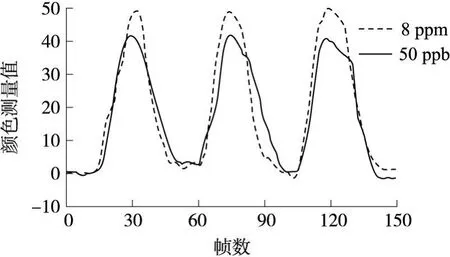
图6 敏感单元的颜色响应重复性曲线
4 结论
在设计的可视嗅觉电子鼻敏感单元中,所选择的敏感材料分子主要与三甲胺分子发生配位作用并显示为颜色变化。配位作用是分子间一对一的相互作用,因此从理论上来说,在单纯的背景气氛下,即使只有一颗三甲胺分子存在也可以被检测到。然而CCD的像元尺寸(μm级)通常是 3倍量级于卟啉和酞菁的分子尺寸(nm级),因此即使在敏感材料分子单层平铺和成像条件为等焦物距的理想情况下,一个 CCD像元内也有百万量级的敏感材料分子。一个 CCD像素的颜色测量值实际上是这百万个分子颜色的分级积累平均。一个三甲胺分子引起一个敏感材料分子的颜色改变量是一定的,假设 K个三甲胺分子的作用可导致 CCD测量值一个单位的颜色改变,那么对于某一确定的敏感单元空间结构,K个三甲胺分子所对应的浓度就是所设理想条件下可视嗅觉电子鼻的检测最低限和浓度分辨率。实际情况要复杂得多,然而即使这样,我们设计的可视嗅觉电子鼻也实现了 ×10-9级的三甲胺检测灵敏对并能对 7个典型浓度进行正确分类。通过优化阵列加工工艺和使用性能更好的成像设备有望进一步提高可视嗅觉电子鼻的气体检测性能,这些工作正在进行之中。
[1]Wu T H,Bechtel P J.Ammonia Dimethylam ine Trimethylamine and Trimethylam ine Oxide from Raw and Processed Fish By-Products[J].Journal of Aquatic Food Product Technology,2008,17(1):27-38.
[2]Chan S T,Yao MW Y,Wong Y C,et al.Evaluation of Chemica1 Indicators for Monitoring Freshness of Food and Determination of Volatile Am ines in Fish by Headspace Solid-Phase Microextraction and Gas Chromatography-Mass Spectrometry[J].Eur Food Res Techno1,2006,224:67-74.
[3]Bain M A,Fauu R,Fornasini G,et a1.Accumulation of Trimethylamine and Trimethylamine-N-Oxide in End-Stage Renal Disease Patients Undergoing Haemodialysis[J].Nephrok Dia1Transplant,2006,21:1300-1304.
[4]丁永胜,牟世芬.离子色谱法测定饲料中氯化胆碱和三甲胺的含量[J].色谱,2004,22(2):174-176.
[5]夏枚生,胡彩虹.气相色谱法快速测定甜菜碱盐酸盐中三甲胺的含量[J].浙江大学学报:农业与生命科学版,1999,25(6):608-610.
[6]邓后勤,夏延斌,邓友光,等.三甲胺测定方法的研究进展[J].食品与发酵工业,2005,31(12):84-88.
[7]Hammond J,Marquis B B,Michaels R,et a1.A Semiconducting Metal-Oxide A rray for Monitoring Fish Freshness[J].Sensors and Actuators B,2002(84):113-122.
[8]ZhangW H,ZhangW De.Fabrication of SnO2-ZnO Ranocomposite Sensor for Selective Sensing of Trimethylamineand the Freshness of Fishes[J].Sensors and Actuators B,2008(134):403-408.
[9]Bai H,Shi G Q.Gas Sensors Based On Conducting Polymers[J].Sensors,2007,7(3):267-307.
[10]Janzen M C,Ponder JB,Balley D P,et al.Colorimetric Sensor Arrays for Volatile Organic Compounds[J].Analytical Chemistry,2006(78):3591-3600.
[11]Suslick K S,Rakow N A.A Colorimetric Nose:“Smell-Seeing”Artificial Chem ical Sensing[C]//Olfaction and the Electronic Nose Stetter,JR,Pensrose,W R Electrochem Soc:Pennington,NJ,2001:8-14.
[12]Wang JY,Luthey-Schulten Z A,Suslick K S.Is the Olfactory Receptor a Metalloprotein?[J].PNAS,2003,100(6):3035-3039.
[13]Sen A,Albarella JD,Carey JR.Low-Cost Colorimetric Sensor for the Quantitative Detection of Gaseous Hydrogen Sulfide[J].Sensors and Actuators B:Chemical,2008,13(1):234-237.
[14]唐忠林,杨建华,徐颖,等.可视嗅觉敏感阵列对几种分支胺的识别[J].传感技术学报,2009,22(5):618-622.
[15]Gouterman M.Spectra of Porphyrins[J].Journal of Molecular Spectroscopy,1961,6:138-163.
