FOXO3a基因转染对血管损伤后新生内膜增生的影响
2011-04-12胡萍盛净蔡文玮马绍骏孙赟
胡萍,盛净,蔡文玮,马绍骏,孙赟
(上海交通大学医学院附属第九人民医院老年科,上海 200011)
经皮冠状动脉腔内成形术(PTCA)的应用为冠心病的治疗开辟了崭新的途径,但 PTCA术后血管再狭窄仍然是临床上急需解决的难题。大量研究证实,血管平滑肌细胞(VSMC)过度增生所致的新生内膜增厚是造成再狭窄的主要原因[1]。多种生长因子、细胞因子及细胞外信号调节因子等参与其病理生理过程。转录因子是一类 DNA结合蛋白,它们与基因启动子中特定序列结合来调节基因的表达,越来越多的研究表明,从转录水平上针对调节细胞增殖、迁移、凋亡等最终共同通路的关键基因进行调控,可以有效防止再狭窄的发生。
转录因子 FKHRL1(FOXO3a)是 forkhead转录因子家族中的重要成员,其主要通过转录调控在细胞的生长、分化、代谢、凋亡和免疫等方面起关键作用[2]。并且在血管成形术后再狭窄过程中参与了血管壁病理生理相关的靶基因的调控,在信号传导通路中发挥决定性的作用。研究表明,磷酸化是Forkhead转录因子家族成员重要的上游修饰途径[3]。而 Forkhead转录因子家族成员是 PI3K/Akt信号途径下游最重要的转录因子[3]。各种外界刺激以及生长、细胞因子的作用均可激活 PI3K,活化Akt,从而磷酸化转录因子 FOXO3a,使其从细胞核中排除,易位到细胞浆中,降低转录激活靶基因的活性,从而促进细胞的生长和增殖[4]。本研究利用基因转染的方法使平滑肌细胞中 FOXO3a转录因子表达增加和转录活性增强,观察其对新生内膜增生及血管狭窄的影响,探寻防治 PTCA术后再狭窄的措施,为后期的临床实验提供理论和实验依据。
1 材料和方法
1.1 材料 清洁级雄性 Wistar大鼠,2月龄,体质量 160~190 g,购自中国科学院上海实验动物中心。
1.2 主要仪器与试剂 HA-FOXO3a-TM质粒(Addgene公司,美国),Lipofectam ine 2000(Invitrogen公司,美国),胎牛血清(FBS,HYCLONE公司,美国);DMEM培养基(GiBico公司,美国);SMα-actin抗体(DAKO公司,丹麦);HA抗体、FOXO3a抗体(Cell Signaling,美国);动脉取血栓球囊导管(120602F爱德华生命科学有限公司,美国);自动 CO2孵箱(Forma Scientific,美国);生物光学显微镜(Nikon,日本)。
1.3 实验方法
1.3.1 分组和建模 将 54只大鼠随机分成空白对照组、质粒对照组和 HA-FOXO3a-TM组,每组 18只。
大鼠颈总动脉球囊损伤模型建立:以上各组大鼠均腹腔注射戊巴比妥钠(40 mg/kg)麻醉,沿颈前正中线切开皮肤,在颈前三角区暴露左颈总动脉及左颈内、外动脉。自颈外动脉切口插入 2F动脉取血栓球囊导管至颈总动脉处,注入 0.9%氯化钠注射溶液以扩张球囊,慢速回拉球囊至颈内外动脉分叉处,抽出球囊液体,重复共 3次,然后撤出导管,结扎颈外动脉[5]。
1.3.2 HA-FOXO3a-TM体内转染 采用脂质体载体 Lipofectamine 2000介导质粒 pECE-HA-FOXO3a-TM以及空载对照质粒 pECE(-)分别转染 HAFOXO3a-TM组和质粒对照组,按试剂转染说明书,先在无菌离心管中将 Lipofectam ine 2000分别与pECE-HA-FOXO3a-TM以及空载对照质粒 pECE(-)混匀,室温静置 45~60 min进行脂质体包裹。在各组大鼠颈总动脉被球囊导管剥脱撤出导管后,在颈总动脉两端暂时阻断血流,0.9%氯化钠注射溶液冲洗管腔后各组分别于颈外动脉切口处注入两组转染液及 PBS液至损伤的颈总动脉,使各组干预液体在颈总动脉内保留灌注 30min后0.9%氯化钠注射溶液冲洗管腔,血管再通,恢复血流,缝合切口,继续饲养。
1.3.3 球囊损伤后血管平滑肌细胞培养和鉴定损伤术及转染后 3 d,各组取 6只大鼠处死,取出左颈总动脉,以组织块贴壁法培养平滑肌细胞。
平滑肌细胞用细胞爬片进行 SMα-actin免疫组织化学鉴定。应用单克隆鼠抗人平滑肌细胞 α-actin抗体(DAKO公司)将培养的平滑肌细胞作 α-actin鉴定。该抗 SMα-actin抗体只与血管平滑肌细胞中 actin的 α异构体特异性结合,可以作为血管平滑肌细胞的鉴定。方法如下:制备细胞爬片以丙酮固定,PBS冲洗,山羊血清封闭后,加入抗平滑肌细胞α-actin抗体,4℃冰箱过夜后取出,PBS冲洗后加入二抗,再 PBS冲洗后 DAB显色,双蒸水冲洗,苏木素复染,盐酸乙醇分化,脱水,封片,显微镜下观察。细胞质如呈棕色为 SM-α-actin阳性表达,证实为平滑肌细胞。
1.3.4 转染后血管平滑肌细胞 HA-FOXO3a-TM表达检测(Western blotting检测) 由于血管平滑肌细胞中有内源性 FOXO3a存在,故采用 Western blotting检测分别检测三组 FOXO3a总蛋白表达以及检测 HA-FOXO3a-TM中所携带的标记蛋白 HA表达来证实转染后活性转录因子 HA-FOXO3a-TM的表达。取损伤术及转染后 3 d培养的平滑肌细胞,分别加入 100uL组织裂解液(Sigma)和 3μl蛋白酶抑制剂(PMSF)制成匀浆,提取蛋白并检测蛋白浓度。10%分离胶上样 10μl蛋白样品,80V电泳、继之400mA转膜 2 h,5%TBST封闭过夜;一抗(HA抗体,1:1000,FOXO3a抗体,1:1000)过夜,洗涤后加二抗(1:2000);曝光、显影。
1.3.5 病理学检测 三组大鼠分别于术后 1,3月各取 6只处死,取出损伤部位左颈总动脉约 1 cm。常规固定、包埋、切片、苏木精伊红染色,光镜下观察血管壁形态学改变;计算机图像分析系统(Image pro Plus 4.5图像分析软件)测定,分别测量血管内膜面积(I)和中膜面积(M),并计算内膜与中膜的面积比值(I/M),以此表示内膜增生程度。
1.4 统计学处理 所有数据均以均数 ±标准差表示,使用 SPSS11.0统计软件包进行处理,计量资料采用 t检验(成组设计两样本 t检验)。
2 结果
2.1 损伤后血管平滑肌细胞鉴定 光学显微镜下可以看到各组均呈长梭形的平滑肌细胞,免疫组织化学染色示 SMα-actin表达阳性,胞质内出现棕色阳性颗粒。
2.2 损伤后血管平滑肌细胞中 HA-FOXO3a-TM的表达 各组平滑肌细胞采用 Western blotting检测发现三组颈总动脉血管平滑肌细胞均有 FOXO3a表达,其中 FOXO3a-TM组表达 HA,空白对照组、质粒对照组不表达,表明 pECE-HA-FOXO3a-TM有效在体转染,损伤血管的平滑肌细胞有效表达 HAFOXO3a-TM。
2.3 血管壁形态学观测 空白对照组及质粒对照组损伤后 1个月、3个月时血管新生内膜均显著增厚,血管狭窄明显,而 FOXO3a-TM组的血管内膜新生程度明显受到抑制。各时间点 FOXO3a-TM组内膜/中膜面积比值较空白对照组及质粒对照组明显降低(P<0.05或 P<0.01);各时间点空白对照组及质粒对照组两者间 I/M值无统计学意义(P>0.05),见表 1。
表1 转染后各组不同时间血管内膜/中膜面积比值(±s)
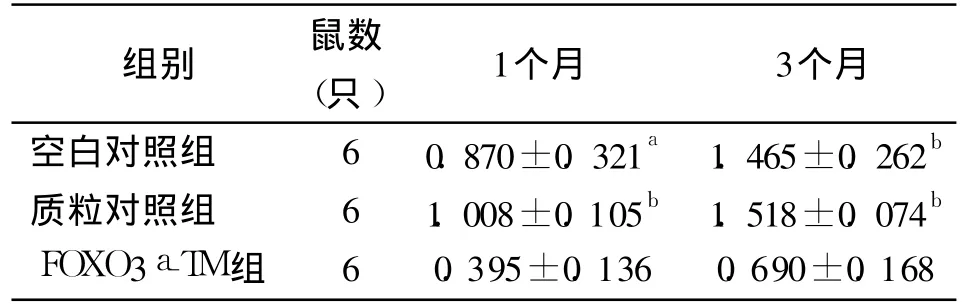
表1 转染后各组不同时间血管内膜/中膜面积比值(±s)
注:与 FOXO3a-TM组比较,a P<0.05,b P<0.01
组别 鼠数(只) 1个月 3个月空白对照组 6 0.870±0.321a 1.465±0.262b质粒对照组 6 1.008±0.105b 1.518±0.074b FOXO 3a-TM组 6 0.395±0.136 0.690±0.168
3 讨论
Fox蛋白家族,是脊椎动物叉头样转录因子的总称[3],由于其在生物体内所起的重要作用,已迅速成为国内外生命科学的研究热点。目前研究较多的 FKHRL1(FOXO3a)是 forkhead转录因子家族中的重要成员,主要通过转录调控在细胞的生长、分化、代谢、凋亡和免疫等方面起关键的作用。
较多研究证实 FOXO3a可参与细胞周期调控[6],使细胞周期停滞在 G1-S和 G2-M期“限制点”,从而抑制细胞生长,具有上游调控作用并且在分化晚期调控基因表达[7],显著抑制细胞的增殖,还可使细胞对凋亡刺激敏感性增强,具有诱导细胞凋亡的作用[8]。FOXO3a在多种细胞类型中表达,平滑肌细胞中也存在这一转录因子,其有抑制平滑肌细胞的增殖,促进凋亡的调控作用[9]。
有学者发现 Forkhead转录因子家族成员是PI3K/Akt信号途径下游最重要的转录因子[3]。在哺乳动物中,各种外界刺激以及生长、细胞因子的作用均可激活 PI3K,从而活化 Akt/PKB,而活化的 Akt能够磷酸化转录因子 FOXO3a,使其从细胞核中排除,易位到细胞浆中,从而降低转录激活靶基因的活性,从而促进细胞的生长和增殖[10]。还有报道[9],生长因子 PDGF-BB、TNF-α和 IGF-1能够分别通过MEK1/2和/或 PI3K依赖的信号通路诱导 VSMC中FOXO3a的磷酸化并导致其核排除/细胞质易位,抑制其靶基因的表达,促进 VSMC增殖、抑制凋亡。所以转录因子 FOXO3a在血管成形术后再狭窄过程中参与了血管壁病理生理相关的靶基因的调控,在信号传导通路中发挥决定性的作用。
本研究利用基因转染的方法使平滑肌细胞中FOXO3a转录因子表达增加和转录活性增强,实验中选用 FOXO3a的三倍突变体(FOXO3a-TM)基因,FOXO3a三倍突变体(FOXO3a-TM)基因序列由于其三个磷酸化位点 (Thr-32、Ser-253、Ser-315)均被丙氨酸残基所结合,由于这三个位点改变,使表达的FOXO3a在信号途径中不能再被磷酸化,阻止FOXO3a从细胞核易位到细胞浆中,从而发挥持续的转录活性。研究证明 FOXO3a磷酸化突变体(FOXO3a-TM)比野生型 FOXO3a(FOXO3a-WT)更具有持续活化的特点,其在信号通路中不能再被磷酸化和核排除,可在细胞核中过量表达,因此生物功能和转录活性增强。
同时实验中选用无抗原性且安全高效的脂质体为载体制备含饱和浓度的 pECE-HA-FOXO3a-TM转染液,通过局部血流保留灌注孵育法,将 pECE-HAFOXO3a-TM转染体内球囊损伤后的局部大鼠颈总动脉,然后在转染 3 d后,在体外培养并鉴定的血管损伤后的平滑肌细胞中,通过蛋白水平的检测,证实了 FOXO3a-TM基因在平滑肌细胞中有效转移和表达。而且在体内转染后 1个月和 3个月,FOXO3a-TM基因转染组血管新生内膜增厚程度均较两组对照组明显减弱,提示应用目的基因局部转染干预后,新生内膜的增生被有效抑制,能显著减少大鼠颈总动脉血管损伤后狭窄的程度。
[1] Mnjoyan ZH,Doan D,Brandon JL,et al.The critical role of the intrinsic VSMC p roliferation and death programs in injury-induced neointimal hyperp lasia[J].Am JPhysiol Heart Circ Physiol,2008,294(5):H 2276-2284.
[2] Salih DA,Brunet A.FoxO transcrip tion factors in themaintenance of cellular homeostasis during aging[J].Curr Opin Cell Biol,2008,20(2):126-136.
[3] Yang L,Xie S,Jamaluddin MS,et al.Induction of androgen receptor expression by phosphatidylinositol 3-kinase/Ak tdownstream substrate,FOXO 3a,and their roles in apoptosis of LNCaP prostate cancer cells[J].JBiol Chem,2005,280(39):33558-33565.
[4] Schwab TS,Madison BB,Grauman AR,et al.Insulin-like growth factor-I induces the phosphorylation and nuclear exclusion of forkhead transcription factors in human neuroblastoma cells[J].Apoptosis,2005,10(4):831-840.
[5] Li JM,Zhang X,Nelson PR,et al.Temporal evolution of gene exp ression in rat carotid artery following balloon angioplasty[J].JCell Biochem,2007,101(2):399-410.
[6] Furukawa-Hibi Y,Kobayashi Y,Chen C,et al.FOXO transcription factors in cell-cycle regulation and the response to oxidative stress[J].Antioxid Redox Signal,2005,7(5/6):752-760.
[7] Jacobs FM,van der Heide LP,Wijchers PJ,et al.FoxO6,a novelmember of the FoxO class of transcription factors with distinct shuttling dynamics[J].JBiol Chem,2003,278(38):35959-35967.
[8] Fu Z,Tindall DJ.FOXOs,cancer and regulation of apoptosis[J].Oncogene,2008,27(16):2312-2319.
[9] Abid MR,Yano K,Guo S,et al.Forkhead transcription factors inhibit vascular smooth muscle cell proliferation and neointimal hyperplasia[J].J Biol Chem,2005,280(33):29864-29873.
[10]Schwab TS,Madison BB,Grauman AR,et al.Insu lin-like grow th factor-I induces the phosphorylation and nuclear exclusion of forkhead transcription factors in human neurob lastoma cells[J].Apoptosis,2005,10(4):831-840.
