以Apo A-I为靶点的基因表达上调剂筛选模型的建立
2011-04-10杜郁王丽王丽非司书毅杨媛洪斌
杜郁,王丽,王丽非,司书毅,杨媛,洪斌
·论著·
以Apo A-I为靶点的基因表达上调剂筛选模型的建立
杜郁,王丽,王丽非,司书毅,杨媛,洪斌
目的建立靶向人 Apo A-I 转录调控序列的高通量药物筛选模型,用于筛选 Apo A-I 基因表达上调剂。
载脂蛋白 A-I; 转录启动子; 荧光素酶类; 药物评价,临床前
www.cmbp.net.cn 中国医药生物技术, 2011, 6(3):178-183
高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平降低是心血管疾病的独立风险因素,它和动脉粥样硬化疾病的发生存在明确的负相关关系[1]。研究发现,HDL-C 的水平每增加 1 mg/dl,心血管病发生的风险可降低 2% ~3%[2]。随着研究的深入,目前倾向认为高密度脂蛋白(HDL)的心血管保护作用很大程度上依赖于它所介导的胆固醇逆转运(reverse cholesterol transport,RCT)过程,即 HDL 将胆固醇从周围组织(包括粥样斑块)转运到肝脏以胆酸形式代谢[3]。因此,提高和改善 HDL 水平与功能,有可能成为动脉粥样硬化治疗的新途径。
载脂蛋白 A-I(apolipoprotein A-I,Apo A-I)是 HDL 的主要结构蛋白和功能单位,与 HDL 的形成密切相关。Apo A-I 在血浆中的浓度与 HDL-C的水平相关,可通过多种机制发挥抗动脉粥样硬化作用[4],有望成为动脉粥样硬化的治疗靶基因之一。通过对肝细胞中 Apo A-I 基因调控区缺失图谱和转基因鼠的研究发现,转录起点 –220 ~ –110 bp 的启动子区域存在几个重要的转录因子结合位点,包括 Site A(–214 ~ –192 bp)、Site B(–169 ~ –146 bp)和 Site C(–134 ~ –119 bp),对于维持肝细胞中 Apo A-I 的正常转录和表达是必需的[5]。本研究以上述Apo A-I 的启动子序列为靶点,利用报告基因体系,建立稳定转染细胞用于基因表达上调剂的高通量筛选。将 Apo A-I 基因上游的 –277 ~ +173 bp 片段克隆于荧光素酶报告基因的上游,得到受 Apo A-I 基因启动子调控的重组报告基因表达质粒,并获得了稳定转染 HepG2 细胞的单克隆细胞株,经筛选条件优化和评价,建立了针对人 Apo A-I 的基因表达上调剂药物筛选模型。
1 材料与方法
1.1 材料
1.1.1质粒、菌株和细胞株 真核细胞表达载体pGL4.17(luc2/Neo)和质粒载体 pGEM-T为美国Promega 公司产品;大肠杆菌 E. coli TG1 为本实验室保存;人肝癌细胞株 HepG2 为本实验室保存。
1.1.2工具酶和主要试剂 限制性内切酶、T4 DNA 连接酶等均购自大连宝生物工程公司;PfuDNA 聚合酶购自上海生工生物工程公司;DNA回收试剂盒购自北京全式金生物技术有限公司;中量质粒提取试剂盒(PureYield™ Plasmid Midiprep System)、细胞裂解液和荧光素酶检测系统(Luciferase Assay System)购自美国 Promega 公司;转染试剂(Lipofectamine™ 2000)购自美国 Invitrogen 公司;MEM 细胞培养基为美国 Thermo 公司产品;胎牛血清、丙酮酸钠、非必需氨基酸和 G418 抗生素为美国 Gibco 公司产品;二甲基亚砜(DMSO)购自美国 Sigma 公司。
1.1.3仪器 MiniCycle PTC-200 型 PCR 仪为美国 MJ Research 公司产品;EnVision 多功能微孔板检测仪为美国 PerkinElmer 公司产品。
1.2 方法
1.2.1DNA 目的片段的体外扩增、克隆及测序 从人肝癌细胞株 HepG2 中抽提获得基因组DNA,并以此为模板,根据 GenBank 上所收录的Apo A-I 基因序列(GeneID:335)和文献[5]报道的人 Apo A-I 基因转录调控元件所在位置,通过Primer Premier 5.0 设计 PCR 上游引物 5’ TACTC GAG AGTGCAGGGAACCCCGACC 3’(下划线表示 Xho I 酶切位点)和下游引物 5’ ATAAGCTT AT GCAGAAGCCCCGTGCTCC 3’(下划线表示Hind III 酶切位点),扩增位于 –277 ~ +173 bp 区域的人 Apo A-I 基因启动子序列。PCR 体系反应条件为 94 ℃ 变性 5 min;94 ℃ 变性 50 s,57 ℃ 退火 50 s,72 ℃ 延伸 60 s(30 个循环);72 ℃ 延伸 10 min。
将 PCR 扩增产物纯化回收,与 pGEM-T 载体连接,转化至 E. coli TG1 感受态宿主菌,用蓝白斑法挑选转化子。提取纯化质粒,酶切鉴定阳性克隆,将含有预期大小片段的重组质粒命名为pGEM-ApoP,测序鉴定插入片段的 DNA 序列。
1.2.2重组质粒的构建和鉴定 Xho I 和 Hind III酶切重组质粒 pGEM-ApoP 和 pGL4.17 质粒,将目的基因片段与双酶切后的线性 pGL4.17 质粒连接,从而将人 Apo A-I 基因上游启动子序列定向插入到 pGL4.17 载体的荧光素酶报告基因上游,构建完成重组质粒 pGL4-ApoP。重组质粒转化至 E. coli TG1 中增殖扩增,提取质粒并用 Xho I 和Hind III 进行双酶切鉴定。
1.2.3细胞培养 HepG2 细胞培养于含 10% 胎牛血清的 MEM 培养基中,添加 1 mmol/L 丙酮酸钠和 1% 非必需氨基酸,37 ℃、5% CO2条件下培养。0.25% 胰酶加 0.02% 乙二胺四乙酸(EDTA)消化传代。
1.2.4重组质粒瞬时转染与转染条件优化 转染用质粒的提取方法按 PureYield™ Plasmid Midiprep System 试剂盒说明书进行。转染前一天,于 30 mm培养皿接种 8 × 105个 HepG2 细胞,待细胞贴壁生长汇聚程度达到 80% 左右时,按 Lipofectamine™2000 说明书操作,将 pGL4-ApoP 经脂质体介导转染至 HepG2 细胞。24 h 后,得到瞬时转染细胞,并测定荧光素酶的表达活性。同时按照 DNA 和转染剂两者比例(μg/μl)为 1:1、1:2、1:2.5、1:3 和1:4考察转染效率。
1.2.5稳定转染细胞株的构建 将瞬时转染细胞以 5 × 103个细胞/孔接种于 96 孔板,置于 37 ℃、5% CO2培养箱内,以含 G418 700 μg/ml 的 MEM选择培养液筛选稳定转染细胞株,每 3 ~ 4 天换液一次。两周后,选择存活的细胞集落进行扩增培养,测定荧光素酶的表达活性,将活性较高的细胞集落通过有限稀释法,筛选获得稳定转染的单克隆细胞株,经多次传代培养后荧光素酶的表达活性无明显降低者可确定为稳定转染细胞株 ApoP-Luc HepG2。
1.2.6化合物筛选流程及模型评价 将稳定转染细胞用含 G418 700 μg/ml 的 MEM 选择培养液调节至 5 × 105个/ml,接种于 96 孔细胞培养板,每孔 100 μl,37 ℃、5% CO2培养 6 h 后,吸弃培养液上清,更换无血清 MEM 培养液,并加入待筛化合物或 DMSO 对照,孵育 20 h。吸弃细胞培养液上清,PBS 洗涤细胞 2 次,每孔加入 20 μl 细胞裂解液,37 ℃ 孵育 15 min 以充分裂解,加入Luciferase Assay System 中提供的荧光素酶检测液后,通过 EnVision 微孔板多功能检测仪读取荧光素酶活性数值。以荧光素酶的表达活性来考察化合物对 Apo A-I 基因表达的上调作用。荧光素酶活性的评价采用调节率来定义:调节率 =(样品组细胞荧光素酶活性/DMSO 组细胞荧光素酶活性)× 100%,本研究将化合物样品的调节率大于 150%定义为初筛阳性。
为评价所构建模型的有效性,将已知阳性化合物染料木素(Genistein)制成不同浓度作用于细胞模型,检测其对荧光素酶表达活性的影响。同时为评价此筛选模型对高通量筛选的可用性,对信号/背景比(S/B)、信号/噪音比(S/N)和变异系数(CV)进行检测,按 Zhang 等[6]的方法计算 Z’ 因子,公式如下所示:Z’= 1 -(3 × 阳性对照孔 SD + 3 ×空白对照孔SD)/(阳性对照孔平均值 - 空白对照孔平均值)。
1.2.7化合物筛选条件优化 化合物溶于 DMSO中,作用于稳定转染细胞的浓度为 10 μg/ml。为优化筛选条件,考察了溶剂 DMSO 浓度以及化合物作用时间对稳定转染细胞荧光素酶表达活性的影响。
2 结果
2.1 Apo A-I 基因启动子序列的获得
以人基因组 DNA 为模板,PCR 扩增得到人Apo A-I 基因启动子序列,扩增产物经琼脂糖凝胶电泳检测,显示获得预期大小的 DNA 片段(图 1A)。
将以上 PCR 扩增产物克隆至 pGEM-T 载体中,对重组质粒的插入片段进行序列测定,结果表明所插入片段均与 GenBank 中所登录的序列(登录号:NG_012021.1)一致,符合 Apo A-I 基因上游启动子序列的预期设计。
2.2 报告基因重组质粒的构建
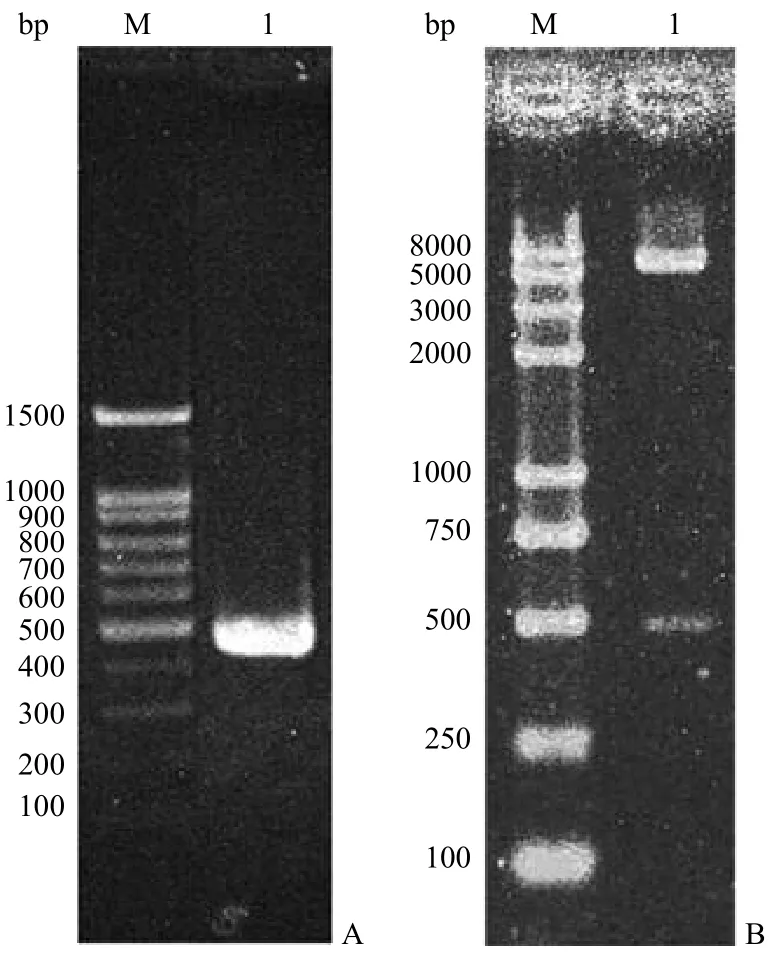
图1 ApoA-I 基因启动子序列的 PCR 扩增和 pGL4-ApoP酶切鉴定结果Figure 1 PCR product of human Apo A-I gene promoter and restriction enzymatic analysis of recombinant plasmid pGL4-ApoP
对构建的重组质粒 pGL4-ApoP 进行酶切鉴定,结果显示,Apo A-I 基因上游启动子序列以正确的方向插入到 pGL4.17 中荧光素酶报告基因的上游(图 1B)。
2.3 稳定转染细胞株的建立
扩增得到的 ApoA-I 基因上游启动子序列含有 –220 ~ –110 bp 区域的几个重要转录因子结合位点,对于在 HepG2 细胞中 Apo A-I 基因的正常表达非常关键。荧光素酶表达活性检测结果显示,相比未插入启动子序列的 pGL4.17 质粒,报告基因质粒 pGL4-ApoP 的荧光素酶表达活性明显增高。同时通过优化重组质粒 DNA 和转染试剂两者比例,确定当 DNA: Lipofectamine™ 2000 两者比例为 1:3 时,转染效率最高(图2,n = 3)。
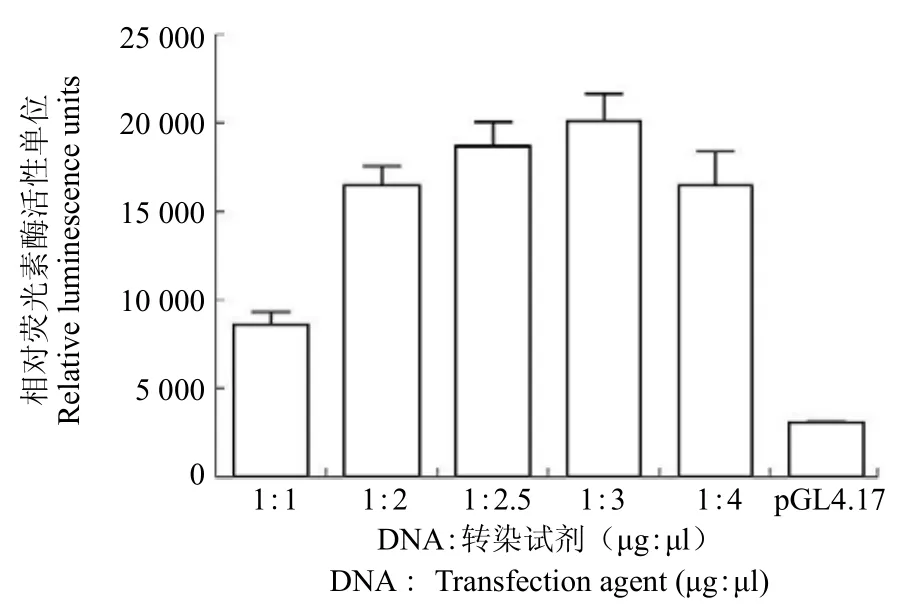
图2 转染试剂浓度对重组质粒荧光素酶活性表达的影响(空载体 pGL4.17 作为阴性对照)Figure 2 Effects of transfection agent concentrations on luciferase activity after the transiently transfection of recombinant reporter plasmid (promoterless pGL4.17 as a negative control)
2.4 筛选条件的优化
考察了 0.01% ~ 1% DMSO 对荧光素酶表达活性的影响,在 0.01% ~ 0.1% 的浓度范围内,DMSO 不会对 ApoP-Luc HepG2 稳定转染细胞株的荧光素酶活性表达产生明显影响(图 3A,n = 3)。故筛选时采用 DMSO 溶剂的终浓度为 0.1%。为确定化合物作用的合适时间,参阅文献[7]的报道,选择 16、18、20 和 24 h 检测细胞荧光素酶表达活性。结果表明,从 16 ~ 20 h,ApoP-Luc HepG2 稳定转染细胞株的荧光素酶活性存在缓慢上升趋势,20 h 后,表达趋于稳定。因此,确定化合物作用于稳定转染细胞的时间为 20 h(图 3B,n = 3)。
2.5 模型验证与评价
不同浓度的 Genistein 作用细胞模型20 h后,测定荧光素酶表达活性。结果显示,对于 ApoP-LucHepG2 稳定转染细胞,在一定浓度范围内,荧光素酶相对活性值随着 Genistein 浓度的增加而升高,呈浓度依赖性,EC50为 3.57 μmol/L(图4,n = 3)。本研究中 Genistein 对 Apo A-I 转录激活作用与文献[8]报道一致,说明 Genistein 能有效作用于已构建的 pGL4-ApoP 表达载体,其对 Apo A-I 基因的转录激活作用能通过荧光素酶活性得到反映,从而证明所构建的稳定转染细胞用于此类药物筛选的可行性。选取 Genistein 作为模型的阳性对照,对模型的可靠程度、敏感度、重现性和准确性加以衡量,评价了多项高通量筛选指标。结果表明,S/B、S/N、CV 和Z’因子分别为 5.12、30.1、6.1 和0.68,优于进行高通量筛选试验所要求的 > 3、> 10、< 10 和 ≥ 0.5的标准。说明本研究建立的模型稳定可靠,适合应用于高通量筛选。
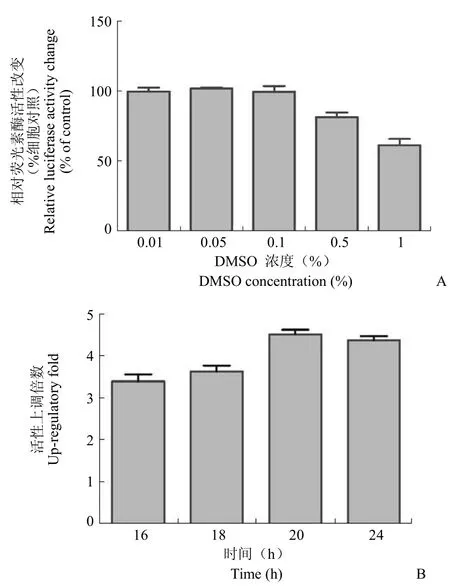
图3 模型筛选条件的优化结果Figure 3 Results of optimization on screening model
2.6 化合物初步筛选结果
应用该模型对本研究所的化合物库进行了筛选,通过检测荧光素酶活性,发现白藜芦醇和毛蕊异黄酮、芹菜素、高良姜素和千层纸素 A 等黄酮类化合物对 Apo A-I 转录活性上调作用明显,进一步采用不同浓度的上述化合物作用于 ApoP-Luc HepG2 稳定转染细胞,证明上述化合物的转录激活作用均呈现剂量依赖性,半数有效浓度分别为0.49、9.40、4.81、8.49 和 7.45 μg/ml(图5)。

图4 染料木素对稳定转染细胞模型的量效曲线Figure 4 Effects of Genistein on lucifearase activity in stable transfected cell model

图5 活性化合物对 ApoP-Luc HepG2 细胞荧光素酶活性影响(每浓度设 4 个复孔,结果以平均值表示)Figure 5 Effects of active compounds on luciferase activity in ApoP-Luc HepG2 cells (Each sample was quadruplicated and quantitative data are expressed as mean)
3 讨论
心血管疾病是全球范围造成死亡的首要原因,动脉粥样硬化(atherosclerosis,AS)以富含脂肪的斑块在大动脉壁聚积为主要特征,是心血管病的主要病理基础。20 世纪 80 年代以来,以他汀类为代表的药物(HMG-CoA 还原酶抑制剂)在治疗动脉粥样硬化领域取得了重大进展,主要通过减少低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平来干预血脂水平、减少心血管事件发生。尽管他汀类药物能减少约 30% 的冠状动脉事件[9],但每年仍有9% 的受治患者受到残余心血管病变风险的困扰[10]。因此,进一步降低动脉粥样硬化心血管疾病发生,有必要关注除 LDL-C 以外的相关血脂风险因素。
人 Apo A-I 蛋白主要在肝脏和小肠中表达,成熟的 Apo A-I 蛋白含有 243 个氨基酸。Apo A-I 是 HDL 颗粒中最主要的载脂蛋白,约占 HDL 中蛋白总含量的 70%,在 HDL 的形成、代谢和功能方面都具有重要作用。人 Apo A-I 基因缺失会导致血浆 HDL 水平低下和家族性低 α-脂蛋白血症,容易造成早发性动脉粥样硬化[11-12]。采用转基因动物和体细胞基因转移的手段证明过表达 Apo A-I 基因可以增加 HDL-C 水平,减缓动脉粥样硬化进程,并在一定程度上使斑块退化[13-14]。Apo A-Imilano是 Apo A-I 的天然突变体,其 173 位的精氨酸被半胱氨酸所取代,该基因突变的携带者罹患心血管疾病的风险很低,临床试验证明输注 Apo A-Imilano突变体和磷脂复合物,有助于动脉粥样斑块的消退,推测与增强泡沫化巨噬细胞胆固醇外排有关[15]。这些研究提示 Apo A-I 有可能是心血管疾病调脂治疗的一个重要靶点。
Apo A-I 的基因表达调控主要发生在转录水平,靠近 Apo A-I 基因转录起点的位置存在类似TATA 盒的结构;其 5’ 上游序列 –220 ~ –110 bp区含有若干转录因子结合位点,受到包括视黄醇类物质 X 受体(RXR),过氧化物酶体增殖物激活型受体 α(PPARα)和肝 X 受体(LXR)在内的核受体的调控;5’ 侧翼的高 GC 区域存在胰岛素应答核心元件(insulin response core element,IRCE),可同转录因子 Sp1 结合。这些转录因子单独或者相互协同作用,通过影响 Apo A-I 的基因表达来应答激素、代谢、饮食及药物的变化和刺激。本研究采用的人 Apo A-I 基因启动子序列,包括了转录起始位点和若干重要的转录因子结合位点,有望在分子机制方面进行深入的研究。
构建稳定转染细胞采用的是 HepG2 细胞,它保留了人类正常肝实质细胞的许多功能,含有与Apo A-I 基因表达相关的必要转录因子,能够比较真实地反映 Apo A-I 在肝脏中表达的环境,更有利于我们筛选得到作用明确的 Apo A-I 基因表达上调剂。
G418 抗性筛选和荧光素酶表达活性的检测结果显示,稳定转染的 HepG2 细胞中含有受 Apo A-I 上游启动子区调控的荧光素酶重组表达质粒,并能够稳定地随细胞培养传代,说明成功得到稳定转染有 Apo A-I 启动子序列的细胞株。我们选择文献报道的 Genistein 检测其对 Apo A-I 转录活性的影响,结果表明,Genistein 能提高稳定转染细胞中 Apo A-I 的转录活性。后续的筛选发现,除Genistein 之外,多个黄酮类化合物都能以剂量依赖的方式作用于 Apo A-I 调控区,可能与这些化合物具有植物雌激素作用,能结合雌激素受体相关。另外,白藜芦醇在本筛选模型上显示出较好的活性,根据文献报道,这类均二苯乙烯类衍生物能够上调Apo A-I的表达水平[16]。目前,研究人员发现一种名为 RVX-208 的白藜芦醇结构衍生物,能够在转录水平提高 Apo A-I 基因表达,已进入了临床 II期实验[17],正在进行药代动力学和安全性相关评价,有望治疗因 HDL-C 水平低下而引起的心血管疾病。
本研究利用报告基因的检测方法建立了适用于高通量筛选的人 Apo A-I 基因表达上调剂筛选模型,可以在细胞水平大规模筛选作用于 Apo A-I基因表达调控序列的小分子化合物。有关阳性化合物对 Apo A-I 基因表达的影响目前正在进一步研究中,有可能获得治疗动脉粥样硬化心血管疾病的新型先导化合物。
[1] Singh IM, Shishehbor MH, Ansell BJ. High-density lipoprotein as a therapeutic target: a systematic review. JAMA, 2007, 298(7):786-798.
[2] Chapman MJ, Assmann G, Fruchart JC, et al. Raising high-density lipoprotein cholesterol with reduction of cardiovascular risk: the role of nicotinic acid--a position paper developed by the European Consensus Panel on HDL-C. Curr Med Res Opin, 2004, 20(8): 1253-1268.
[3] Fredenrich A, Bayer P. Reverse cholesterol transport, high density lipoproteins and HDL cholesterol: recent data. Diabetes Metab, 2003, 29(3):201-205.
[4] Khuseyinova N, Koenig W. Apolipoprotein A-I and risk for cardiovascular diseases. Curr Atheroscler Rep, 2006, 8(5):365-373.
[5] Dullens SP, Plat J, Mensink RP. Increasing apoA-I production as a target for CHD risk reduction. Nutr Metab Cardiovasc Dis, 2007, 17(8):616-628.
[6] Zhang JH, Chung TD, Oldenburg KR. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. J Biomol Screen, 1999, 4(2):67-73.
[7] Yang Y, Zhang Z, Jiang W, et al. Identification of novel human high-density lipoprotein receptor Up-regulators using a cell-based high-throughput screening assay. J Biomol Screen, 2007, 2(2):211-219.
[8] Lamon-Fava S. Genistein activates apolipoprotein A-I gene expression in the human hepatoma cell line HepG2. J Nutr, 2000, 130(10):2489-2492.
[9] Brugts JJ, Yetgin T, Hoeks SE, et al. The benefits of statins in people without established cardiovascular disease but with cardiovascular risk factors: meta-analysis of randomised controlled trials. BMJ, 2009, 338:b2376.
[10] Hausenloy DJ, Yellon DM. Targeting residual cardiovascular risk: raising high-density lipoprotein cholesterol levels. Postgrad Med J, 2008, 84(997):590-598.
[11] Schaefer EJ, Heaton WH, Wetzel MG, et al. Plasma apolipoprotein A-1 absence associated with a marked reduction of high density lipoproteins and premature coronary artery disease. Arteriosclerosis, 1982, 2(1):16-26.
[12] Ng DS, Leiter LA, Vezina C, et al. Apolipoprotein A-I Q[-2]X causing isolated apolipoprotein A-I deficiency in a family with analphalipoproteinemia. J Clin Invest, 1994, 93(1):223-229.
[13] Plump AS, Scott CJ, Breslow JL. Human apolipoprotein A-I gene expression increases high density lipoprotein and suppresses atherosclerosis in the apolipoprotein E-deficient mouse. Proc Natl Acad Sci U S A, 1994, 91(20):9607-9611.
[14] Tangirala RK, Tsukamoto K, Chun SH, et al. Regression of atherosclerosis induced by liver-directed gene transfer of apolipoprotein A-i in mice. Circulation, 1999, 100(17):1816-1822.
[15] Alexander ET, Weibel GL, Joshi MR, et al. Macrophage reverse cholesterol transport in mice expressing ApoA-I Milano. Arterioscler Thromb Vasc Biol, 2009, 29(10):1496-1501.
[16] Hansen HC, Chiacchia FS, Patel R, et al. Stilbene analogs as inducers of apolipoprotein-I transcription. Eur J Med Chem, 2010, 45(5):2018-2023.
[17] Bailey D, Jahagirdar R, Gordon A. RVX-208: a small molecule that increases apolipoprotein A-I and high-density lipoprotein cholesterol in vitro and in vivo. J Am Coll Cardiol, 2010, 55(23):2580-2589.
MethodsHuman genomic DNA was used as a template to amplify the promoter sequence of Apo A-I using PCR. The fragment was cloned into pGEM-T vector and characterized by sequencing. The promoter fragment was then inserted upstream of luciferase reporter gene of pGL4.17, and then transfected into HepG2 cell line using LipofectamineTM2000. Stable transfectant was obtained using limited cell dilution method in the presence of G418. Samples were detected by measuring luciferase activity of stable transfected HepG2 cells in 96-well format after assay optimization and validation with genistein.
ResultsThe promoter sequence of Apo A-I containing essential transcriptional elements was obtained from human genomic DNA by PCR. The reporter plasmid named pGL4-ApoP was constructed by inserting the promoter sequence upstream of luciferase reporter gene of pGL4.17. The drug screening model was established and evaluated using genistein as a positive control. Z’-factor is above 0.5, showing that this model was robust and reliable. About 5000 compounds were screened and resveratrol and several flavonoids were identified as positive compounds.
ConclusionThis new drug screening model could be efficiently applied to screen up-regulators of human Apo A-I gene expression.【Key Words】Apolipoprotein A-I; Transcription initiation site; Luciferases; Drug evaluation, preclinical
Author Affiliations:Department of Bioengineering (DU Yu, WANG Li, WANG Li-fei, YANG Yuan, HONG Bin), National Laboratory for Screening New Microbial Drugs (SI Shu-yi), Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences, Beijing 100050, China
Establishment of a high-throughput screening model for identifying up-regulator of human Apo A-I expression
DU Yu, WANG Li, WANG Li-fei, SI Shu-yi, YANG Yuan, HONG Bin
ObjectiveTo establish a high-throughput screening model based on transcriptional regulation of human apolipoprotein A-I for identifying up-regulator of Apo A-I gene expression.
s:HONG Bin, Email: binhong69@hotmail.com; YANG Yuan, Email: yangyuan78@hotmail.com
10.3969/cmba.j.issn.1673-713X.2011.03.003
国家自然科学基金(30801401);“重大新药创制”科技重大专项“十一五”计划(2009ZX09302-004)
100050 北京,中国医学科学院医药生物技术研究所卫生部抗生素生物工程重点实验室(杜郁、王丽、王丽非、杨媛、洪斌),国家新药(微生物)筛选实验室(司书毅)
洪斌,Email:binhong69@hotmail.com;杨媛,Email:yangyuan78@hotmail.com
2011-03-16
方法以人基因组 DNA 为模板,PCR 扩增 Apo A-I 上游的启动子序列,克隆至荧光素酶报告基因质粒 pGL4.17 上游,采用脂质体介导的方法将重组质粒转染人肝癌细胞HepG2,在 G418 抗性存在的条件下,通过有限稀释法筛选稳定转染细胞株。对溶剂浓度和药物作用时间进行条件优化,应用阳性化合物染料木素评价模型有效性,通过检测荧光素酶的表达活性变化来筛选人 Apo A-I 基因表达上调剂。
结果通过 PCR 成功扩增了人 Apo A-I 基因上游的启动子序列,构建了相应的重组荧光素酶报告基因质粒 pGL4-ApoP,并建立稳定转染细胞株 ApoP-Luc HepG2。对筛选条件优化后,应用阳性化合物进行评价,筛选窗相关系数 Z’因子为 0.68,大于 0.5,适于进行高通量筛选。应用该筛选模型对 5000 余种化合物进行筛选,4 个黄酮类化合物和白藜芦醇显示出较好的活性,半数有效浓度均小于 10 μg/ml。
结论成功建立了人 Apo A-I 基因表达上调剂筛选模型,并利用该模型筛选到 5 个活性化合物。
www.cmbp.net.cn Chin Med Biotechnol, 2011, 6(3):178-183
