软骨形态发生蛋白1诱导犬真皮成纤维细胞向软骨细胞表型分化的实验研究
2011-03-27赵贵庆崔磊曹谊林
赵贵庆 崔磊 曹谊林
软骨形态发生蛋白1诱导犬真皮成纤维细胞向软骨细胞表型分化的实验研究
赵贵庆 崔磊 曹谊林
目的探讨软骨形态发生蛋白1(Cartilage-derived morphogenetic protein-1,CDMP1)诱导体外培养的犬真皮成纤维细胞(Dermal fibroblasts,DFs)向软骨细胞表型分化的可行性。方法应用CDMP1细胞诱导液对体外扩增至第4代的犬DFs进行诱导培养,观察细胞的形态变化,以免疫荧光染色和RT-PCR检测细胞中软骨特异蛋白的表达情况。结果诱导培养6 d后,实验组部分DFs呈星形或多角形,免疫组化染色显示有软骨特异的II型胶原分泌,RT-PCR检测也表明有Ⅱ型胶原、aggrecan和SOX9表达。但是诱导培养10 d后,均转为阴性。结论CDMP1可以诱导犬DFs向软骨细胞表型分化,有可能成为组织工程化纤维软骨的种子细胞。
真皮成纤维细胞纤维软骨细胞软骨形态发生蛋白-1组织工程
纤维软骨主要分布于半月板、颞下颌关节盘、椎间盘等关节内,细胞外基质中含有大量的Ⅰ型胶原和少量的Ⅱ型胶原以及粘多糖。由于纤维软骨中没有血运,再生能力差,所以纤维软骨的损伤往往引起重要的功能障碍,如颞下颌关节盘损伤引起的颞下颌关节功能紊乱等,严重影响了患者的生活质量。组织工程的发展为纤维软骨的修复提供了新的途径。
真皮成纤维细胞(Dermal fibroblasts,DFs)是真皮组织中合成细胞外基质的主要细胞,也是人体中分布最为广泛、数量最多、最易于获取和体外培养的细胞。我们的早期研究发现,软骨形态发生蛋白1(Cartilage-derived morphogenetic protein-1,CDMP1)可以诱导人DFs向软骨细胞表型分化[1-3]。本研究将深入探索DFs作为纤维软骨种子细胞的可能性。
1 对象与方法
1.1 细胞来源
犬皮肤成纤维细胞来自成年健康Beagle犬(购自上海农学院)腹部皮肤真皮组织。
1.2 试剂及仪器
1.2.1 主要试剂及来源
CDMP1(PeproTech公司,美国),DMEM培养基、F12培养基(Gibco,美国),胎牛血清(FBS)(Hyclone,美国),绵羊血清(BSA)(上海华美生物工程公司),RT-PCR引物(上海生工生物工程技术服务有限公司),vimentin多克隆抗体(Santa Cruz公司),Fibronectin单克隆抗体(Aachen公司,德国),鼠抗人CollagenⅠ(Cambridge公司,英国),鼠抗人CollagenⅡAb3(Neomarkers公司,美国),AMV逆转录酶XL(大连宝生物工程有限公司)。
1.2.2 主要仪器及型号
CO2培养箱(Forma公司,美国),无菌超净工作台(上海博讯实验有限公司),恒温摇床(太仓华美生化仪器厂),普通台式离心机(TDL-40B,上海安亭医疗仪器厂),光学显微镜、倒置相差显微镜(Nikon公司,日本),精密电子天平(Sartorius公司,德国),60 mm、100 mm培养皿和50 mL离心管(Falcon公司,美国),0.22 μm针孔过滤器(Millipore公司,美国)。
1.3CDMP1诱导培养DFs及DFs分化检测
1.3.1 细胞获取
无菌条件下切取犬下腹部皮肤2 cm×2 cm,分离、提纯DFs,体外扩增培养至第4代,备用。
1.3.2 细胞鉴定
应用兔抗人vimentin多抗克隆抗体和鼠抗人Fibronectin单克隆抗体对体外扩增培养第4代的犬DFs进行免疫荧光染色,荧光显微镜观察确定分离细胞的类型。
1.3.3 诱导培养
取第4代近融合的DFs,按4×105个/皿的细胞密度接种于100 mm培养皿,实验组加入7 mL含100 ng/mL的CDMP1、含10%FBS的DMEM/F12培养液(软骨诱导液),对照组中加入等量含10%FBS的DMEM/F12培养液(基础培养液),37℃、5%CO2环境中培养,每3天换液1次,观察细胞形态的变化。
1.3.4 免疫荧光染色
分别消化收集单层CDMP1诱导和非诱导培养6 d的DFs,制备细胞爬片,进行Ⅰ型和Ⅱ型胶原的免疫荧光染色。以原代培养的透明软骨细胞作为Ⅱ型胶原的阳性对照和Ⅰ型胶原的阴性对照,以原代培养的半月板纤维软骨细胞为Ⅰ型胶原的阳性对照。检测细胞分泌软骨主要细胞外基质的能力。
1.3.5 逆转录聚合酶链反应(RT-PCR)
以从新鲜犬半月板中提取的RNA为阳性对照,成软骨诱导6 d的DFs为实验组,未诱导的DFs为对照组,检测Ⅰ型胶原Ⅰα1,Ⅱ型胶原Ⅱα1以及aggrecan和SOX9基因的表达,以GAPDH为内参照,引物序列如表1所示。

表1 逆转录聚合酶链反应(RT-PCR)中应用的引物Table 1Nucleotide primers used for RT-PCR
2 结果
2.1Vimentin和Fibronectin免疫荧光染色
扩增至第4代的真皮成纤维细胞形态均一,表现出典型的长梭形,细胞突起较长,互相连接,细胞在培养皿中黏附良好,具有较强的活力。第4代真皮成纤维细胞Vimentin和Fibronectin免疫荧光染色阳性,在胞质中具有较强表达(图1),证明自犬皮肤中获取的成纤维细胞具有间充质来源特性。
2.2CDMP-1诱导单层培养的DFs向软骨细胞分化
第4代的DFs接种后以含有100 ng/mL的CDMP1诱导培养,以不含有CDMP1的为对照组。1 d后实验组(图2A)和对照组(图2D)无明显差异,细胞均为长梭形;6 d后,实验组(图2B)和对照组(图2E)有明显的不同,对照组仍是成纤维细胞典型的长梭形,而实验组中有一部分细胞呈椭圆形或星形,其余细胞呈长梭形;在培养10 d后,实验组和对照组细胞均呈长梭形,指纹状排列,两组间没有差异。
2.3 细胞免疫荧光染色
Ⅱ型胶原是软骨细胞特异的细胞外基质,真皮组织中不含有Ⅱ型胶原。CDMP1诱导6 d后,Ⅱ型胶原免疫荧光染色显示,部分细胞呈阳性;非诱导组细胞未见有阳性结果。Ⅰ型胶原在诱导组和非诱导组中均呈强阳性表达,即DFs在表达Ⅱ型胶原的同时,保留了Ⅰ型胶原的表达(图3)。
2.4RT-PCR
CDMP1诱导的DFs单层培养6 d后,RT-PCR检测表明,诱导组和阳性对照组中Col 2和SOX9表达阳性,而对照组中未见有表达;aggrecan在实验组和对照组中均有表达,但是实验组和阳性对照组的条带亮度明显较对照组强;而ColⅠα1在各组中均为高表达,无明显差异(图4)。
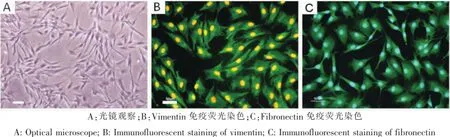
图1 第4代犬DFs(400×)Fig.1The 4thpassage of DFs(400×)

图2 CDMP1诱导单层培养的DFs(400×)Fig.2The morphology of canine DFs treated with CDMP1(400×)

图3 6d后,Ⅰ型胶原和Ⅱ型胶原免疫荧光染色检测(荧光显微镜,400×)Fig.3After 6 days,confirmed by ColⅠandⅡimmunofluorescent staining(Fluorescence microscope,400×)
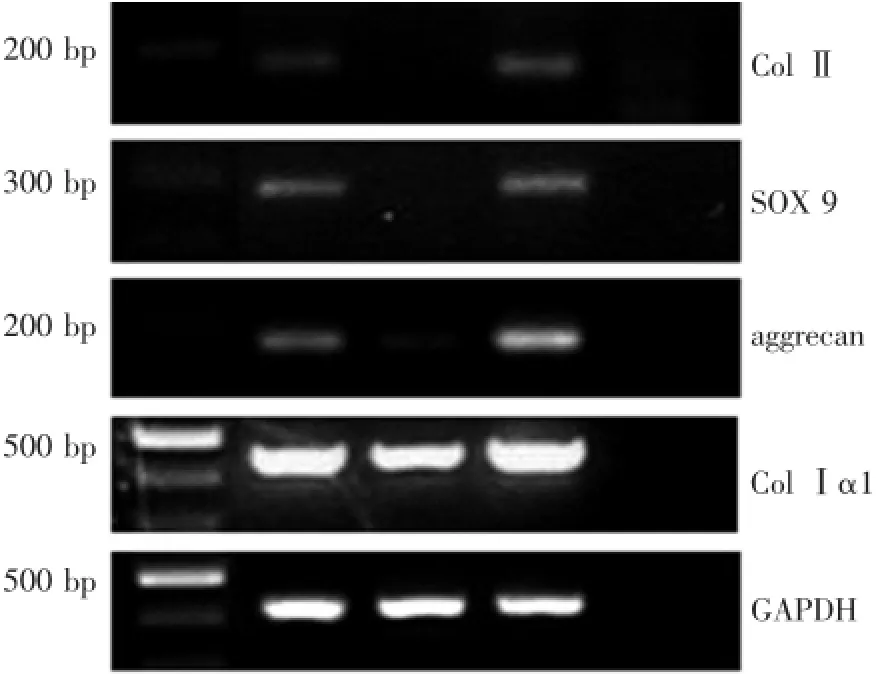
图4 RT-PCR检测Fig.4RT-PCR detection
3 讨论
CDMPs是BMP家族的成员,CDMP1又称为BMP14、GDF5,是与软骨形态发生和发育相关的最为特异的一类生长因子,CDMP1在出生后可继续维持其生物学特性,并促进软骨组织的损伤修复过程[4]。CDMP1主要通过调节间充质前体细胞的分化,参与软骨组织发生、发育与损伤修复的全部的生物学过程,是调节软骨细胞分化的重要生长因子[5]。研究发现,CDMP1可以诱导三维培养的骨髓来源间充质细胞向软骨细胞表型分化[6];CMDP1可以在体外诱导韧带来源的成纤维细胞向软骨细胞的表型分化,并且没有碱性磷酸酶活性的上调[7]。我们的早期研究发现,CDMP1可以诱导体外单层培养的人真皮成纤维细胞表达软骨特异的Ⅱ型胶原和aggrecan[5]。
真皮成纤维细胞是分化完全的终末体细胞,通常认为其不再具备如干细胞那样向其他类型细胞分化的能力。但是,近年来的研究发现,真皮中含有一些具有干细胞特性的亚细胞类型,在一定的条件下可以向软骨细胞、骨细胞和脂肪细胞表分化[8]。我们的早期研究证明,DFs可以在体外构建组织工程肌腱和角膜[9]。DFs获取简单,可在短时间内扩增至所需的细胞数量,传代过程中不会去分化。所以,真皮中的成纤维细胞可能是一个潜在的组织工程化种子细胞库。已有文献报道多种方法可以诱导DFs向软骨细胞系分化,如SOX5、6和9因子联合转染[10]、在aggrecan或perlecan涂层的二维表面上培养[11]以及与脱钙骨粉的共培养[12]等。
本研究以成年Beagle犬为研究对象,分离培养皮肤中的成纤维细胞,在单层培养条件下,细胞具有成纤维细胞典型的长梭形特征。体外传代至第4代后,细胞形态均一,具有较强的增殖能力;免疫荧光检测发现,细胞中Vimentin和Fibronectin呈阳性表达,这说明我们分离培养的细胞具有间充质来源细胞的特性。
我们应用含有100 ng/mL CDMP1的诱导液培养单层条件下的DFs,发现6 d后诱导组细胞形态与非诱导组有明显的区别,非诱导组中细胞呈典型的成纤维细胞状外观,而诱导组中一部分细胞呈椭圆形或多角形,类似于原代培养的透明软骨细胞。在第10天时,由于细胞增殖,培养皿中细胞密度增大,诱导组和非诱导组细胞均表现为成纤维细胞样长梭形特征,两组之间没有差别。对体外诱导培养第6天的细胞进行细胞爬片,免疫荧光染色发现,诱导组中部分细胞Ⅱ型胶原染色阳性,而对照组中未见有阳性细胞。Ⅰ型胶原染色发现,不论诱导组还是非诱导组都表现为强阳性。诱导培养第10天时,两组中Ⅱ型胶原染色均为阴性,Ⅰ型胶原染色均为阳性。对体外诱导第6天和第10天的细胞进行RT-PCR检测,也进一步证实了上述结果。值得注意的是,RTPCR显示,在培养第6天时,诱导组中SOX9和aggrecan表达阳性,而在非诱导组中仅有aggrecan的微量表达。SOX9是软骨细胞的一个重要的转录因子,它是属于HMG box(High mobility group)家族中的SRY(Sex determining region Y)亚家族。有研究发现,在胚胎发育过程中,SOX9与Ⅱ型胶原的表达具有平行关系[2]。这说明,CDMP1可以在单层培养条件下诱导犬DFs表达软骨特异的Ⅱ型胶原和aggrecan,使DFs向软骨细胞表型分化,但是诱导10 d后,细胞的外形又恢复为长梭形结构,Ⅰ型胶原免疫荧光染色阴性,且Ⅱ型胶原及SOX9的表达均转阴。可见,CDMP1不能在单层培养条件下维持DFs分化的软骨细胞表型。我们早期的研究发现,CDMP1诱导微团培养的人DFs在2周后有大量细胞表现出软骨陷窝结构,细胞外基质中有大量的黏多糖沉积[5],提示三维环境可能更有利于细胞表型的维持。
总之,本研究表明,犬皮肤成纤维细胞在体外单层培养条件下具有较强的增殖能力,能够满足组织工程对种子细胞增殖能力的要求;CDMP1可以诱导单层培养的犬DFs向软骨细胞分化,但是不能长期维持这种分化状态。在后续的研究中,我们将对CDMP1诱导三维培养的DFs向软骨细胞分化的能力进行更为深入地研究。
[1]崔磊,尹烁,邓辰亮,等.软骨形态发生蛋白1诱导真皮成纤维细胞向软骨细胞表型分化的影响因素[J].中华医学杂志.2005;85 (33):2331-37.
[2]尹烁,崔磊,李纲,等.CDMP1诱导成纤维细胞向成软骨细胞表型分化的实验研究[J].上海第二医科大学学报.2004;24(6):254-57. [3]崔磊,尹烁,邓辰亮.软骨形态发生蛋白1诱导真皮成纤维细胞表达软骨细胞表型的实验研究[J].中华医学杂志.2004;84(15): 1304-1309.
[4]Mizunoand S,Glowadcki J.Chondroinduction of human dermal fibroblasts by demineralized bone in three-dimensional culture [J].Exp Cell Res,1996,227(1):89-97.
[5]Peretti GM,Gill TJ,Xu JW,et al.Cell-Based therapy for meniscal repair:a Large animal study[J].Am J Sports Med,200432(1):146-158.
[6]Yates KE,Mizuno S,Glowacki J.Early shifts in gene expression during chondroinduction of human dermal fibroblasts[J].Exp Cell Res,2001;265(2),203-211.
[7]Yoo JU,Barthel TS,Nishimura K,et al.The chondrogenic potential 63(7):755-760.
[3]Murray JC.Keloids and hypertrophic scars[J].Clin Dermatol,1994, 12(1):27-37.
[4]Tredget EE,Nedelec B,Scott PG,et al.Hypertrophic scars,keloids, and contractures:the cellular and molecular basis for therapy[J]. Surg Clin North Am,1997,77(3):701-730.
[5]Cone RD,Lu D,Koppula S,et al.The melanocortin receptors: agonists,antagonists,and the hormonal control pigmentation[J]. Recent Prog Horm Res,1996,51:287-317.
[6]Koonin AJ.The aetiology of keloids:a review of the literature and a new hypothesis.S Afr Med J,1964,38:913-916.
[7]郑健生,邢新,张敬德.α-促黑素细胞激素及其对成纤维细胞的生物学作用[J].中国临床康复,2002,6(22):3414-3415.
[8]肖调立,龙剑虹,黄晓元.α-促黑素细胞激素和白细胞介素8在病理性瘢痕组织中的表达及意义[J].中国组织工程研究与临床康复,2007,119(36):7215-7218.
[9]Kiss M,Wlaschek M,Brenneisen P,et al.Alpha-melanocyte stimulating hormone induces collagenase/matrix metalloproteinase-1 in human dermal fibroblasts[J].Biol Chem Hoppe Seyler,1995, 376(7):425-430.
[10]Bohm M,Raghunath M,Sunderkotter C,et al.Collagen metabolism is a novel target of the neuropeptide alpha-melanocyte-stimulating hormone[J].J Biol Chem,2004,279(8):6959-6966.
[11]Bohm M,Luger TA.Melanocortins in fibroblast biology--current update and future perspective for dermatology[J].Exp Dermatol, 2004,13(4):16-21.
[12]Butler PD,Longaker MT,Yang GP.Current progress in keloid research and treatment[J].J Am Coll Surg,2008,206(4):731-741.of human bone-marrow-derived mesenchymal progenitor cells[J]. J Bone Joint Surg Am,1998;80(12):1745-1757.
[8]Hoben GM,Koay EJ,Athanasiou KA.Fibrochondrogenesis in two embryonic stem cell lines:effects of differentiation timelines[J]. Stem Cells,2008,26(2):422-430.
[9]Vanderploeg EJ,Imler SM,Brodkin KR,et al.Oscillatory tension differentially modulates matrix metabolism and cytoskeletal organization in chondrocytes and fibrochondrocytes[J].J Biomech, 2004;37(12):1941-1952.
[10]Izuta Y,Ochi M,Adachi N,et al.Meniscal repair using bone marrow derived mesenchymal stem cells experimental study using green fluorescent protein transgenic rats[J].Knee,2005,12(3):217-223.
[11]Chang HY,Chi J-T,Dudoit S,et al.Diversity,topographic differentiation,and positional memory in human fibroblasts[J]. Proc Natl Acad Sci U S A,2002,99(20):12877-12882.
[12]Ikeda T,Kamekura S,Mabuchi A,et al.The combination of SOX5, SOX6,and SOX9(the SOX trio)provides signals sufficient for induction of permanent cartilage[J].Arthritis Rheum,2004,50(11): 3561-3573.
(收稿日期:2011年4月3日,修回日期:2011年4月27日)
Study of CDMP1 Inducing DFs into Chondrogenic Lineage in Vitro
ObjectiveTo explore the feasibility of cartilage-derived morphogenetic protein-1(CDMP1)inducing dermal fibroblasts(DFs)into chondrogenic lineage.MethodsThe fourth passage of DFs isolated from canine were induced by CDMP1.The morphological changes were observed and the expression of cartilage specific proteins were detected by immunofluorescent staining and RT-PCR.ResultsAfter inducing 6 days,stellar-like or polygonal-like cells were observed, and cartilage specific collagen typeⅡwas detected by immunofluorescent staining as well as RT-PCR examination.Other cartilage specific proteins as aggrecan and SOX9 were detected by RT-PCR.But these effects could not be maintained after inducing 6 days.ConclusionCDMP1 could induce DFs into chondrogenic lineage,and CDMP1 induced DFs is promising to be the seed cell of engineered fibrochondrocytes.
Dermal fibroblasts;Fibrochondrocytes;Cartilage-derived morphogenetic protein-1;Tissue engineering
Q813.1+1
A
1673-0364(2011)03-0139-05
ZHAO Guiqing1,CUI Lei2,CAO Yilin2.
1 Yahan Medical Aesthetic Hospital,Changsha 410007,China.2 Department of Plastic and Reconstructive Surgery,Shanghai Ninth People′s Hospital,Shanghai Jiaotong University School of Medicine,Shanghai Key Laboratory of Tissue Engineering, Shanghai 200011,China.
2011年3月12日,
2011年5月4日)
10.3969/j.issn.1673-0364.2011.03.005
410000湖南省长沙市长沙亚韩医学美容医院(赵贵庆);200011上海市上海交通大学医学院附属第九人民医院整复外科,上海市组织工程研究重点实验室(崔磊,曹谊林)。
