褶纹冠蚌脏神经节Glu、GABA、DA、Ach和5-HT能神经元的分布
2011-03-14孙妍妍李葆明雷光春吴小平
肖 昱,唐 勤,孙妍妍,刘 玥,李葆明,,雷光春,吴小平,
(1.南昌大学 生命科学研究院,江西 南昌,330031; 2.复旦大学 神经生物学研究所,上海200032; 3.北京林业大学 自然保护区学院,北京 100083)
谷氨酸、γ-氨基丁酸、多巴胺、乙酰胆碱和 5-羟色胺作为哺乳动物中枢神经系统中的重要神经递质,在学习、记忆和认知等行为过程中起重要作用。软体动物尽管没有发达的中枢神经系统,但许多研究表明,它们的神经系统中存在大量Glu、GABA、DA、Ach和 5-HT能神经元,并具有重要功能[1-4]。文献报道,Glu在枪乌贼的神经细胞间信号传递中起着重要作用[5]; GABA 在软体动物神经系统起兴奋和抑制双重作用[3,6]; Ach是软体动物运动神经元重要的神经递质,对双壳类动物纤毛运动同时具有兴奋和抑制作用[7]; 5-HT广泛分布于软体动物,如无齿蚌(Anodonta piscinalis)、褐云玛瑙螺(Achatina fulica)、紫贻贝(Mytilus edulis)、地中海贻贝(Mytilus galloprovicialis)神经系统和其他组织[8-10],可能与感觉信息传递有密切关系[11]。
褶纹冠蚌(Cristaria plicata(Leach))隶属瓣鳃纲(Lamellibranchia)、真瓣鳃目(Eulamellibranchiata)、蚌科(Unionidae),是中国重要的淡水经济蚌种之一。关于淡水蚌类神经系统的神经元类型及分布,迄今知之甚少。本实验目的是阐明淡水蚌神经系统Glu、GABA、DA、Ach和5-HT能神经元的分布及形态学特征,尤其是阐明它们是否存在于同一神经元内,以期为淡水贝类的行为学和保护等方面研究等方面提供基础。
1 材料与方法
1.1 药品
小鼠抗谷氨酸单克隆抗体(ab78944,Abcam公司)、小鼠抗谷氨酸脱羧酶(GAD67)单克隆抗体(ab26116,Abcam公司)、小鼠抗酪氨酸羟化酶单克隆抗体(T1299,Sigma公司)、小鼠抗胆碱乙酰转移酶单克隆抗体(ab78023,Abcam公司)、小鼠抗色氨酸羟化酶单克隆抗体(T0678,Sigma公司)、生物素化羊抗小鼠 IgG (Jackson公司)、辣根过氧化物酶标记链霉卵白素(Jackson公司)、DAB试 剂盒(中山金桥公司)。
1.2 实验材料
褶纹冠蚌购买于上海市徐汇区万有全集团新鲜市菜场,选取健壮无损伤的鲜活个体。
1.3 H.E.染色
分离脏神经节,迅速放入现配预冷的4%多聚甲醛(0.1 mol/L PB)固定液中,4℃固定6~8 h。取出神经节,依次放入10%、20%、30%的 PB-蔗糖溶液中梯度脱水(4℃),直至标本沉至容器底部。O.C.T包埋,于冰冻滑动切片机(Leica,Germany; -25℃)冠状连续切片,片厚为10 μm。将切片贴于涂有铬矾明胶的载玻片上。风干后,用苏木素-伊红(H.E.)染色法染色,梯度酒精脱水,二甲苯透明,中性树胶封片,OLYMPUS BX41系统显微镜下观察并拍照记录结果。
1.4 免疫组织化学
采用 SP免疫组织化学法:-25℃冠状连续切片,片厚为40 μm。将切片放入0.01 mol/L PBS(磷酸缓冲液)中充分漂洗后,置入 0.3% H2O2室温处理 4~5 min(抑制内源性过氧化物酶),PBS漂洗 3×10 min;加入 0.5%Triton X-100(PBST(PBS,0.5% Triton X-100)),室温摇床反应 30 min; 弃去 Triton,加入10%正常羊血清室温孵育30 min(抑制非特异性吸附);弃去血清,滴加 1∶500稀释的一抗,4℃孵育 72 h,PBS漂洗3×10 min; 滴加1∶500稀释的二抗(生物素化羊抗小鼠IgG),室温孵育2 h,PBS漂洗3×10 min;滴加1∶500稀释的辣根过氧化物酶标记的链霉卵白素,室温反应 1 h,PBS漂洗 3×10 min; 滴加DAB-H2O2成色反应,室温约 2~3 min至变色适度,放入 0.1 mol/L Tris-HCl终止成色反应; 0.1 mol/L PBS中将切片贴于涂有铬矾明胶的载玻片上,风干;苏木素复染2 min,自来水蓝化10 min,蒸馏水漂洗10 s,梯度酒精脱水,二甲苯透明,中性树胶封片,镜检并拍照记录结果。实验中,以10%正常羊血清与0.2% Triton X-100等比例混合成的抗体稀释液代替一抗作为空白对照,结果为阴性。
2 实验结果
2.1 形态学观察
脏神经节是褶纹冠蚌中枢神经系统最大的神经节,2个对称的脏神经节愈合成1对蝴蝶状结构,紧贴于后闭壳肌前缘腹侧表面,表面呈淡黄色。其背侧面平滑,腹侧面膨胀突起且表面光滑。前侧逐渐变细成为脑脏神经连索,与脑神经节相连; 后端也逐渐变细成为 1对粗大的外套神经,延伸到身体后端外套膜; 前腹侧方两侧 1对弓状突起,弯向背侧延伸至鳃腔中成为鳃神经。
应用 H.E染色法,作者标记出脏神经节由神经节被膜、胞体区和中央纤维网区 3部分组成。胞体区神经元分层不明显,神经细胞属单极型,多呈梨形或卵圆形,少数为不规则形。根据胞体直径大小明显分为小型(5~15 μm)、中型(15~35 μm)和大型(35~50 μm)细胞3种类型。细胞核多为圆形或椭圆形,多居于胞质中央,大小为 6~15 μm。不同大小的神经元胞体散乱分布在神经节表面,有时会大量聚集成簇分布。在中央神经纤维网区有少量神经胞体成簇分布,它们大部分为中、小型细胞。胞体发出的突起均进入中央神经纤维网,中央神经纤维网内的神经纤维呈散乱絮状分布(图1-1,图1-2)。
2.2 自发荧光现象
应用 OLYMPUS BX-URA2荧光显微镜,在450~480 nm和510~550 nm两种激发光滤光片带处,观察经多聚甲醛固定过的脏神经节冰冻切片。结果显示:多数神经元胞体能自发红色和绿色荧光,其中红色荧光强于绿色荧光。这些自发荧光的胞体遍及神经节的整个胞体区,且呈不规则排列。中央神经纤维网靠近脑-脏神经连索区域和鳃神经区域亦存在大量具有自发荧光的纤维神经,呈念珠状或少量静脉曲张状放射分布(图2-1,图2-2,图2-3,图2-4,)。在 100×油镜下,可观察到在神经元胞体内部和中央神经纤维网区有大量红色和绿色荧光色素颗粒,这些颗粒围绕细胞核周围分布(图2-5)。
2.3 免疫组化结果
为了鉴定和定位Glu、GABA、DA、Ach和5-HT神经元,作者选用抗 Glu、GAD67(GABA合成限速酶)、TH(DA合成限速酶)、ChAT(Ach合成限速酶)和 TPH(5-HT合成限速酶)抗体,进行免疫组织化学实验。
2.3.1 Glu免疫阳性神经元
脏神经节的整个胞体区都存在 Glu能神经元。在胞体层较厚的区域,有大量小型细胞呈强 Glu免疫阳性反应,少量中型细胞呈弱 Glu免疫阳性反应,且两种细胞呈不规则散乱分布。在胞体层较薄的区域,可见少量大型Glu免疫阳性细胞。中央纤维网有零星的阳性反应神经末梢存在(图3-1,图3-2)。
2.3.2 GAD67免疫阳性神经元
脏神经节的外侧胞体区可见大量呈阳性反应的小型细胞,少数中型细胞呈弱阳性。这些阳性细胞多为单级神经元,其轴突进入神经节中央纤维网。中央纤维网区中可见丰富的GAD67强阳性反应的神经纤维,呈不规则絮状排列,并有少量阳性神经纤维呈静脉曲张状突起(图3-3,3-4)。

图1 褶纹冠蚌脏神经节的组织切片(H.E染色)Fig.1 The hematoxylin and eosin staining of the visceral ganglion
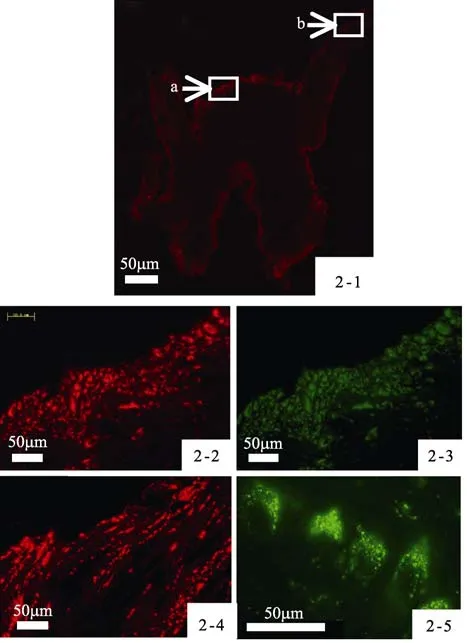
图2 褶纹冠蚌脏神经节自发荧光现象Fig.2 The occurrence of autofluorescence in the visceral anglion
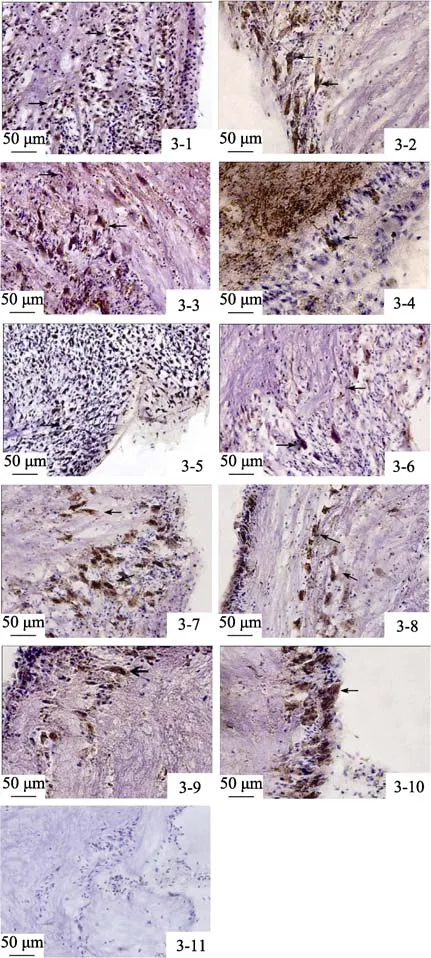
图3 褶纹冠蚌脏神经节Glu、GABA、DA、ChAT、5-HT神经元的SP法免疫组化定位Fig.3 SP immunohistochemical locanization of Glu,GABA,DA,Ach and 5-HT neurons in the visceral ganglia of Cristaria plicata
2.3.3 TH免疫阳性神经元
脏神经节的整个胞体区及神经节周围的结缔组织鞘均见TH免疫阳性细胞。在大量细胞成簇出现的区域,TH免疫阳性反应神经元大部分为小型胞体;偶见呈TH免疫阳性反应的大型神经元; 中央纤维网区可见零星的阳性反应神经末稍(图3-5,3-6)。
2.3.4 ChAT免疫阳性神经元
脏神经节背内侧靠近外套神经的胞体区有大量的中型细胞呈强 ChAT阳性反应; 在中央神经纤维网中成簇放射状夹杂排列的神经元中,也有少数中型细胞呈强 ChAT阳性反应,并夹杂有少量大型细胞亦呈弱 ChAT阳性反应。鳃神经根部有少量中型细胞聚集分布; 中央纤维网区可见较丰富的 ChAT阳性反应神经末梢(图3-7,3-8)。
2.3.5 TPH免疫阳性神经元
脏神经节胞体区大量神经元呈TPH免疫阳性细胞,靠近外套神经和鳃神经区域尤为明显。大部分免疫阳性细胞为大、中型神经元,偶见小型的免疫阳性神经元; 中央纤维网区只分布有颜色较浅的细小阳性反应纤维或末梢(图3-9,3-10)。
3 讨论
从解剖学看,瓣鳃纲褶纹冠蚌的脏神经节与腹足纲和头足纲种类有较大不同:腹足纲的脏神经节位于食管末端处,形小、无愈合,彼此有神经相连[12-13]; 头足纲的脏神经节在脑的腹面与平衡器相邻,从背面观其状似四角形[14]; 而淡水褶纹冠蚌脏神经节位于后闭壳肌腹侧,愈合,呈典型的蝴蝶状,海洋瓣鳃纲种类(例如,疣帘蛤)的脏神经节为“X”型[15]。对脏神经节进行组织学比较后发现,瓣鳃纲不同种类之间存在差异:栉孔扇贝(Chlamys farreri)胞体区含小型(5~15 μm)、大型细胞(15~36 μm)[16]; 淡水褶纹冠蚌神经节胞体区含有小型(5~15 μm)、中型(15~35 μm)和大型(35~50 μm)3 类细胞。这些差异可能与不同种类软体动物生活的环境、行使的功能和所包含的神经递质含量等差异有关[8]。
在褶纹冠蚌脏神经节,3种类型神经元均有自发的红色和绿色荧光,且红色荧光占主导。文献报道,无齿蚌脏神经节中的自发绿色荧光较黄色荧光占主导[17]; 贻贝的脑、脏神经节自发橙黄荧光较绿色荧光占主导[18]。由于黄色荧光蛋白的激发光带为490~510 nm,而本实验使用的两种激发光均不在此发光带内,故无法观察到自发黄色荧光。本实验为进一步研究褶纹冠蚌神经元是否有其他波长的自发荧光奠定了基础。
自发荧光是海洋无脊椎动物普遍存在的现象。例如,一些腔肠动物(水母、水螅和珊瑚)在受到机械刺激时会发射绿色荧光,栉水母类则发射蓝色荧光[19]。文献报道,生物胺类物质如多巴胺、5-羟色胺等经甲醛处理后可显示不同的荧光。由于褶纹冠蚌脏神经节胞体存在自发红、绿荧光现象,本实验无法运用免疫荧光技术进行双标实验,以分析不同神经递质的共存现象,这一问题亟待在今后的研究中解决。
为了研究褶纹冠蚌脏神经节内不同递质神经元的分布模式,作者采用了冰冻切片技术及SP免疫组化方法。实验结果表明,这一方法可以清晰地观察到Glu、GABA、DA、Ach和5-HT能神经元的分布规律及主要特征,不同种类神经元的形态学和分布有所不同。许多研究表明,Glu在软体动物的主要功能是参与各种运动机能的调节,如摄食[20]、游泳[21]。GABA参与调节软体动物的各种运动功能。例如,静水椎实螺(Lymnaea stagnalis)的中枢神经系统和支配某些肌肉的神经中均有GABA神经元。在一些软体动物贻贝(Mytilus galloprovincialis)、蛤蜊(Venerupis pullastra)和牡蛎(Ostera edulis)),GABA能诱导幼虫的附着和变态[22]。
文献报道,DA 在软体动物摄食方面起着重要的作用。在软体动物腹足纲中,DA参与调节食物的摄取量。在海兔中,DA在学习和记忆功能方面起重要的作用。Ach是软体动物的运动神经递质。例如,支配海兔摄食肌肉的运动神经元以Ach为递质。5-HT则参与调控多种功能。在瓣鳃纲,5-HT控制鳃和纤毛运动[23],控制出、入水管的肌肉运动,并参与摄食和学习过程[9]。5-HT还参与性别功能的神经调控,与生殖发育有关[24-26]。
本实验表明,Glu、GABA、DA、Ach和5-HT能神经元在褶纹冠蚌脏神经节中均有分布。其中GABA能神经元含量较少; GABA能神经纤维广泛分布于中央纤维网,少数 GABA能神经纤维具有静脉曲张状的突起,推测 GABA神经元在整个神经节内参与大范围、远距离的神经活动调节。5-HT能神经元大量聚集在外套神经和鳃神经附近,推测5-HT作为一种重要的神经递质在不同神经节之间起到交流作用,可能参与调控褶纹冠蚌的运动及生殖功能。关于这 5种神经递质在褶纹冠蚌脏神经节的具体生理功能,有待今后的进一步研究。
致谢:本实验的部分实验在南昌大学生命科学学院完成,部分实验在复旦大学神经生物学研究所完成。感谢徐开静和单红英两位老师在实验技术方面给予的协助。
[1]Nesic O B,Magoski N S,McKenney K K,et al.Glutamate as a putative neurotransmitter in the mollusk,Lymnaea stagnalis[J].Neuroscience,1996,79(4):1255-1269.
[2]Karhunen T,Airaksinen M S,Tuomisto L,et al.Neurotransmitters in the nervous system ofMacoma balthica(Bivalvia)[J].Comp Neurol,1993,334(3):477-488.
[3]张丽丽,于梅.五种经典神经递质在软体动物中的研究现状[J].生命科学仪器,2008,6(12):32-36.
[4]Cottrell G A.Occurrence of dopamine and noradrenaline in the nervous tissue of some invertebrate species[J].Br J Pharmacol Chemother,1967,29:63-69.
[5]Evans P D,Reale V,Merzon R M,et al.N-methyl-D-aspartate (NMDA) and non-NMDA(metabotropic ) type glutamate receptors modulate the membrane potential of the Schwann cell of the squid giant nerve fibre [J].Exp Biol,1992,173:229-249.
[6]Kerkut G A,Cottrell G A.Acetylcholine and 5-hydroxytryptamine in the snail brain [J].Comp Biochem Physiol,1963,8:53-63.
[7]Yoshida M,Kobayashi M.Identified neurons involved in the control on the buccal muscle movement on the African giant snailAchatina fulica[J].J Exp Biol,1991,155:415- 433.
[8]Dahl E,Falck B,Mecklenburg C,et al.Neuronal localization of dopamine and 5-hydroxytryptamine in some mollusca [J].Z Zellforsch,1966,71:489-498.
[9]Lolagey R D,Garew T J.Serotonin immunoreactivity of the neurons the gastropodAplysia california[J].Neurobiol,l986,17:339-386.
[10]Biasi S D,Vitellaro Z L.Distribution of 5HT-immunoreactivity in the pedal ganglion ofMytilus galloprovincialis[J].Cell Tissue Res,1987,249:111-116.
[11]Morse D E,Hooker N,Duncan H,et al.γ-Aminobutyric acid,a neurotransmitter,induces planktonic abalone larvae to settle and begin metamorphosis[J].Science,1979a,204:407-410.
[12]李国华.脉红螺(Rapana Venosa)神经系统解剖的初步研究[J].动物学报,1990,36 (4):345-351.
[13]金志良.钉螺神经系统的显微解剖[J].动物学报,1993,39(3):229-238.
[14]张彦衡.乌鲗的解剖[J].山东大学学报,1958,1:119-161.
[15]Siniscalchi A,Cavallini S,Sonetti D,et al.Serotonergic neurotransmission in the bivalveVenus verrucosa(Veneridae):a neurochemical and immunohistochemical study of the visceral ganglion and Gonads [J].Marine Biology,2004,144:1205-1212.
[16]孙虎山,王宜艳.栉孔扇贝神经节结构的显微观察[J].中国水产科学,2007,14(3):390-396.
[17]Sweeney D.The anatomical distribution of monoamines in a fresh water bivalve mollusc,Sphaerium sulcatum(L.)[J].Comp Biochem Physiol,1968,25:601-614.
[18]George B S,Edward A.Histofluorescent localization of serotonin and dopamine in the nervous system and gill ofMytilus edulis(Bivalvia) [J].Biological Bulletin,1975,148:141-156.
[19]钟卫鸿,陈建孟,陈伟,等.珊瑚和海葵来源红荧光蛋白的研究和应用[J].中国生物工程杂志,2005,25(5):10-14.
[20]Fox L E,Lloyd P E.Glutamate is a fast excitatory transmitter at some buccal neuromuscular synapses inAplysia[J].Neurophysiol,1999,82(3):1477-1488.
[21]崔素敏,王晓安.中国蛤蜊神经系统GABA和Glu的HPLC测定和免疫组化定位研究[J].四川动物,2008,27(5):764-767.
[22]Garcia M L,Sliva A.Effects of GABA and epinephrine on the settlement and metamorphosis of the larvae of four species of bivalve mollusks[J].Experimental Marine Biology and Ecology,2005,316:149-156.
[23]Stephens R E,Prior G.Dynein from serotonin-activated cilia and fl agella:extraction characteristics and distinct sites for cAMP-dependent protein phosphorylation [J].Cell Sci,1992,103:999-1012.
[24]Martınez G,Rivera A.Role of monoamines in the re-productive process ofArgopecten purpuratus[J].Invertebr Reprod,1994,25:167-174.
[25]Martınez G,Saleh F,Mettifogo L,et al.Monoamines and the release of gametes by the scallopArgopectenpurpuratus[J].J Exp Zool,1996,274:365-372.
[26]Gibbons M C,Castagna M.Serotonin as an inducer of spawning in six bivalve species[J].Aquaculture,1984,40:189-191.
