魁蚶雌核发育的人工诱导
2011-03-14聂鸿涛郑小东于瑞海
杨 青,李 琪,聂鸿涛,郑小东,于瑞海
(中国海洋大学 海水养殖教育部重点实验室,山东 青岛 266003)
人工诱导雌核发育是快速建立纯系、克隆的有效手段。目前有关水产动物雌核发育的研究多见于鱼类[1-4],在海洋经济贝类人工雌核发育研究方面,已报道的种类限于太平洋牡蛎 (Crassostrea gigas)[5]、贻贝(Mytilus edulis)[6]、地中海贻贝(Mytilus galloprovincialis)[7]、皱纹盘鲍(Haliotis discus hannai)[8]、华贵栉孔扇贝(Chlamysnobilis)[9]、虾夷扇贝(Patinopecten yessoensis)[10]、栉孔扇贝(Chlamys farrer)[11]和马氏珠母贝(Pinctada martensii)[12]等贝类,为近交系的开发以及基因着丝粒作图等遗传学研究提供了有用素材。
魁蚶(Scapharca broughtonii)俗名赤贝,属于瓣鳃纲、翼形亚纲、蚶目、蚶科,主要分布在中国、日本及朝鲜沿海,是中国近海渔业生产的重要贝类资源之一。然而,由于近年来魁蚶野生资源因滥捕、栖息地破坏而严重衰退,很多地区已较难采集。目前,国内外关于魁蚶的研究主要集中在育苗生产、增殖放流、繁殖生物学等方面,其他方面的研究报道相对较少。为保护和利用魁蚶这种珍贵的海产贝类资源,积累有关遗传学资料,本研究利用紫外线人工诱导魁蚶雌核发育并探索其最佳条件,以期为魁蚶雌核发育二倍体品系的培育和近交系的开发提供基础数据。
1 材料与方法
1.1 材料
实验所用亲贝取自山东威海自然海区的2龄贝(壳长10.7 cm±0.5 cm,壳高6.4 cm±0.3 cm)。亲贝经刷干净后入池,于浮动网箱中暂养(水温16℃),每天换水投饵,饵料为叉鞭金藻、三角褐指藻和盐藻。
1.2 精卵的采集
采用阴干升温的方法获取成熟精、卵,并分别用海水定量至浓度为1.0×107个/mL和2.0×104个/mL。所用海水为四级砂滤海水,培养温度为23~25℃。
1.3 紫外线处理精子和受精
将1.0 mL精液置于直径9.0 cm的塑料培养皿中,将培养皿置于紫外线杀菌灯下 25 cm处,用紫外线强度测定仪(法国Cole-Parmer公司)测得此条件下紫外线强度为2 561 µW/(cm2·s)。将精子在紫外线下分别处理0,10,15,20,25,30,35,40,45,50,55和60 s。照射结束后每个培养皿中加入5.0 mL卵液,充分混合后转移至烧杯培养,温度保持23~25℃。
1.4 数据统计和倍性检查
通过计算授精后 3 h分裂卵数占总处理卵数的百分比获得卵裂率,通过计算授精后8 h担轮幼虫数占总受精卵数的百分比获得早期胚胎存活率,通过计算授精后24 h D形幼虫数占总观测幼虫数的百分比获得 D形幼虫发生率。采用不同的亲贝,该实验重复进行3次。
采用染色体制片法测定担轮幼虫倍性,具体操作如下:将担轮幼虫样品浓缩后,用 0.1%的秋水仙素海水处理2 h,加入0.075 mol/L的KCl溶液低渗处理30 min,去掉低渗液,用Carnoy氏液(甲醇:冰醋酸=3:1)固定,反复固定 3次。滴片前去掉固定液,加入50%冰醋酸,用吸管轻轻吹打解离成单细胞。样品滴到已经加热的载玻片上,空气干燥后经磷酸缓冲液(pH 6.8)稀释的10% Giemsa染色。观察和计数分散较好的中期分裂相(n=1 248)以获得染色体数目。
利用流式细胞仪(德国 Partec公司,FCM)进行DNA 相对含量的分析,具体操作如下:将担轮幼虫或D形幼虫样品,滤除海水、杂质和组织块后,移入盛有1.0 mL DAPI染液的1.5 mL离心管中,-20℃冷冻保存。检测前将样品解冻后在旋涡混合器上充分解离成单细胞悬液,经20 μm筛绢过滤样品至流式细胞仪专用样品管中,进一步去除组织块,进行DNA相对含量分析。
2 结果
2.1 不同紫外线照射剂量对卵裂率、早期胚胎存活率和D形幼虫发生率的影响
不同紫外线照射时间与卵裂率、早期胚胎存活率和D形幼虫发生率的关系见图1(图1中各数据表示平均值 ± SD)。卵裂率总的趋势是随紫外线照射时间的增加而降低,对照组为89.1%,60 s照射组为20.7%。早期胚胎存活率随照射时间的增加而逐渐下降,对照组为91.3%,35 s时为52.3%; 之后随着照射剂量的增加而回升,至45 s照射组达到最高67.2%,之后再次急剧下降,60 s照射组为16.0%。D形幼虫发生率随照射时间增加显著降低,对照组为 95.2%,照射30 s时,其值变为0。
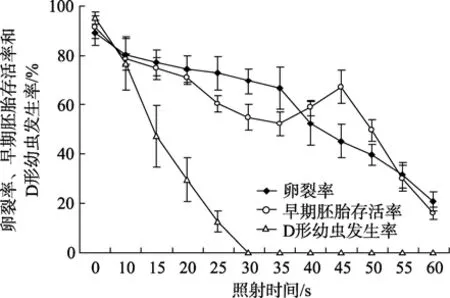
图1 卵裂率、早期胚胎存活率和D形幼虫发生率与不同紫外线照射时间之间的关系Fig.1 Relationships between ultraviolet irradiation duration and the rates of cleavage,survival at the early embryo stage and development of D-larvae
2.2 流式细胞仪测定结果
图2以DNA直方图的形式显示了对照组(0 s)和雌核发育组(45 s)担轮幼虫的 DNA相对含量。对照组和45 s照射组的DNA相对含量均有2个峰,一个为存在比率较高、DNA没有开始复制的G1期细胞,另一个为存在比率较低、DNA复制完全的G2和M期细胞[13]。其中对照组主峰值为104.95,45 s照射组主峰值为 51.18,二者的比值为 2.05,说明对照组的DNA相对含量基本上为45 s照射组的2倍,即45 s照射组能有效地诱导产生雌核发育单倍体。

图2 对照组(0 s)和雌核发育组(45 s)担轮幼虫的DNA相对含量Fig.2 Histograms of fluorescence intensity from diploid control and 45 s irradiated trochophore larvae by flow cytometry
2.3 染色体频率分布
图3显示了各实验组中的幼虫细胞染色体数目的频率分布情况。对照组中几乎全部为二倍体(2N),染色体数目为38,20 s照射组中染色体数目为2N=38的幼虫仍占一定比例,但随照射时间增加,2N比例减少,染色体数目为N=19的单倍体细胞和非整倍体细胞比例逐渐增加。45 s照射组大部分细胞染色体数目均为19,单倍体比例为37.1%,此时已无二倍体细胞。60 s照射组中染色体数目为19的细胞比例明显减少。
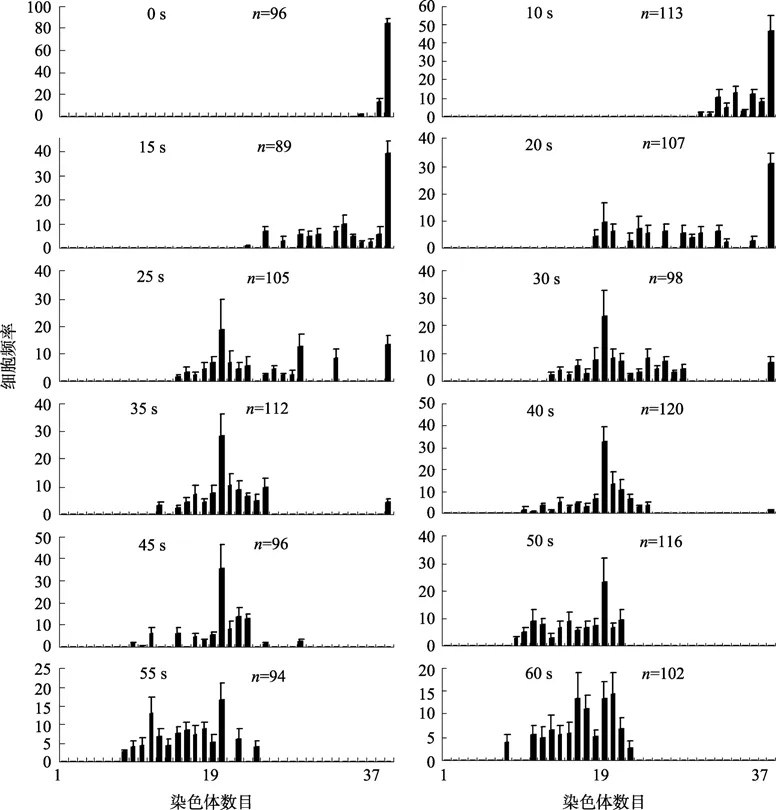
图3 各实验组细胞染色体数目分布频率Fig.3 Frequency distribution of chromosome numbers in larval cells by various durations of ultraviolet irradiation in three experiments (± SD)
3 讨论
本研究发现利用紫外线(254 nm)遗传失活魁蚶精子DNA从而诱导雌核发育是有效的。根据染色体数目分析结果和流式细胞仪分析的结果可以看出,强度为 2 561 µW/(cm2·s) 的紫外线照射 20~60 s均能诱导出魁蚶雌核发育单倍体,但照射20~40 s时二倍体仍然存在,而且照射时间超过 45 s后受精率就会明显下降。由于有效地诱导雌核发育既需要精子遗传物质失活又需要保证较高的受精率,因此强度为2 561 µW/(cm2·s)的紫外线照射遗传失活魁蚶精子的适宜剂量为45 s。在已报道的贝类雌核发育研究中,栉孔扇贝是强度为 2 561 µW/(cm2·s)的紫外线照射30 s[14],太平洋牡蛎是强度为 720 µW/(cm2·s)的紫外线照射60 s[5],地中海贻贝是强度为620 µW/(cm2·s)的紫外线照射2 min[7]。由此可见诱导贝类精子遗传失活的紫外线照射剂量因种类的不同而异。
紫外线照射导致精子染色体遗传失活的原理在于它能够使DNA氢键断裂,同一链上相邻的或双螺旋相对应的两条链上的胸腺嘧啶之间形成胸腺嘧啶二聚体,致使双螺旋两链间的氢键减弱,DNA结构局部变形,从而严重影响DNA的正常复制和转录[15]。本实验中各照射组均出现非整倍体,由于紫外线的照射剂量决定精子染色体的失活程度,因此实验中出现非整倍体可能是低剂量紫外线造成精核染色体部分失活的结果,即未完全失活的精子染色体入卵后与卵核结合,所生成的合子则为非整倍体。Watson[16]认为在特定的酶作用下,由紫外线引起的DNA损伤可以被光修复,这同样可以导致父本染色体部分参与核分裂,从而导致非整倍体的产生。
实验中随紫外线照射时间的增加,卵裂率、早期胚胎存活率和 D形幼虫发生率总体呈下降趋势,经紫外线照射的精子受精后所产生的单倍体胚胎发育速度明显慢于正常受精所产生的二倍体胚胎。卵裂率的下降表明精子激活卵子的能力随紫外线照射剂量的增加而降低,原因可能是精子中一些与受精力、胚胎发育相关的功能结构受到破坏的程度增大,从而减弱了精子的受精力。紫外线照射30 s后D形幼虫发生率降为0,照射35~45 s时早期胚胎存活率出现回升,呈现Hertwig效应。该现象在皱纹盘鲍[8,17]、太平洋牡蛎[18]、合浦珠母贝[12]、栉孔扇贝[14]等贝类的雌核发育研究中也有报道。Hertwig效应产生的原因可能是由于高辐射剂量能完全破坏精子的遗传物质,导致产生的单倍体胚胎比低剂量诱发出来的具有显性致死突变基因的非整倍体胚胎存活时间长[17]。本研究首次报道了利用紫外线诱导魁蚶雌核发育的适宜条件,为魁蚶雌核发育二倍体的人工诱导提供了基础数据。
4 结论
本研究首次研究了利用紫外线照射进行魁蚶雌核发育的人工诱导,发现随照射时间的增加,卵裂率、早期胚胎存活率和D形幼虫发生率呈下降趋势,遗传失活的精子与正常卵子受精后其胚胎发育至D形幼虫前期停止。根据染色体计数和基于流式细胞仪的细胞倍性分析,确定魁蚶精子遗传失活的最佳照射剂量为在强度 2 561 µW/(cm2·s)的紫外线下照射45 s。研究结果为开展魁蚶雌核发育二倍体的人工诱导研究奠定了基础。
[1]Purdom C E,Thompson D,Lou Y D.Genetic engineering in rainbow troutSalmo gairdneriiRichardson,by suppression of meiotic and mitotic metaphase [J].J Fish Biol,1985,27:73-79.
[2]Yamamoto E.Studies on sex-manipulation and production of cloned populations in hirame,Paralichthys olivaceus(Temminck et Schlegel) [J].Aquaculture,1999,173:235-246.
[3]Harald B T,Tillmann J B,Deborah J M R,et al.Gynogenesis and sex determination in Atlantic Halibut(Hippoglossus hippoglossus) [J].Aquaculture,2006,252:573-583.
[4]Francesc P,Rosa M C,Castora G,et al.Induction of gynogenesis in the turbot (Scophthalmus maximus):Efects of UV irradiation on sperm motility,the Hertwig efect and viability during the flint 6 months of age [J].Aquaculture,2004,238:403-419.
[5]Li Qi,Osada M,Kashihara M,et al.Induction of gynogenetic diploids and cytological studies in the Pacific oyster,Crassastrea gigas[J].Suisanzoshoku,2000,48(2):185-191.
[6]Fairbrother J E.Viable gynogenetic diploidMytilus edulis(L.) larvae produced by ultraviolet light irradiation and cytochalasin B shock [J].Aquaculture,1994,126:25-34.
[7]Scarpa J,Komaru A,Wada K T.Gynogenetic induction in the mussel,Mytilus galloprovincialis[J].Bull Natl Res Inst Aquac,1994,23:33-41.
[8]Li Qi,Osada M,Kashihara M,et al.Artificially induced gynogenetic diploid in the Pacific abalone,Haliotis discus hannai[J].Fish Genet Breed Sci,1999,28:85-94.
[9]Goswami U.Sperm density required for inducing gynogenetic haploidy in scallopChlamys nobilis[J].Indian J Mar Sci,1991,20:255-258.
[10]Li Qi,Osada M,Kashihara M,et al.Effects of ultraviolet irradiation on genetical inactivation and morphological structure of sperm of the Japanese scallop,Patinopecten yessoensis[J].Aquaculture,2000,186:233-242.
[11]Pan Ying,Li Qi,Yu Ruihai,et al.Induction of gynogenetic diploids and cytological studies in the zhikong scallop,Chlamys farreri[J].Aquat Living Resour,2004,17:201-206.
[12]许国强,林岳光,李刚,等.人工诱导合浦珠母贝雌核二倍体发生及“Hertwig”效应的初步研究 [J].热带海洋,1990,9:1-7.
[13]Bruce A,Dennis B,Julian L,et al.Molecular biology of the cell [M].New York:Garland Publishing,1994.
[14]Pan Ying,Li Qi,Yu Ruihai,et al.Induction of gynogenesis and effects of ultraviolet irradiation on ultrastructure of sperm of the Zhikong scallop,Chlamys farreri[J]. Fisheries Science,2004,70:487-496.
[15]楼允东.人工雌核发育及其在遗传学和水产养殖上的应用 [J].水产学报,1986,10(1):111-123.
[16]Watson J D.Molecular Biology of the Gene [M].London:W A Benjamin,Inc.1975.
[17]Kijima A.Effect of UV irradiation on genetic inactivation of sperm using marketing tissue culture petri dish in the Pacific abaloneHaliotis discus hannai[J].Tohoku Journal of Agriculture Research,1992,42:73-81.
[18]Guo Ximing,Gaffney P M.Artificial gynogenesis with ultraviolet light-irradiated sperm in the Pacific oyster,Crassostrea gigasII.Allozyme inheritance and early growth [J].Heredity,1993,84:311-315.
