基于MONTE-CARLO模型的细胞传感器纳米颗粒表面处理分析*
2011-03-10徐铭恩钱丽娟
徐 莹,韩 斌,徐铭恩,钱丽娟
(1.杭州电子科技大学自动化学院生物医学工程及仪器研究所,杭州310018;2.浙江省肿瘤医院肿瘤研究所,杭州310018)
随着微加工工艺的发展,细胞传感器和芯片的结合已经越来越紧密。目前比较常用的细胞传感器主要有胞外电位检测类器件如微电极阵列MEA(Microelectrode Arrays)[1]和场效应管(Field Effect Transistor,FET)[2],阻抗测试仪 (Electric Cell-substrate Impedance Sensing,ECIS)等[3]。通常用于细胞电生理活动记录的电极阵列是一个和细胞大小相匹配、具有独立引线的金属薄片圆盘阵列,当具有电兴奋性或生理活性的细胞或组织培养于其上时,能感应胞外动作电位及其形态等生理参数的变化,将相关的电学参数输出至外部系统。
表面处理是衔接细胞一级传感和芯片二级传感的关键。细胞与硅器件耦合的情况,直接影响测量信号的大小,尤其对于不太容易贴壁生长的神经细胞来说,有时信号甚至会淹没在噪声中。对于测试细胞动作电位的微电极阵列,更需繁琐有效的表面处理过程,使细胞耦合并定位在电极有效区域,才具备二级传感信号。电极表面处理的量化分析可用于说明器件和细胞耦合的难易程度[4],但微电极在固体电极上伏安行为的重现性差,发生不重现的原因与固体电极的表面状态直接有关:金属表面具有一定的表面能,因在其晶体的棱面原子上具有未饱和的价态,这种表面能的分布不均匀。晶面上存在的缺陷,如台阶、纽结、螺旋错位和吸附原子等,使溶液中的许多物质很容易吸附到这些具高能的点位上而造成污染。另一方面,金属被化学或电化学的方法氧化。其表面产生氧化物膜(如铂上的 PtO和PtO2)并吸附,容易形成惰化层。所以固体电极进行表面处理的第一步是进行机械研磨、抛光至镜面程度[5-6]。
表面处理通常可分为几个步骤。为提高微阵列的电学特性,通常对电极进行铂黑纳米粒子的电镀,并在电生理测试前进行电化学测试,以避免铂黑颗粒贴附性的退化。对于未使用过的铂黑电极,其在1 mol/L H2SO4中的极化电容值为24 mF/cm2(采用伏安法对双电层区域的测试结果,V=50 mV/s),粗糙因子约为185,当使用后的电极参数明显低于该参数时(5倍左右),电极特性较差。之后,表面处理的生物素处理步骤可分为单分子或多分子层电极修饰,主要分为蘸涂、滴涂和旋涂法。这些方法均需通过化学物质的官能团来影响细胞和器件的有效贴附性。有研究者对培养神经元的基底进行化学和几何改性,将某介质蛋白层粘素吸附在器件上,该器件表面易生长具特殊形态的海马神经元,其主要依赖于层粘素单膜表面的化学特性[7]。所以生物素的有效作用位点也导致了器件处理的差异和不均匀性。因此,目前对于生物传感器普遍要求电镀铂黑纳米颗粒后再进行生物素的涂布,以提高表面处理的有效性。最后,细胞和电极的贴附需采用几次清洗、再沉积过程才能达到各电极相对的稳定和一致的贴附程度。目前对于表面处理的效果还未有较直观的理论仿真测试,只能采用电化学方法、光谱法、波谱法、QCM和显微学等实验方法等进行间接测试和直接观察。
所以本文采用Monte-Carlo统计模型,判断电极上电镀铂黑纳米颗粒、贴附生物素膜后,电极表面均匀有机膜的上膜颗粒孔径和有效程度等。由于将纳米尺度的生物素涂覆到电极表面时,首先需要将生物素溶解充分后再滴至电极表面,该过程可等效为匀质颗粒随机沉积到电极表面的过程,经搅拌均匀和清洗、再贴附的过程控制越精确,颗粒匀质程度越高,贴附程度越好。模型可定义一个有效表面贴附率C来判断生物素贴附程度。根据模型的简化程度,可分别假设沉积的纳米颗粒为二维圆形和三维球形,微电极表面为圆盘结构;同时纳米颗粒在电极上的贴附被认为是不可逆的,即一旦贴附上,不存在后期的脱附问题。
1 表面处理的相关仿真
1.1 单层贴附颗粒在电极上的分布
假设电极半径R,考虑实验中电极和表面处理的颗粒一般尺度大小,设半径r,R>100r,表面处理过程可等效为将铂黑纳米颗粒吸附到电极表面上。由于表面处理中同种颗粒的相互排斥性,若某粒子在贴附到电极的过程中,连续100次与电极上已贴附颗粒重叠(包括部分重叠),则该次实验结束,记录此时的贴附率为C1,连续1 000次实验后,将C1至C1000的分布进行统计得到分布图曲线,判断电极上纳米颗粒贴附程度的有效贴附程度。
分析中,令圆盘金电极半径R固定,沉积的铂黑纳米粒子半径r动态变化,观察粒子面积总和与电极面积比值的贴附率概率分布。实验结束条件为某一欲沉积的纳米粒子连续1 000次与已经在圆盘电极中贴附的纳米粒子重叠。考虑一般微电极的尺度,实验参数设置为:圆盘电极半径R=12.5 μm;纳米粒子在1个数量级内选取不同分散度,粒径分别为 r=50,[50 100],100,[100 150],150,[150 200],200,[50 200](单位:nm)。
实验结果如图1所示。当纳米粒子的半径固定时,从概率分布图上可以看出,随着粒子半径的增大,面积贴附率越大;但当粒子半径增加到一定程度时,面积贴附率将稳定在某一范围,不会随着半径的增大出现显著的变化,如150 nm粒径与200 nm单一粒径的覆盖率均在46%左右。同时,在实验操作中,纳米粒子的半径是不固定的[4]。当符合均匀分布的粒子半径分散度在某一区间范围内,随着区间范围的增大,贴附率也增大,如粒径散度为[50~200]nm的粒子贴附率提高至53%;但是,由实验结果可看出,区间分散度相等情况下,粒径越大,面积比反而减小,如贴附率结果为[50~100]nm>[100~150]nm >[150~200]nm;同时,粒径分散度越大,贴附率也越高,如[50~200]nm粒径的面积覆盖率达53%,且概率分布峰值也较显著。所以,纳米粒子的粒径制备和淀积在达到实验要求的基础上,平均粒径可适当减小,粒径分散度可增大至一个数量级,从而达到较佳的电极总面积有效覆盖率。
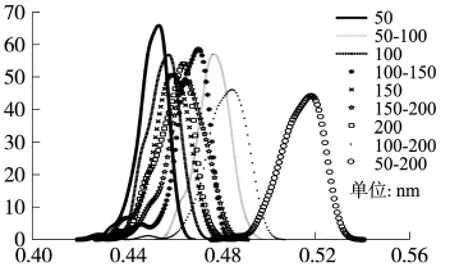
图1 粒径和分散度不同的单层贴附颗粒在圆盘电极上的贴附率分布
1.2 多层异质颗粒贴附有效性的仿真
在细胞微电极阵列的处理过程中,需要在铂黑纳米颗粒沉积后,再对电极阵列做多种生物膜的沉积处理,即在铂黑等纳米颗粒A沉积上后,在该部分上继续沉积B生物膜,然后再进行一些靶向的生物量测试,实现一种“层层贴附”的处理方式。在此情况下,研究生物膜的有效覆盖率具有必要性。为简化计算,圆盘电极半径仍固定为R,纳米粒子A及生物膜颗粒B半径RA、RB符合均匀分布,在A沉积于电极后,再淀积B颗粒,观察B贴附率的分布曲线,即条件概率分布关系。其中S,圆盘电极面积;SA,圆盘电极中 A颗粒的面积和;SB-in,表示圆盘电极被A铺满后,A区域内B颗粒的面积和,比较A/B各面积覆盖率的概率分布关系。为了计算的简便,仍采用二维模型进行分析。
为说明实验的有效重复性,圆盘电极半径分别采用R=12.5 μm和35 μm进行比较。铂黑粒子A粒径 RA=50,[50 100],100,[100 150],150,[150 200],200,[50 200]nm;考虑采用的统计模型及实验中一般生物素的分子量和粒径大小,该模型适用于具有较小粒径的B颗粒,在实验操作中,例如各种靶向生物病毒颗粒;取RB=[20~50]nm,在此条件下分析相关结果。考虑生物实验中贴附的有效性,若A粒子连续1 000次与已沉积的A粒子重合;且B粒子连续1 000次与已沉积的B粒子重合,则实验结束(图2为实验的直观分布结果)。
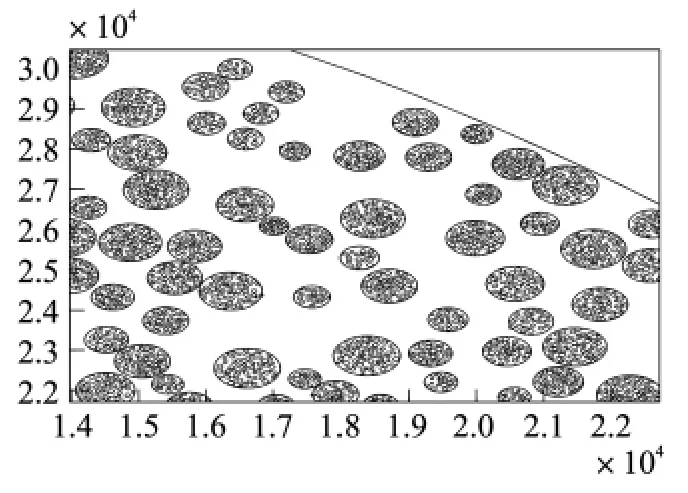
图2 简化A粒子和B粒子为二维圆,当B粒径小于A粒子时,B在A表面的淀积分布情况
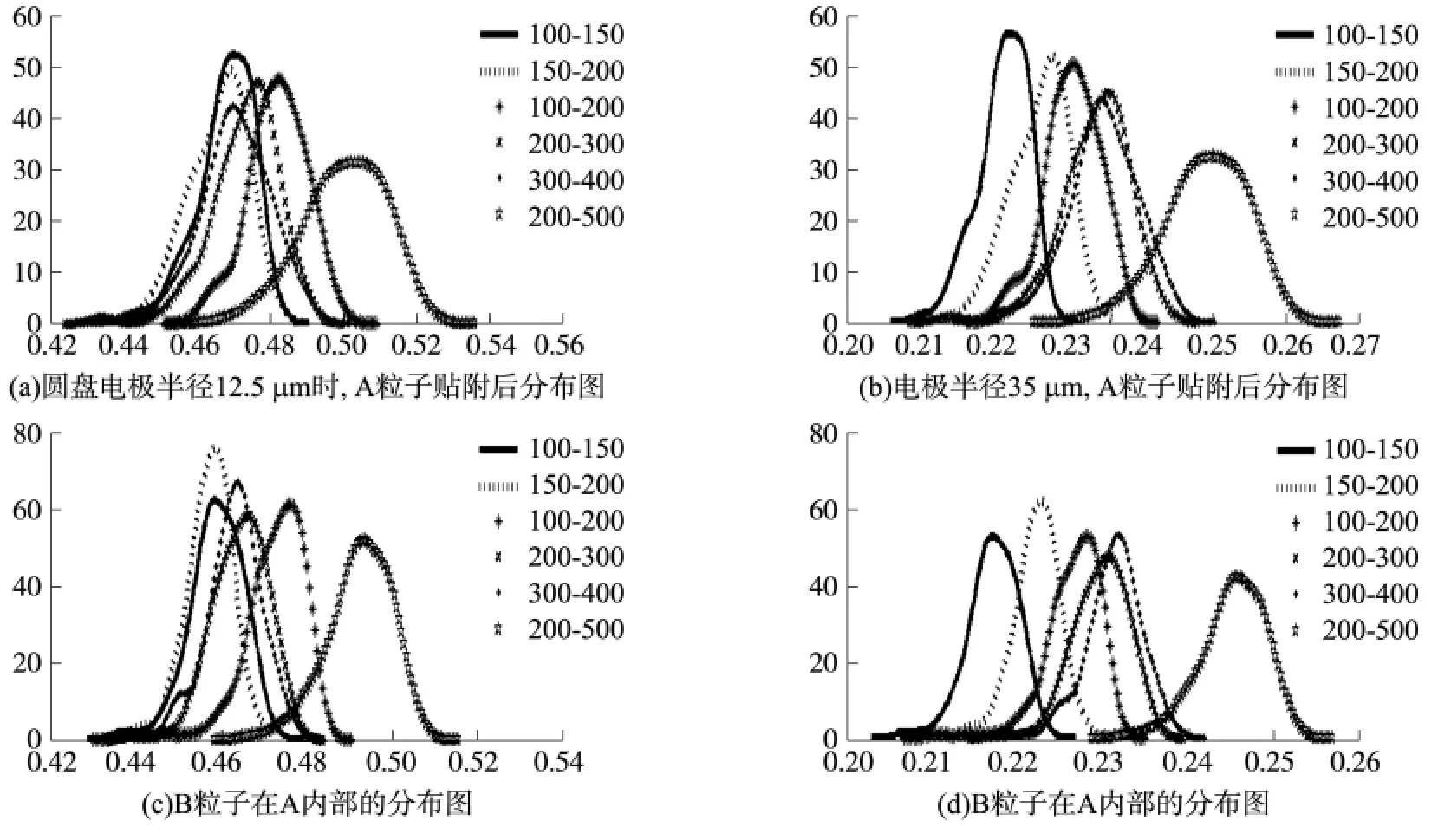
图3 A粒子贴附分布及B粒子在A内部的分布图(单位:nm)
统计结果如图3所示。其中,A粒子的贴附率分析同§1.1实验结果一致;B粒子与A粒子的分布趋势基本一致,即面积贴附率随着A平均粒径RA和其分散度的增大而增大,但面积比的概率分布峰形显著程度明显下降,即方差明显增大。所以对于多层异质性颗粒,每一层的粒径分散度越大,面积贴附率也越高,并且其贴附率远大于该分布区间的单一粒子的粒径最大值分布结果,但峰形显著程度明显下降,如粒径分散度为[200~500]nm(贴附率概率分布峰值仅30%)与[100~150]nm(贴附率概率分布峰值达50%)的纳米颗粒分布结果。另外,比较图3(a)、3(b)的概率分布和面积覆盖率情况,可见圆盘电极的大小对整体趋势影响不大。所以当贴附多层生物素时,应综合考虑贴附粒子的单一粒径大小或均匀分布的粒径分散度区间。当然,由于该二维统计方法的局限性和粒子粒径的选择范围,具体的贴附率情况仍需进一步进行分析。
为进一步验证A与B粒子的覆盖率关系,还可采用逆向分析的方法参照分析。即A粒子贴附电极步骤完成后,判断B粒子在A粒子以外的圆盘电极部分的覆盖情况,然后与图3的分析结果进行对比。实验结果发现,对于单一粒径分布或粒径分散度不大的粒子,虽然由于统计方法不同,面积贴附率存在明显区别,但概率分布峰形显著程度变化趋势与图3基本一致,因此也可作为§1.2实验结果的参照。然而对于均匀分布粒子,随着粒径及其分散度的增大,结果与图3存在明显不同。例如,在图4中当A粒径分散度分别为[100~500]nm、[200~500]nm、[300~500]nm 时,图3、图4的分布率结果相反,原因在于A粒子的分布不均匀性同样能有效提高B粒子在圆盘电极其它区域的贴附程度,所以逆向分析结果也相反。因此该实验结果作为对§1.2实验的参照,适用于沉积的纳米粒子粒径和分散度均较小的情况。
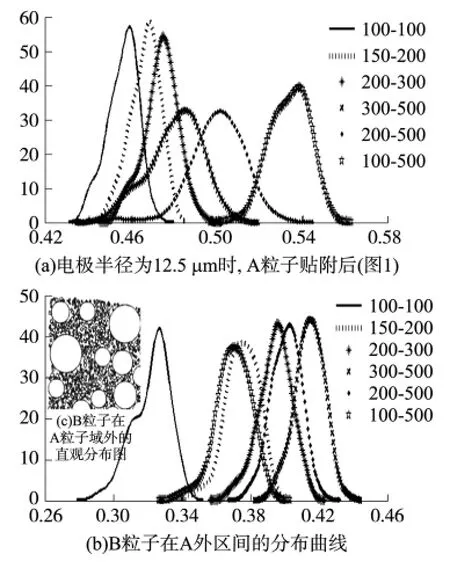
图4 电极半径为12.5 μm时,A粒子贴附后的分布及B粒子在外区间的分布图
1.3 三维异质纳米颗粒贴附性的模型分析
在实际的实验操作中,A和B均为三维的颗粒。例如,当在电极上电镀铂黑颗粒后,其三维结构的表面积总和应远大于原圆盘电极表面积。由于统计A粒子的贴附率分布时,球体和圆形的模型计算结果差异不大,仍可采用§1.1实验进行分析;而当多层粒子沉积时,例如B沉积在A粒子表面时,虽然可采用§1.1实验来讨论B粒子的贴附率分布区间和各贴附率曲线随粒径大小的大致变化趋势,但具体数值则由于二维和三维的模型、及生物素A/B的粒径不同存在较大差异。为更好说明实际操作中多层粒子分层贴附的情况,应将A和B均考虑为粒径在相同分布区间的三维纳米球型粒子进一步讨论。由于实验中各生物层粘素的主要成分为蛋白质,大小在60 kDa~150 kDa,同时各种纳米粒子的粒径大小一般在r=[50~200]nm左右,所以统一A和B的粒径均为分散度为[50~200]nm的粒子。当A粒子贴附完成后,假设每个A粒子的有效贴附区域为上半球表面,对各个粒子根据表面积公式进行总求和运算,讨论SA与S的关系;然后再分析球体B粒子在SA上的贴附率SB,最终说明SB贴附率变化。
实验结束条件同§1.2,且B部分或全部与A接触为有效贴附;实验参数及方法设置为:圆盘电极R=12.5 μm;纳米粒子 A 的半径 RA=[50 ~200]nm;生物素B的半径RB=[50~200]nm。
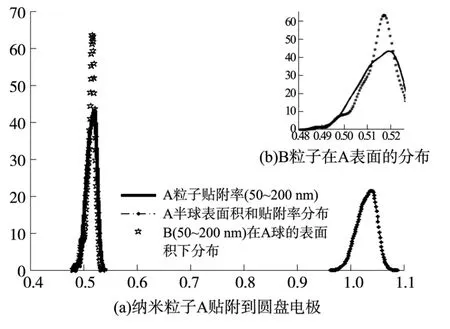
图5 当纳米粒子A贴附到圆盘电极后(a),将纳米粒子A以三维球体模型计算B粒子在A表面的分布(放大图b)
当纳米粒子A(RA=[50-200]nm)贴附到圆盘电极(R=12.5 μm)后,将纳米粒子A以球体模型计算A贴附在圆盘电极上的分布,各A粒子上半球表面积之和SA与S之比,分布图如图5黑色点线所示,可见贴附在圆盘电极上的各种粒径的A粒子表面积和比圆盘电极略有增大;考虑A粒子面积贴附率分布区间 p=[0.97~1.07],可等价为一个面积为pS的新圆盘电极,计算生物素颗粒B(RB=[50~200]nm)在该等效电极的面积分布区间内重新贴附后,各B粒子分布曲线的统计估计值,得到最终分布图如星形线所示。这可理解为当纳米粒子存在后,生物素在圆盘电极上的表面处理结果(即B在A存在下的条件概率分布曲线),结果发现,当B在A存在时,其表面贴附率稳定在51.5%左右;而A粒子贴附率的峰值也达到了52%(图5右上图,实线),但达到该贴附率对应的概率分布最大峰值仅为40%,低于前者的60%,这说明多层处理后,圆盘电极表面处理的贴附率虽无明显增大,但处理结果均一重复性提高,更易得到稳定的实验结果并进行统计分析。另外,分析也进一步考虑了A/B纳米粒径分散跨度为一个数量级的区间分布,即[5~500]nm的颗粒,结果与图5差异不大,说明纳米粒子的分散度增加虽能增大后期处理的贴附率,但跨一个数量级以上的粒子分散度对有效贴附率提高作用不大。综上,纳米粒子(如铂黑颗粒等)的电镀贴附处理,能有效降低金电极表面的电极阻抗,增大多层生物素贴附的有效性,减小电极阵列间生物素处理的差异性,因此在电极上进行铂黑处理是必要的,粒径分散度可在一个数量级范围内适当增大。
在实际操作中,生物素B并非一个个单独的悬挂在纳米粒子A上的,粒子间的缝隙、褶皱都可以增大B贴附的概率,而由实验结果得出,A粒子的不均匀性更能增大B的堆积贴附率,这也是实验中可采用铂黑纳米粒子电镀于金圆盘电极上,提高表面处理的有效表面积、减小电极体阻抗的主要原因。
从§1.2实验得出,若采用二维圆盘模型,当A粒径为[50~200]nm,B粒径[20~50]nm,B在 A粒子上贴附后,能达到的有效贴附度40%左右;而当A、B粒径区间均取值[50~200]nm时,由于A、B粒径处于同一分散度,不宜采用§1.2实验方法,否则理论与实际的分析结果将存在更大差异。所以当多层贴附的粒径A/B/C的粒径差异不大时,为了分析准确性,应采用复杂度较高的三维粒子分析方法,而当多层贴附的粒径及分散度均较小时,为了计算简便程度,也可采用二维方法来讨论多层粒子的有效贴附率分布随粒径分散度的变化。
2 电极电镀及交流阻抗实验
实验采用了不同直径、间距的圆盘电极阵列作为测试芯片进行了初步测试。以细胞阻抗电生理测试系统ECIS芯片[8-9]的设计进行改进,主要用途是根据阵列的实时电化学阻抗测试结果,分析细胞形态、细胞贴附等相对静态参数;同时,其不同的阵列间距设计也可用于测试细胞的迁移及活性等动态参数。芯片各部分的布局如图6所示。
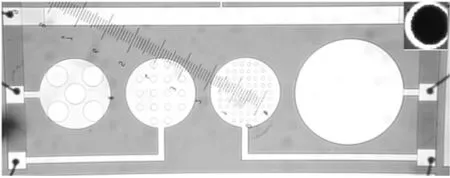
图6 基于微加工工艺的金圆盘电极照片(右上图:单电极电镀铂黑后照片)
整个芯片面积大小为6 mm×3 mm。芯片各模块共享参考电极。表1为圆盘电极各部分参数,共为4个具有微阵列点的金圆盘电极。其中圆盘电极1为单个直径1.5 mm的金电极,用于细胞与电极贴附后的初步电生理阻抗测试;圆盘电极2直径1 mm,阵列的单个电极点直径为25 μm,和普通细胞大小10 μm~30 μm大小相匹配,主要用于测试贴壁性细胞的迁移及电生理活性等动态参数,圆盘电极3和4直径均为1 mm,阵列点直径和间距分别为100 um,250 um,等间隔排布,主要用于分析细胞形态、细胞贴附等相对静态参数,并尽量减小相邻电极之间的电场干扰问题。

表1 集成圆盘电极阵列芯片各模块参数
为说明电镀铂黑粒子对圆盘电极表面积及阻抗的影响,对圆盘电极进行电镀前后的交流阻抗比较试验[10-11]。以直径和间距最小的圆盘微阵列电极2为例(d=25 μm),在 1 kHz时,阻抗值约为 500 kΩ,符合微电极能测到细胞阻抗电信号的要求,但会产生较大的热噪声,因此仍需要做表面处理,即采用电镀铂黑颗粒的方法,降低噪声,平稳基线[12-13]。微电极阵列上的铂黑沉积过程简述如下:采用三电极法,电极浸泡在2%氯铂酸水溶液中,控制电流密度为5 mA/cm2,圆盘电极为阴极;阳极为铂电极,Ag/AgCl为参考电极。电镀时,阳极和阴极需进行观察并及时调整位置,以使得电化学过程在阴极表面电流分布均匀。沉积1 μm厚的(2 mg/cm2)多孔性铂膜层,耗时需10 min。实验条件控制在室温下进行,可在沉积过程中添加搅拌子使贴附的颗粒更为均匀。沉积后,电极应迅速取出并用去离子水彻底清洗,以除去电镀液。该电极可在去离子水中保存直至使用,也可在干燥器中充氮保存。如电极久置出现钝化,可在新鲜热硫酸溶液(体积比50%)中浸泡5s清洗后再使用,或重复电镀。
图7为电镀前后,圆盘电极阵列2在0.9%的NaCl溶液中采用三电极电路对电镀前后的电极交流阻抗图进行比较(n=10,直流偏置-0.2 V,加载10 mV交流电压)。在性能测试中,铂黑颗粒使电极的阻抗幅值和相位均产生了一定的变化。电镀前后,交流阻抗幅值基本下降一个数量级,幅值均随着频率的升高逐渐下降,但电镀后低频段内(1 Hz~100 Hz)阻值随频率变化的斜率无中高频段变化显著,所以针对阻抗幅值灵敏度的测试适合在中高频段1 kHz~100 kHz进行;对于电镀前后的电极相位,在1 kHz~10 kHz内,均为一基本恒定值(-80°左右),因此可以判断电极主要呈容性,测试灵敏度不高。但电镀后低频和高频的相位随频率变化更明显,所以在实际测试细胞贴壁阻抗时,为说明生物膜等有机物引起的电极表面容性阻抗的变化,10 kHz~100 kHz更适宜测试,且具有较好的灵敏度。因此,对电镀前后的圆盘电极交流阻抗测试说明电镀能有效增加电极表面积,从而改善电极的体阻抗及灵敏度。后期可针对电镀后电极所培养细胞的不同,对于多种生物素在电极表面贴附率的实验进行分析研究。
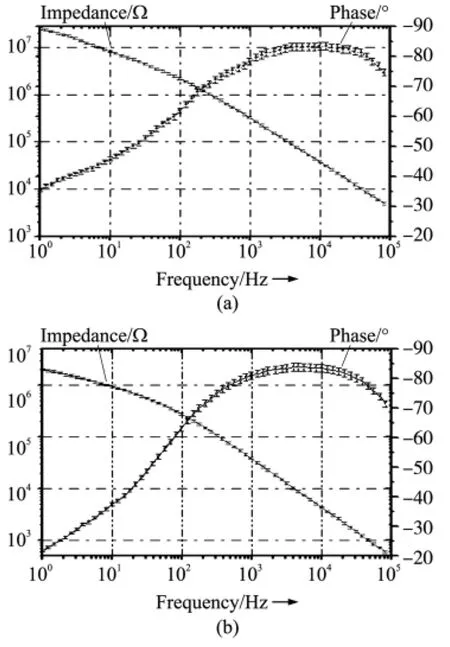
图7 电镀纳米铂黑颗粒前(a)后(b)的金圆盘电极交流阻抗图比较
3 讨论
本文针对圆盘金微电极阵列的表面处理贴附率有效性进行了Monte-Carlo三种分布模型的统计分析,在此基础上开展相关的电镀和交流阻抗实验,从理论和实验角度说明纳米颗粒及其粒径散度的表面处理对于生物微电极阵列的重要性,阐述了后期实验的方向。目前细胞微电极阵列的普遍问题是相关电生理实验缺乏可重复性,成为快速分析的瓶颈。所以对电极-细胞耦合程度的量化分析有助于后期实验重现性、细胞与电极耦合有效性及细胞电生理信号特异识别性。表面处理技术的量化评估,有利于建立基于高通量平台的实验生物学、计算生物学、信息处理技术有机结合的研究方法,更易实现细胞芯片的便携化和商品化,开拓食品、环境科学等相关应用领域[14-15]。
[1]Kovacs G T A,Electronic Sensors with Living Cellular Components[J].Proceeding of the IEEE,2003,91:915-922.
[2]Ingebrandt.Cardiomyocyte-Transistor-Hybrids for Sensor Application[J].Biosensor& Bioelectronics,2001,16:565-570.
[3]Dorielle T.Design Rule for Optimization of Microelectrodes Used in Electric Cell-Substrate Impedance Sensing(ECIS)[J].Biosensors and Bioelectronics,2009,24:2071-2076.
[4]Benilova I V.Electrochemical Study of Human Olfactory Receptor OR 17-40 Stimulation by Odorants in Solution[J].Mater Sci Eng C,2008,28:633-639.
[5]Albers W M.Immobilization of Biomolecules Onto Organized Molecular Assemblies[J].Technical Research Centre of Finland,VTT Publications,1999,391:37-124.
[6]Li Q M.A method for in Situ Auto-Renewal of the Surface of Glassy Carbon Electrodes[J].Journal of Electroanalytical Chemistry,2003,560:19-23.
[7]Cheng M.Surface Modification and Characterization of Chitosan Film Blended with Poly-L-Lysine[J].J Biomater Appl,2004,19:59-75.
[8]Keese C R,Wegener J,Walker S R,et al.Electrical Wound-Healing Assay for Cells in Vitro[J].Proc Nat Acad Sci USA,2004,101:1554-1559.
[9]Okeqawa T,Pong R C,Li Y,te al.The Role of Cell Adhesion Molecule in Cancer Progression and its Application in Cancer Therapy[J].Acta Biochem.Poi.2004,51:445-457.
[10]Franks W.Impedance Characterization and Modeling of Electrodes for Biomedical Applications Biomedical Engineering[J],IEEE Transactions,2005,52(7):1295-1302.
[11]Kindlundh M.A Gel-Based Wafer-Level Testing Procedure for Microelectrodes[J].Sens Actuators,B Chem,2005,107(2):557-562.
[12]Amit R,Ragini R S,Nick F et al.Cell-Based Screening for Membranal and Cytoplasmatic Markers Using Dielectric Spectroscopy[J].Biophysical Chemistry 2008,135:59-68.
[13]Czaplewski B D.Preparation and Characterization of Platinum Black Electrodes[J].Journal of Materials Science,2000,35:2447-2457.
[14]Liu Q J.Impedance Studies of Bio-Behavior and Chemosensitivity of Cancer Cells by Micro-Electrode Arrays[J].Biosensors and Bioelectronics 2009,24:1305-1310.
[15]Karasinski J,Andreescu S,Sadik O A.Multiarray Sensors with Pattern Recognition for the Detection,Classification and Differentiation of Bacteria at Species and Subspecies Levels[Z].Methods,2005,37:84-93.
