罗汉果快繁技术研究
2011-03-07邝玮琦饶力群彭国平
邝玮琦,饶力群,李 倩,聂 凯,彭国平
(湖南农业大学生物科学技术学院,湖南 长沙 410128)
罗汉果,学名“光果木鳖”[Siraitia grosvenori(Swingle)C.Jeffrey],为葫芦(Cucurbiataceae)罗汉果属多年生草质藤本植物,主产地为桂林龙胜、龙脊、永福、临桂等地区,目前贵州、湖南、江西等省都有移栽。罗汉果主要成分罗汉果苷Ⅴ,其甜度是蔗糖的425倍[1],而其热量几乎为零。最近研究表明,罗汉果中的罗汉果苷和罗汉果醇具有清除自由基抗脂质过氧化和抗糖尿病的作用[2]。20世纪80年代林荣等开始对罗汉果组培技术进行研究。付长亮和马小军[5]利用茎尖培养得到脱毒的罗汉果组培苗。本实验首先通过湖南本土的适宜性移栽,选取生长旺盛的罗汉果植株的茎段作为外植体得到脱毒的无菌苗。利用正交设计的方法研究不同外源激素添加物对罗汉果继代增殖的的影响,并且利用SPSS17.0软件对正交实验进行设计和方差分析,以期筛选出适合罗汉果茎段增殖和生根的培养基。
1 材料和方法
1.1 材料
实验材料为罗汉果脱毒继代4代瓶苗。
1.2 方法
将罗汉果瓶苗茎段剪成1~2 cm带芽茎段,接入含50mL培养基的240 mL培养瓶,每个培养瓶接种2个茎段。光照12 h/d,光照强度3 000 lx,温度26±2℃,培养30 d后计数。
1.2.1 单因素实验 以MS+BA 0.5 mg/L+IBA 0.1 mg/L+NAA 0.01mg/L+蔗糖 30 g/L+琼脂粉 5 g/L为基本培养基,以6-BA,IBA,NAA,蔗糖作为单因素条件,各设 5 个水平:6-BA(0.1、0.5、1.0、2.0、3.0 mg/L),IBA (0.05、0.1、0.2、0.3、0.4 mg/L),NAA(0.01、0.05、0.1、0.15、0.2 mg/L),蔗糖(10、20、30、40、50 g/L),分别考察其对脱毒苗茎段的影响。
1.2.2 罗汉果茎段增殖正交实验 以MS为基本培育基,4 因素各设置 3 个水平:6-BA(0.3、0.5、0.7 mg/L),IBA(0.1、0.2、0.3 mg/L),NAA(0.01、0.05、0.1 mg/L),蔗糖(20、30、40 g/L)。筛选出最适合罗汉果茎段不定芽的增殖培养基,如表1所示。
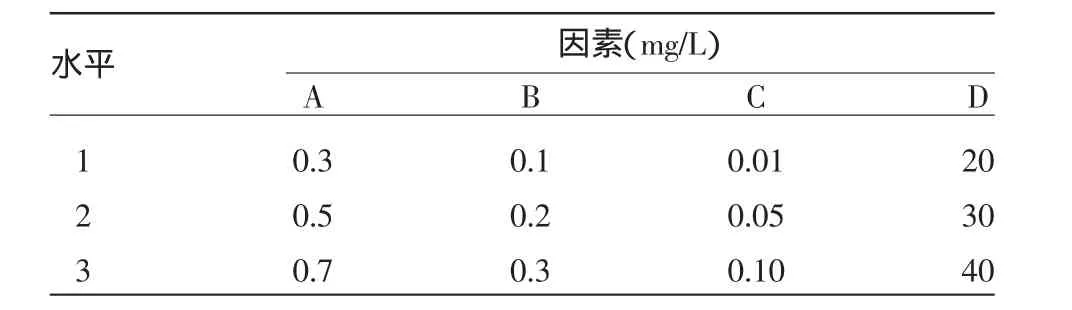
表1 罗汉果茎段增殖正交设计L9(34)水平表
1.2.3 数据分析 利用SPSS17.0分析软件进行数据分析,得到方差结果,根据极差筛选出最佳的增殖培养基配方。
1.2.4 生根培养 将增殖培养的无菌苗剪成双节茎段接种于下列三种生根培养基中:①1/2MS+6-BA 0.1 mg/L+NAA 0.1 mg/L+活性碳0.01%+琼脂5%+蔗糖 30%,pH=5.8;②1/2MS+6-BA 0.1mg/L+IBA 0.5 mg/L+活性碳0.01%+琼脂5%+蔗糖30%,pH=5.8;③1/2MS+NAA 0.1mg/L+活性碳 0.01%+琼脂5%+蔗糖30%,pH=5.8。每种培养基接种20个双节茎段,培养30 d后记录生根率。
2 结果与分析
2.1 单因素对罗汉果茎段增殖的影响
2.1.1 不同6-BA浓度对罗汉果茎段增殖的影响不同6-BA浓度对罗汉果茎段增殖的影响如表2所示。当6-BA浓度为0.1~1.0mg/L时,随着激素浓度的增加,茎段的增殖倍数也增加,长势都很好,
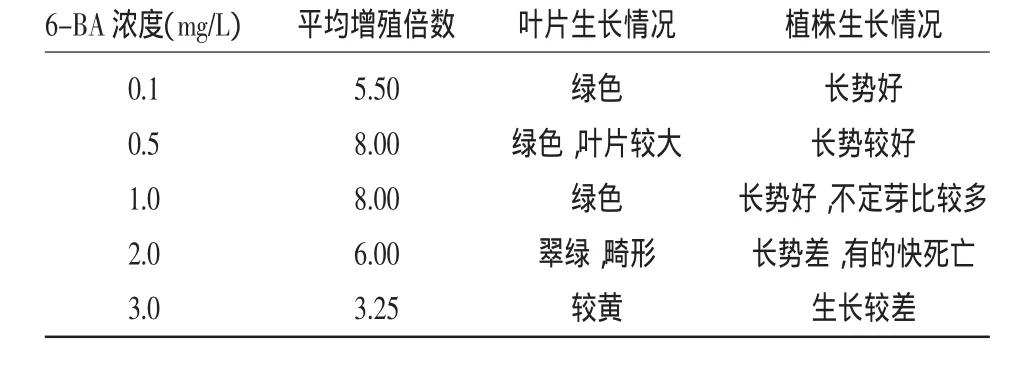
表2 不同6-BA浓度对罗汉果茎段增殖的影响
但当6-BA浓度上升到3.0mg/L时,罗汉果茎段和叶片枯黄,叶片畸形,综合比较以0.5 mg/L为最佳浓度,浓度高于1.0mg/L不利于组培苗的遗传稳定。当6-BA浓度低于0.1mg/L时不能有效诱导细胞分裂,增殖倍数低。
2.1.2 不同IBA浓度对罗汉果茎段增殖的影响 不同IBA浓度对罗汉果茎段增殖的影响如表3所示。当IBA浓度小于0.1mg/L时,不能有效刺激茎段细胞生长,茎段长势差。当IBA浓度大于0.1mg/L时,增殖倍数没有很大变化,但当IBA浓度大于0.3 mg/L时叶片比较多,而且大,不利于茎段的增殖。综合比较以0.2mg/L为最佳浓度。
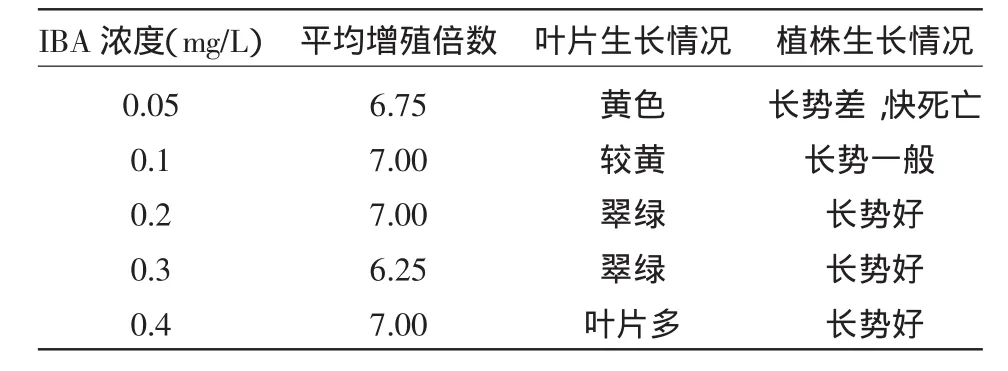
表3 不同IBA浓度对罗汉果茎段增殖的影响
2.1.3 不同NAA浓度对罗汉果茎段增殖的影响不同NAA浓度对罗汉果茎段增殖的影响如表4所示。当NAA浓度高于0.1 mg/L时会使罗汉果的营养生长过盛,叶片多而且大,并且茎段开始有生根的趋势,不利于茎段的增殖。综合比较以0.1mg/L为最佳浓度。

表4 不同NAA浓度对罗汉果茎段增殖的影响
2.1.4 不同蔗糖浓度对罗汉果茎段增殖的影响 不同蔗糖浓度对罗汉果茎段增殖的影响如表5所示。蔗糖作为碳源对罗汉果茎段影响显著,浓度低于20mg/L时不足以提供生长所需的碳源,叶片变成黄色。同时,蔗糖也起到了调节渗透压的作用,当蔗糖浓度高于30mg/L时,都会引起渗透压处于超最适水平[3]。因此,以蔗糖浓度30 g/L为最佳浓度。
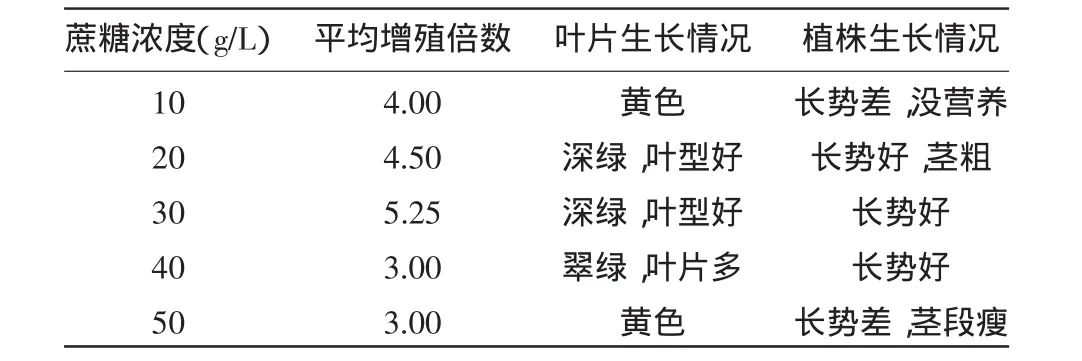
表5 不同蔗糖浓度对罗汉果茎段增殖的影响
2.2 正交实验
2.2.1 实验结果 正交实验的结果(表6)显示了各因素不同水平的极差,从表6中可知Ra=3.083;Rb=3.250;Rc=0.916;Rd=3.584。4因素对罗汉果茎段增殖的影响大小依次是:蔗糖>IBA>6-BA>NAA。
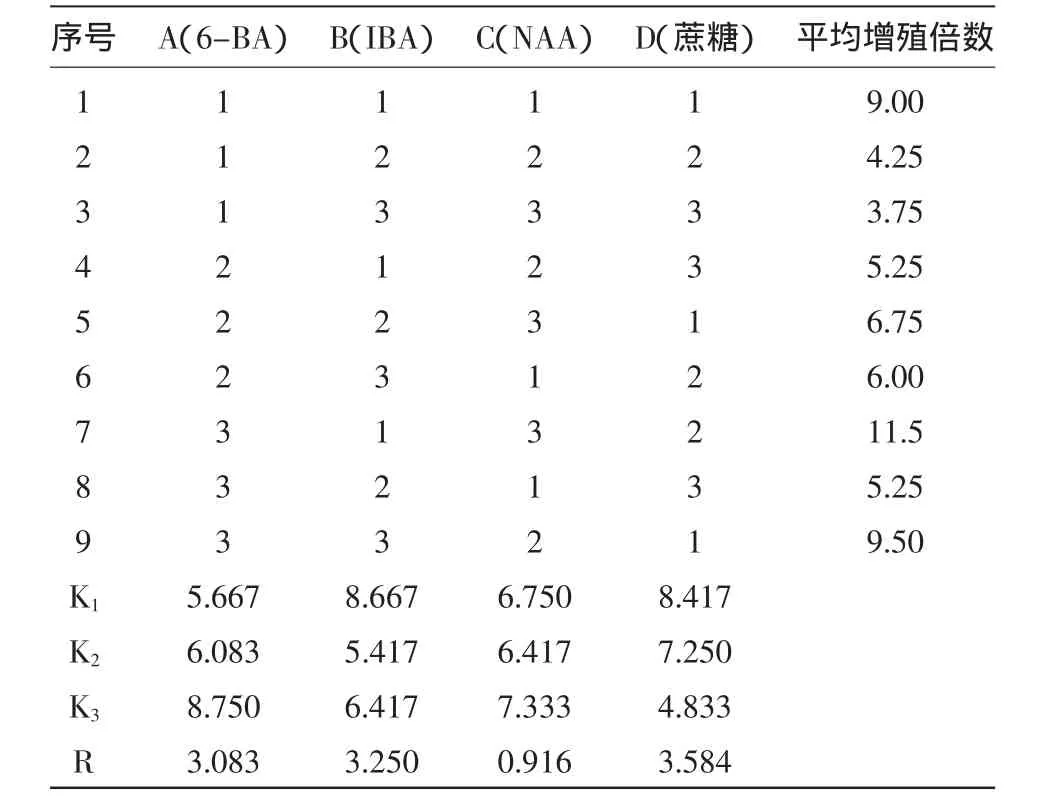
表6 罗汉果茎段增殖正交设计L9(34)实验结果
正交结果分析显示:6-BA K3最大,IBA K1最大,NAA K3最大,蔗糖K1最大,所以最佳培养基配方为A3B1C3D1,即MS+6-BA 0.7mg/L+IBA 0.1 mg/L+NAA 0.01 mg/L+蔗糖 20 g/L+琼脂 5 g/L,pH=5.8(在试验出现的处理中)。
2.2.2 方差分析 在利用SPSS进行正交实验方差分析时,无空白的正交实验需要利用重复实验得到误差,且不能利用实验的平均值作为重复变量,而要用原始数据[4]。在实验中重复4次,误差从重复实验中得到。在α=0.05时,6-BA,IBA和蔗糖对茎段的增殖影响显著(p<0.05),NAA对实验影响不显著(p>0.05),NAA作为实验因子可以忽略。
2.3 生根培养实验结果
按照1.2.4的方法接种1周后,实验结果表明:①号培养基中的茎段长出根,根细而长,生根率达到95%,30 d后生根情况如图1所示。10 d后接种在②、③号培养基的茎段中的根被诱导出来。②号培养基中的根粗而短,30 d后生根情况如图2所示,生根率达到80%。③号培养基中的茎段底部形成的愈伤组织比较小,根细而长并且分支较多,生根率达到85%,30 d后生根情况如图3所示。

3 结论与讨论
在对罗汉果茎段进行扩繁时,应选择继代次数小于8代的继代苗的茎段,有利于组培苗的遗传稳定性,用茎段作为外植体时更有利于组培苗的稳定性。
植物生长调节物质是培养基中关键物质,细胞分裂素6-BA和生长素NAA、IBA对芽的诱导和生长发育起重要作用,其中细胞分裂素是一类较活跃的植物激素,它不仅促进植物细胞的分裂和增大,而且在芽的分化、叶绿体的发育,养分的运输和分配、细胞衰老的抑制等方面都表现显著的效果[7-10];而植物生长素调节植物生长,尤其能刺激茎内细胞纵向生长并抑制根内细胞纵向生长的一类激素,它可影响茎的向光性和背地性生长。
本实验分别对6-BA、IBA、NAA、蔗糖做单因素的水平实验,其中6-BA、IBA、蔗糖对罗汉果茎段的增殖有显著影响,NAA对罗汉果茎段增殖的影响不显著,4因素对罗汉果茎段增殖的影响大小依次是:蔗糖>IBA>6-BA>NAA。与NAA相比,IBA能更好地促进细胞分裂,诱导芽的形成和促进芽的生长。综合各项指标确定最优培养基为:MS+6-BA 0.7mg/L+IBA 0.1mg/L+NAA 0.01mg/L+蔗糖20 g/L+琼脂5 g/L,pH=5.8。本文与付长亮等[5]的罗汉果组织培养结果有差异,可能是由于材料不同和选材时间不同所致。莫长明等[6]利用6-BA和NAA的单一组合作为茎段增殖的标准配方,本研究也发现6-BA和IBA搭配更有利于继代增殖培育。
研究得出最佳生根培养基为:1/2MS+6-BA 0.1 mg/L+NAA 0.1 mg/L+活性碳0.01%+琼脂5%+蔗糖30%,pH=5.8;6-BA和NAA的搭配能更好地诱导生根,生根率达到95%,添加NAA能促进根的分化,7 d后长出根,粗壮且分支多;与没有添加IBA的相比,添加IBA的培养基根数更多,说明IBA能促进生根。
[1] Matsumoto K,Kasai R,Ohtani K.Minor cucurbitane-glycosides from fruits of Siraitia Grosvenori(Cucurbitaceae)[J].Chem Pharm Bull:1990(38):2030-2032.
[2] 戚向阳,陈维军,张俐勤,等.罗汉果皂甙清除自由基及抗脂质过氧化作用的研究[J].中国农业科学,2006,39(2):382-388.
[3] Beru To M,Lanteri L,Porto Gallo.micropropagation of tree peony(Paeonia suff ruticosa)[J].Plant cell,Tissue and Organ culture,2004,(79):249-255.
[4] 夏传涛,袁秉祥.无空列正交实验的设计及SPSS软件的数据处理[J].数理医药学杂志,2006,1(19):91-92.
[5] 付长亮,马小军.罗汉果脱毒苗的快速繁殖研究 [J].中草药,2005,8(36):1225-1229.
[6] 莫长明,白隆华.罗汉果组培苗繁育标准操作规程研究[J].时珍国医国药,2008,9(19):2092-2094.
[7] 王兆龙,曹卫星.细胞分裂素对植物基因表达的调节[J].植物生理学通讯,2000,36(1):82-87.
[8] 鞠 伟,程云燕,张 健.罗汉果研究概况综述[J].广西轻工业,2001,(4):4-6.
[9] 何 康.中国农业百科全书(农作物卷,上)[M].北京:农业出版社,1984.336-337.
[10]林 纬,黎起秦,彭好文,等.罗汉果组培苗种植存在问题及解决措施[J].广西农业科学,2003,(4):74-75.
[11]刘世彪,田启建,江德应,等.罗汉果的人工授粉试验及果实的营养成分分析[J].湖南农业科学,2010,(10):111-113.
[12]陈树帮,林 源,张雨生.南药罗汉果产业资源利用与探讨[J].广东农业科学,2009,(8):373-374.
[13]白先达,赵 洪,唐更生,等.气象条件对罗汉果生长影响的分析[J].江西农业学报,2009,21(7):113-116.
[14]林 荣,王秀琴,王润珍.罗汉果茎段离体培养研究[J].广西植物,1985,5(3):273-277.
