心脏特异表达Calponin 1转基因小鼠的心脏功能分析
2011-02-16王书美张晓娟曹兴水张连峰
王书美,吕 丹,陈 炜,张晓娟,曹兴水,张连峰,2
(1.中国医学科学院实验动物研究所,卫生部人类疾病比较医学重点实验室,北京 100021;2.中国医学科学院实验动物研究所,国家中医药管理局人类疾病动物模型三级实验室,中国医学科学院和北京协和医学院,北京 100021)
Calponin 1(CNN1)基因编码的碱性调宁蛋白(calponin 1,CNN1)是一个首先从鸡砂囊和牛主动脉中分离出的相对分子质量为3.4×104的碱性蛋白[1,2]。它主要在平滑肌细胞中表达,具有很强的组织特异性,结合肌动蛋白,原肌球蛋白,钙调蛋白[1,3,4],抑制肌球蛋白的ATP酶活性[5],在固定化的肌球蛋白抑制Ca2+-依赖的肌动蛋白的移动性[6],诱导肌动蛋白丝的构象改变[7],参与平滑肌收缩。
20世纪90年代,CNN1作为平滑肌分化的标记,研究主要集中在其结合肌动蛋白,抑制肌球蛋白ATP酶(myosin ATPase,简称ATP酶)方面。近年来,发现CNN1可调节肌动蛋白细胞骨架的稳定性,认为CNN1可作为重要的信号转导和整合分子[8]。现在研究也表明CNN1不仅作为平滑肌分化的可靠标记,还可预测肿瘤转移及患者的预后情况。其表达改变与许多疾病的发生、发展密切相关,研究其生化特征及生化分子机制,能为预防和治疗平滑肌疾病及肿瘤,提供理论与实验基础。
在鼠类胚胎发育过程中,在9.5d胚胎的背主动脉,心脏流出管道,管型心脏中可监测到CNN1,随后的发育过程中血管平滑肌组织中CNN1表达上调,而在心脏中的表达下调至检测不到的水平,表明CNN1参与心肌纤维发育,调节胚胎期心脏的收缩[9]。Tan等[10]基因芯片结果中显示心力衰竭患者中CNN1表达比非心力衰竭者下调,本实验也发现cTnTR141W扩张型心肌病模型小鼠心脏中CNN1表达比野生型小鼠降低,推测其对心脏发育及心血管系统可能具有重要的作用。CNN1过表达对心脏会有怎样的影响,对心脏的发育是有利还是不利的,本文因此建立了心脏特异表达CNN1的转基因小鼠,以对其生理功能,特别是对心脏正常发育可能存在的作用进行初步研究。
1 材料和方法
1.1 CNN1表达载体的构建及转基因小鼠的制备
以pBluescriptR-CNN1质粒(Open Biosystems,美国,Clone ID4824832)为模板,用PCR法扩增人CNN1全长cDNA,将扩增片段插入pMD18T载体,经测序并比对正确无突变碱基后,以Sal I(宝生物工程有限公司,中国)酶切回收CNN1片段,并克隆入α-MHC启动子下游构建心脏特异CNN1表达载体。提取并酶切鉴定质粒正确后,用Not I将其线性化,SephedexG50柱纯化DNA片段,获得α-MHC启动的CNN1基因的转基因片段,注射前将转基因片段的浓度调整至5ng/μL,用显微注射法将线性化的转基因表达载体注射到C57BL/6J小鼠的受精卵中(小鼠购自中国医学科学院实验动物研究所,康蓝公司XCXK京2004001),用ICR小鼠作假孕受体(本实验室饲养),制备转基因小鼠(TE2000U显微注射仪)[11]。实验中涉及动物的操作程序已经得到中国医学科学院医学实验动物研究所实验动物使用与管理委员会的批准(GC-08-2035)。
1.2 PCR法鉴定CNN1转基因小鼠的基因型
转基因小鼠在出生9~14d用剪趾法编号,收集剪下的组织,用碱裂解法提取基因组DNA[12],用PCR法对转基因小鼠进行基因型检测。PCR上游引物为:5′AAGGGCGGAACATCATTGGGCT 3′,下游引物为:5′CTCGAAGATCTGCCGCTTGGT 3′(invitrogen)。PCR反应体系20μL(试剂购自宝生物工程有限公司,中国)。反应条件:94℃预变性3min,94℃变性30s,60℃退火30s,72℃延伸30s,30个循环。CNN1目的片段为215bp。
1.3 Western Blot
将小鼠脱颈椎处死后,取100mg心脏组织加入1mL预冷的蛋白裂解液,冰上充分研磨,之后冰上静置30min,再将组织匀浆于4℃,12000r/min离心30min,吸取上清即为心脏组织总蛋白。取50μg蛋白,12%的SDS-PAGE凝胶电泳,将蛋白转移到0.45μm硝酸纤维素NC膜上(Millipore,美国)。将NC膜放入5%脱脂奶粉封闭液,室温下置摇床上封闭1h,再用TBST稀释的兔抗人Calponin 1单克隆抗体(ab46794,Abcam公司,美国)(1∶20000稀释),4℃杂交过夜。次日,TBST洗3次,每次5min。将膜转移到TBST稀释的辣根过氧化物酶标记的羊抗兔抗体(Pierce,美国)(1∶15000),室温杂交1h,采用HRP-GAPDH作为内参(康成生物,中国),TBST洗3次,每次5min。将膜置于化学发光液中,X-ray胶片曝光、显影及定影。
1.4 超声检查CNN1转基因小鼠
选用3月龄的转基因阳性和同窝阴性对照小鼠,用三溴乙醇(0.2mL/10g体重)麻醉,脱去心前区的被毛,选用30Hz的探头,按Zhou[13]报道的方法进行心脏超声影像分析(Vevo770小动物超声探测系统,加拿大)。
1.5 组织学检测
选用6月龄的转基因阳性和同窝阴性对照小鼠,颈椎脱臼法牺牲小鼠,打开胸腔取出心脏,将心脏组织固定在中性福尔马林中24h,进行脱水、包埋、切片、HE染色和Masson染色。
1.6 统计学分析
数据SPSS统计软件处理。先进行数据的方差齐性检验,组间比较采用独立性t检验。计量数据用均数±标准差(±s)表示。
2 结果
2.1 CNN1基因在小鼠心脏组织中的表达
分别提取新生、14d,30d,90d的野生型小鼠,3月龄cTnTR141W和cTnTR92Q转基因小鼠[14,15]的心脏组织总蛋白,用Calponin 1单克隆抗体进行Western Blot分析,结果CNN1在不同年龄的野生型小鼠心脏中均有表达,且表达随小鼠年龄的增长略有下调(图1A),同时发现CNN1在扩张型心肌病模型小鼠心脏中表达降低,肥厚型心肌病模型小鼠心脏中表达升高(图1B)。
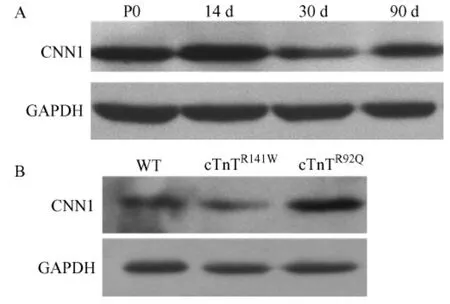
图1 CNN1基因在小鼠心脏组织中的表达Fig.1 Expressions of CNN1 gene in the heart tissues

图2 CNN1转基因小鼠的建立Fig.2 Generation of CNN1 transgenic mice
2.2 CNN1转基因小鼠的建立
用PCR法克隆人CNN1基因,测序结果显示克隆的cDNA同已报道的CNN1序列完全一致(GenBank No.NM_001299.4),将CNN1基因插入心脏特异表达的α-MHC启动子下游,构建α-MHCCNN1转基因表达载体(图2A)。用显微注射法将线性化的转基因表达载体注射到C57BL/6J小鼠的受精卵中,转入受体假孕ICR小鼠中,小鼠出生14d提取基因组DNA,用PCR扩增CNN1基因215bp目的片段,鉴定CNN1转基因小鼠的基因型(图2B),共得到4只首建鼠,且均可传代。分别提取CNN1首建鼠的F1代阳性转基因小鼠和同龄阴性对照小鼠心脏组织总蛋白,用CNN1单克隆抗体进行Western Blot分析,结果显示5号及6号首建鼠心脏组织内CNN1蛋白表达量明显高于同龄阴性对照小鼠(图2C)。
2.3 超声检查CNN1转基因小鼠的心脏几何构型及心功能
将3月龄的CNN1转基因小鼠和同窝阴性对照小鼠进行心脏超声影像分析(表1,图3),结果显示,CNN1转基因小鼠收缩期左室内径(LVID,systolic)增加28%(P<0.01,n=12),舒张期左室内径(LVID,diastolic)增加16.2%(P<0.01,n=12),收缩期左室后壁厚度(LVPW,systolic)减小15.7%(P<0.01,n=12),舒张期左室后壁厚度(LVPW,diastolic)减小21%(P<0.01,n=12),射血分数EF(ejection fraction)降低11.5%(P<0.01,n=12),短轴缩短率FS(fraction shortening)降低14.6%(P<0.05,n=12)。

表1 3月龄CNN1转基因小鼠心脏结构和功能M型超声分析(n=12)Tab.1 The cardiac structure and function analysis of 3-month transgenic mice by M-mode echocardiograph(n=12)
2.4 CNN1转基因小鼠心脏病理检查
将6月龄CNN1转基因小鼠和同窝阴性对照小鼠的心脏进行病理解剖,并进行HE染色和Masson染色。HE染色可见CNN1转基因小鼠心脏全心扩大,心脏室壁明显变薄,心腔变大(图4A,B),高倍镜下可见心肌细胞不均匀肥大,细胞间隙变大(图4C,D),Masson染色可见CNN1转基因小鼠心脏心肌间质纤维明显增多(图4E,F)。(图见封3)
3 讨论
Calponins是肌动蛋白结合蛋白家族,在脊椎动物细胞中广泛表达。按其等电点(isoelectric point,pI)分为碱性调宁蛋白(h1 calponin,CNN1,pI 8~10),中性调宁蛋白(h2 calponin,h2CaP,pI 7~8),酸性调宁蛋白(h3 calponin,h3CaP,pI 5~6)[16]。这3个成员的前273个氨基酸残基具有很高的同源性(>70%),都是由单一CH结构域(calponin homologydomain)和29个氨基酸残基组成的CLR(calponin-like repeat)三拷贝串联重复序列组成。但它们的羧基末端序列有较大的差异[17]。碱性调宁蛋白大多表达于终末分化和非增殖性的平滑肌细胞中,其在平滑肌组织中的含量与原肌球蛋白(tropomyosin)相似,为肌动蛋白的1/7。中性调宁蛋白主要分布于心肌组织中。酸性调宁蛋白是一种无组织表达特异性的变异体,其在脑组织中含量最丰富。
本文利用Western Blot检测了CNN1在野生型小鼠心脏中的时程表达,出生后的小鼠心脏中均检测到了CNN1的表达,并发现CNN1在cTnTR141W扩张型心肌病小鼠模型中的表达比野生型小鼠低,推测其对心脏发育及心血管系统可能具有重要的作用。
本文中,首建鼠Founder 5和Founder 6的后代小鼠PCR检测结果显示外源基因能稳定地传递到下代。Western Blot结果显示,CNN1在5号和6号首建鼠心脏组织中与野生型小鼠相比有较高表达,表明成功建立了心脏特异表达的α-MHC-CNN1转基因小鼠。
我们建立的心脏特异表达CNN1的转基因小鼠的心脏超声影像分析结果显示,与野生型小鼠心脏相比,收缩期和舒张期左室内径增加,收缩期和舒张期左室后壁厚度变薄,射血分数和短轴缩短率降低。心脏组织病理观察结果显示,CNN1转基因小鼠心脏全心扩大,心脏室壁明显变薄,心腔变大,高倍镜下可见CNN1转基因小鼠心肌细胞不均匀肥大,细胞间隙变大,心肌间质纤维明显增多。

图3 CNN1转基因小鼠M型超声分析截图Fig.3 Analysis of the mouse heart by echocardiography
目前,关于心脏特异表达CNN1的转基因小鼠尚未见报道,本文成功建立了心脏特异表达的α-MHC-CNN1转基因小鼠,实验发现,CNN1过表达可使心脏发生心腔增大,室壁变薄,心脏收缩功能减弱等改变,此转基因小鼠的建立为进一步研究CNN1对心脏正常发育,以及对CNN1在心脏发育和心肌病的发生过程中的生物学功能及可能的机制加以研究,提供了有价值的模型动物。
[1]Takahashi K,Hiwada K,Kokubu T.Isolation and characterization of a 34,000-dalton calmodulin-and Factinbinding protein from chicken gizzard smooth muscle[J].Biochem Biophys Res Commun,1986,141:20-26.
[2]Takahashi K,Nadal-Ginard B.Molecular cloning and sequence analysis of smooth muscle calponin[J].J Biol Chem,1991,266:13284-13288.
[3]Childs TJ,Watson MH,NovyRE,etal.Calponin and tropomyosin interactions[J].BiochemBiophys Acta,1992,1121:41-46.
[4]Graceffa P.Evidence for interaction between smooth muscle tropomyosin and caldesmon[J].FEBS Lett,1987,218:139-142.
[5]Winder SJ,Walsh MP.Calponin:thin filament-linked regulation of smooth muscle contraction[J].Cell Signal,1993,5:677-686.
[6]Shirinsky VP,Biryukov KG,Hettasch JM,et al.Inhibition of the relative movement of actin and myosin by caldesmon and calponin[J].J Biol Chem,1992,267:15886-15892.
[7]Noda S,Ito M,Watanabe S,et al.Conformational changes of actin induced by calponin[J].Biochem Biophys Res Commun,1992,185:481-487.
[8]Kathleen GM,Samudra SG.Signaltransduction in smooth muscle:cross-bridge regulation by thin filament-associated proteins[J].J Appl Physiol,2001,91:953-962.
[9]Miano JM,Olson EN.Expression of the smooth muscle cell calponin gene marks the early cardiac and smooth muscle cell lineages during mouse embryogenesis[J].J Biol Chem,1996,271:7095-7103.
[10]Tan FL,Moravec CS,Li JB,et al.The gene expression fingerprint of human heart failure[J].PNAS,2002,99:11387-11392.
[11]Gordan JW,Ruddle FH.Integration and stable germline transmission of genes injected intomousepronuclei[J].Science,1981,214(4526):1244-1246.
[12]Truett GE,Heeger P,Mynatt RL,et al.Preparation of PCR-quality mouse genomic DNA with hot sodium hydroxide and tris(HotSHOT)[J].Biotechniques,2000,29(1):52-54
[13]Zhou YQ,Foster FS,Brian JN,etal.Comprehensive transthoracic cardiac imaging in mice using ultrasound biomicroscopy with anatomical confirmation by magnetic resonance imaging[J].Physiol Genomics,2004,18:232-244.
[14]冯娟,董伟,全雄志,等.cTnTR141W转基因小鼠扩张型心肌病模型的建立[J].中国比较医学杂志,2007,17(10):563-567.
[15]董伟,冯娟,全雄志,等.cTnTR92Q转基因小鼠肥厚型心肌病模型的建立[J].中国比较医学杂志,2008,18(5):5-8.
[16]Danninger C,GimonaM.LivedynamicsofGFP-calponin:isoform-specific modulation of the actin cytoskeleton and autoregulation by C-terminal sequences[J].J Cell Sci,2000,113:3725-3736.
[17]Gimona M and Mital R.The single CH domain of calponin is neither sufficient nor necessary for F-actin binding[J].J Cell Sci,1998,111:1813-1821.
