密度感应拮抗剂C-30对变异链球菌生物膜的影响
2011-02-05何智妍黄正蔚
何智妍,黄正蔚
(上海交通大学医学院附属第九人民医院牙体牙髓病科,上海市口腔医学研究所,上海市口腔医学重点实验室,上海200011)
牙菌斑生物膜是人类龋病和牙周病的主要致病因素,也是目前口腔微生物学和生态学研究的热点。变异链球菌是龋病公认的主要致病菌,可在牙齿表面黏附和聚集,形成复杂的致龋性生物膜。细菌从浮游状态到结成细菌生物膜,经历了从低密度到高密度、从无组织状态到有组织状态的过程,其生物学性状也发生了很大改变。在细菌完成表面附着后,细菌间密度感应调控机制(quorum sensing)在生物膜的成熟和分化过程中发挥了重要的作用。密度感应调控机制是指微生物通过化学信号分子进行信息传递的一种形式,以微生物的群体密度为依据控制特定基因的表达,调节着细菌群体的许多生理功能[1-3]。因此,抑制细菌间密度感应效应可能成为控制生物膜相关感染的新靶点,而最直接的抑制方法之一就是使用密度感应拮抗剂。最早人们发现海洋红藻生物D.pulchra自身能通过产生与密度感应受体AHL结构相似的卤代呋喃(图1a),与AHL受体结合后能抑制细菌的密度感应调控,从而保护自己不被细菌感染。之后,人们又发现该卤代呋喃化合物能抑制病原体Serratia liquefaciens在固体培养基上的运动性,也能抑制S.liquefaciens质粒荧光基因的表达(不影响细菌生长),而且该化合物还能抑制致病菌V.harveyi产生细胞外毒素[4-6]。卤代呋喃C-30具有与D.pulchra呋喃有相似的结构式(图1b、c),也是一种密度感应拮抗剂,能有效抑制细菌生物膜形成的密度感应调控机制。本研究旨在观察密度感应拮抗剂呋喃C-30对变异链球菌生物膜形成的影响,为开辟新的防龋途径提供参考。
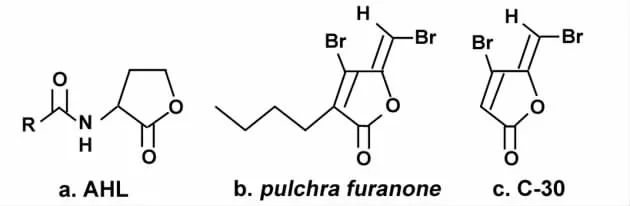
图1 AHL、D.pulchra呋喃和卤代呋喃C-30的结构式
1 材料和方法
1.1 主要材料和仪器
变异链球菌UA159(上海交通大学医学院附属第九人民医院口腔微生物研究室);牛心脑浸液培养基(brain heart infusion,BHI,Difco公司,美国);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑嗅盐(MTT,Sigma,美国);十二烷基硫酸钠(SDS);二甲基甲酰胺(DMF,上海生工生物工程有限公司);呋喃C-30(根据参考文献[7]自行合成,合成路线如图2所示,溶于二甲亚砜中,浓度100 μg/mL);激光共聚焦显微镜(Leica TCS SP2,德国);全自动酶标仪(Bio-Tek Elx800,美国);分光光度计(岛津UV1601,日本)。

图2 呋喃C-30的合成路线
1.2 呋喃C-30对浮游状态变异链球菌生长的影响
变异链球菌(UA159)接种于牛心脑浸液培养基(BHI),37℃培养过夜后,制备菌悬液,并调细菌密度为2×109CFU/mL,取新鲜菌悬液20 μL加入到盛有3 mL BHI培养基试管中,在37℃微需氧培养2 h后,加入已合成的密度感应拮抗剂呋喃C-30,并使其终浓度为2.0 μg/mL。另设不加呋喃C-30只含菌液和BHI培养基的试管作为空白对照,在37℃微需氧环镜下继续培养24 h,分别于培养后4、14和24 h用分光光度计检测各组菌液的OD600。实验设计3次平行重复,取均值。
1.3 呋喃C-30对变异链球菌形成生物膜的影响
1.3.1 MTT法检测各组生物膜中的菌量
变异链球菌(UA159)接种于牛心脑浸液培养基(BHI),37℃培养过夜,制备细菌密度为2×109CFU/mL菌悬液,并将其接种于96孔板(每孔新鲜菌悬液20 μL,BHI培养基180 μL),37℃微需氧培养2 h后,随机分为两个实验组和一个空白对照组,每组复3孔,同时设置调零孔。两实验组加入呋喃C-30,并使其终浓度分别为2.0、4.0 μg/mL,空白对照组不加呋喃C-30,再在37℃微需氧环境下继续培养24 h。确定形成生物膜后,吸去上清液,用无菌PBS溶液冲洗3次,以去除表面的浮游细菌。然后在每孔中加入 50 μL MTT溶液(5 mg/mL,溶解于无菌PBS缓冲液),37℃暗箱孵育3 h,在这期间,活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲瓒并沉积在细胞中。之后吸去MTT溶液,每孔内加入100 μL三联溶液(体积比10%的十二烷基硫酸钠和体积比50%的二甲基甲酰胺溶于双蒸水),溶解胞内的甲瓒结晶,再在37℃暗箱中孵育3 h后,用全自动酶标仪检测每孔的OD600。实验设计3次平行重复,取平均值。
1.3.2 激光共聚焦显微镜(CLSM)检测各组生物膜中死活菌比例
取细菌密度为2×109CFU/mL的新鲜菌悬液接种于预置有直径15 mm无菌盖玻片的12孔板(每孔菌液200 μL,BHI培养基1 800 μL),37℃微需氧培养2 h后,随机分为两个实验组和一个空白对照组,每组复3孔,同时设置调零孔。两实验组加入呋喃 C-30,并使终浓度分别为 2.0、4.0 μg/mL,空白对照组不加呋喃C-30,再在37℃微需氧环境下继续培养24 h。确定形成生物膜后,吸去上清液,用无菌PBS溶液冲洗3次,以去除表面的浮游细菌,按照死菌、活菌荧光染色试剂盒(LIVE/DEAD BacLightBacterialViability Kits 7012,Molecular Probes,美国)说明进行染色,每一标本生物膜表面滴加200 μL荧光染液,室温下避光孵育15 min后,激光共聚焦显微镜(CLSM)下观察。
1.4 统计学分析
用SPSS 17.0软件进行统计分析,不同浓度呋喃C-30对生物膜形成量的总体均数之间的比较用单因素方差分析,两两比较采用q检验,检验水准α=0.05。
2 结果
2.1 呋喃C-30对浮游状态变异链球菌生长的影响
无论是含2.0 μg/mL呋喃C-30的实验组还是空白对照组,细菌生长量均随培养时间增加而增加,且各时间点之间两两比较均有显著性差异(P<0.05);而在相同培养时间点内,实验组与对照组相比,差异均无统计学意义(P>0.05)(图3)。提示2.0 μg/mL呋喃C-30对浮游态变异链球菌的生长无显著影响。
2.2 呋喃C-30对变异链球菌形成生物膜的影响
变异链球菌在不同浓度呋喃C-30作用下所形成的生物膜的菌量(OD600),与空白对照组相比,2.0 μg/mL和4.0 μg/mL的呋喃C-30均能明显减少生物膜中的菌量,当加入浓度2.0 μg/mL的呋喃C-30后,生物膜中的菌量明显降低,其OD600差值为0.219,而4.0 μg/mL的呋喃C-30组中生物膜菌量的减少幅度最大,为0.316。各组间两两比较差异均有统计学意义(P<0.05)(图4)。

图3 2.0 μg/mL呋喃C-30对浮游变异链球菌生长的影响

图4 各组生物膜中菌量的比较
2.3 呋喃C-30对生物膜中死活菌比例和结构的影响
在不同浓度的呋喃C-30作用后,变异链球菌24 h生物膜激光共聚焦荧光图像中,由于活菌的数量远远大于死菌,绿色荧光的强度远远高于红色荧光的强度;所以同一视野叠加后,仍均呈绿色荧光。在对照组的共聚焦荧光图像中,变异链球菌中活菌数量很多,而且细菌间相互集聚成团,结构相对较致密(图5-1c)。随着呋喃C-30浓度的增加,变异链球菌的数量明显减少,细菌间的集聚程度也开始减轻,细菌间的结构逐渐稀疏(图5-2c,5-3c)。同时,通过红绿色荧光强度的比较,发现对照组和各组实验活菌量占总菌量的比值分别为77.91%,78.22%和73.63%,差异均无统计学意义(P>0.05)。

图5 不同浓度呋喃C-30处理变异链球菌生物膜的CLSM图像
3 讨论
龋病的主要致病因素是由致龋细菌构成的致龋性生物膜(牙菌斑),生物膜内的细菌在空间分布、形态结构、生理、代谢、对底物的降解或利用和对环境的抵抗能力等生物学特性都发生了改变,其毒力大增并对各类抗生素作用的敏感度下降,对恶劣环境和宿主免疫防御机制有很强的抗性、耐药性[8-9]。因此,需要研发新的策略控制牙菌斑生物膜的感染。
变异链球菌从浮游的生长状态到形成生物膜,涉及到多种相互交错的信号转导通路来协调细菌间的生理活动,以趋利避害。目前研究较多的是密度感应系统,是细菌根据细胞密度变化进行基因表达调控的一种生理行为,具有群体感应的细菌能产生并释放称为自体诱导物(Autoinducer)的信号分子,它随着细胞密度的增加而增加,当积累到一定阈值时可与专一性受体结合从而启动细菌中特定基因的表达[10]。细菌细胞通过群体感应信号分子与周围环境进行信息交流,从而改变其生理活性,如共生、细菌毒性、运动性、孢子和生物膜的形成等,所以,抑制细菌密度感应被认为是一种新的抗感染策略,主要包括抑制信号分子的合成、密度感应拮抗剂的应用、密度感应信号失活化学剂的应用、密度感应淬灭酶的应用等等方法来抑制微生物的密度感应调控。其中最常用的方法之一就是使用密度感应拮抗剂,其作用机制是:依靠与密度感应信号分子在结构上的相似性,与密度感应受体相结合,从而竞争性抑制密度感应的调控过程,最常用的密度感应拮抗剂是天然或合成的卤代呋喃。
本文主要研究密度感应拮抗剂呋喃C-30对变异链球菌UA159生物膜形成的影响,结果显示所选浓度(2.0 μg/mL)的拮抗剂对变异链球菌的生长不产生影响,但对变异链球菌生物膜的形成有显著的抑制作用,而且随着拮抗剂浓度的增加,生物膜的抑制程度也随之增加,表明拮抗剂并不是通过杀菌或者抑制细菌的生长来抑制生物膜的形成。这一作用在对其他微生物的研究中也多有报道,如Louise D、Christensen等[11](2007)研究中发现该卤代呋喃C-30化合物对铜绿假单胞菌的缺陷株和野生株形成的生物膜存在着抑制作用,而且缺陷株受该化合物的抑制作用更加明显;Lönn-Stensrud J等[12]同样证实该化合物能有效抑制咽峡链球菌、中间链球菌等口腔链球菌生物膜的形成。
本研究通过激光共聚焦显微镜的观察也发现生物膜的结构也受到呋喃C-30的影响。随着拮抗剂浓度的增加,生物膜中细菌堆积明显降低,细菌间的结构也变得稀疏,但是生物膜内活菌占总菌量的比值不存在显著性差异;结果都证实呋喃C-30可有效抑制变异链球菌UA159生物膜形成,可能是通过使用密度感应拮抗剂抑制密度感应调控系统。其具体作用机制仍有待进一步的研究。
[1] Boyen F,V Eeckhaut,F Van Immerseel,et al.Quorum sensing in veterinary pathogens:mechanisms,clinical importance and future perspectives[J].Vet.Microbiol,2009,135(3-4): 187-195.
[2] Czárán T,Hoekstra RF.Microbial communication,cooperation and cheating:Quorum sensing drives the evolution of cooperation in bacteria[J].PLoS ONE,2009,4(8):6655.
[3] Suntharalingam P,Cvitkovitch DG.Quorum sensing in streptococcal biofilm formation[J].Trends Microbiol,2005,13(1): 3-6.
[4] Defoirdt T,Boon N,Bossier P,et al.Can bacteria evolve resistance to quorum sensing disruption?[J].PLoS Pathog,2010,6 (7):1000989.
[5] Czajkowski R,Jafra S.Quenching of acyl-homoserine lactonedependent quorum sensing by enzymatic disruption of signal molecules[J].Acta Biochimica Polonica,2009,56(1):1-16.
[6] Zhang LH.Quorum quenching and proactive host defense[J].Trends Plant Sci,2003,8(5):238-244.
[7] Manny AJ,Kjelleberg S,Kumar N,et al.Reinvestigation of the sulfuric acid-catalysed cyclisation of brominated 2-alkyllevulinic acids to 3-alkyl-5-methylene-2(5H)-furanones[J].Tetrahedron,1997,53(46):15813-15826.
[8] Padera RF.Infection in ventricular assist devices:the role of biofilm[J].Cardiovasc Pathol,2006,15(5):264-270.
[9] Lindsay D,Von Holey A.Bacterial biofilms within the clinical setting:what healthcare professionals should know[J].J Hosp Infect,2006,64(4):313-325.
[10] West SA,Griffin AS,Gardner A,et al.Social evolution theory for microorganisms[J].Nat Rev Microbiol,2006,4(8): 597-607.
[11] Christensen LD,Moser C,Jensen PO,et al.The impact of Pseudomonas aeruginosa quorum sensing on biofilm persistence in an in vivo intraperitoneal foreign-body infection model[J].Microbiol,2007,153(7):2312-2320.
[12] Lönn-Stensrud J,Petersen FC,Benneche T,et al.Synthetic bromated furanone inhibits autoinducer-2-mediated communication and biofilm formation in oral streptococci[J].Oral Microbiol Immunol,2007,22(5):340-346.
