海藻糖对植物糖代谢的调控及糖感受的介导
2011-01-26罗玉
罗 玉
(昆明学院生物科学与技术系,云南昆明650214)
海藻糖(а-D吡喃葡萄糖,а-D-吡喃型葡萄糖苷)是由两个葡萄糖分子组成的双糖,海藻糖是昆虫中的血糖,是真菌中的贮藏碳水化合物,在细菌、酵母和动物中普遍存在。海藻糖结构缺乏诱导端,使海藻糖对热、PH等不敏感。海藻糖对酸、碱、高温的稳定性强,吸水性强,使它在生物体内具有很强的抗脱水作用[1],在干旱、寒冷、高盐碱等逆境条件下可保护生物膜、蛋白质等免受伤害[2-3]。海藻糖在作物抗逆育种中有广阔的应用前景。海藻糖是一种结构稳定的非还原性双糖,自身不与氨基酸或蛋白质等发生作用,具有明显的化学惰性和极强的稳定性。海藻糖常被用作稳定剂、防腐保鲜剂,成为食品、化妆品、药品中的添加剂。近年来,在高等植物中也发现了海藻糖的存在,植物中的海藻糖还参与代谢调控和基因表达调控,影响着植物生长、发育及对外界环境变化的反应[4-6]。海藻糖是一种典型的应激代谢与保护物质:当生物体生长环境良好时,体内不积累海藻糖;而当生物体处于胁迫环境时,体内就会迅速积累海藻糖[7-8]。海藻糖合成、分解及其调控中蕴含着生物生长发育、生物抗逆、生物对极端环境适应的重要机制,海藻糖作为一种新发现的信号分子[9],弄清它的感知传导途径,与已知的糖信号之间的交叉反应,将极大的推进海藻糖在各领域中的应用。
1 海藻糖的代谢
海藻糖和蔗糖都是双糖,它们在代谢上也很相似,见图1。
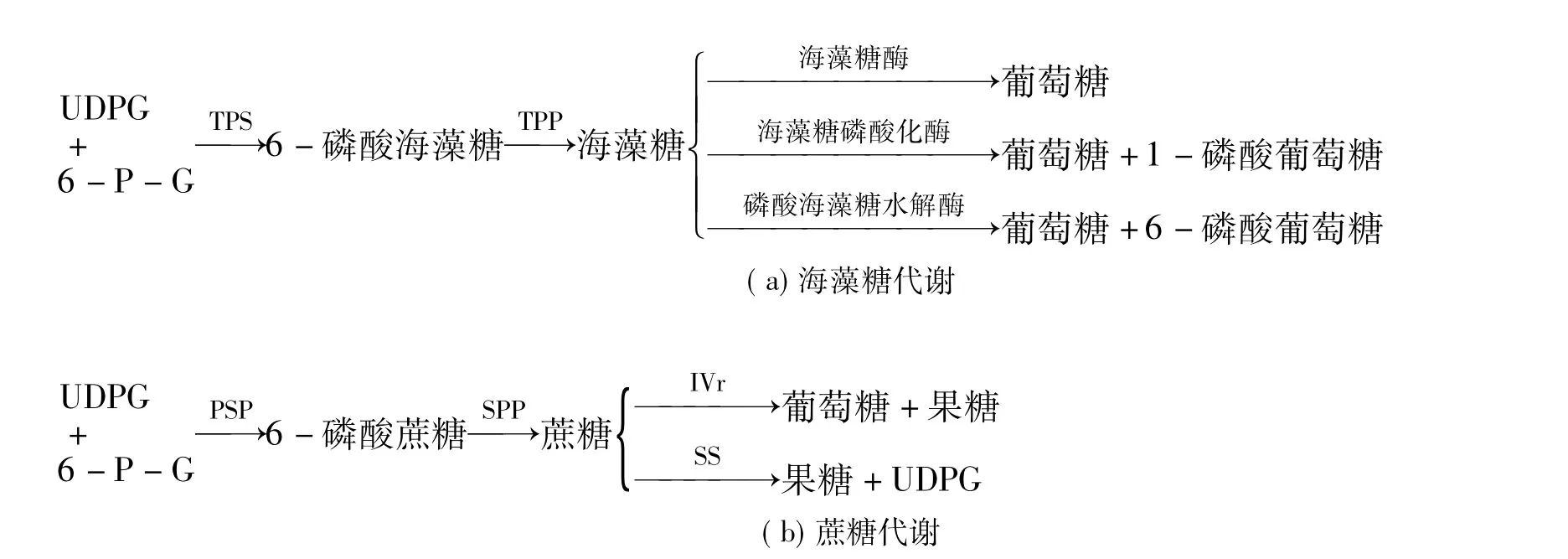
图1 两种双糖代谢途径图
UDPG和6-磷酸葡萄糖在TPS的作用下生成6-磷酸海藻糖,6-磷酸海藻糖在TPP作用下生成海藻糖。在大肠杆菌中,TPS和TPP分别由OtsA和OtsB基因编码。在酵母菌中,海藻糖合成复合物包含三个亚单位,分别由TPS1,TPS2,TSL1基因编码。其中TPS2编码TPP蛋白,TSL1是编码一个调节亚基。TSL1有一个同源基因TPS3[10],TPS1基因编码的蛋白具有完整的6-磷酸海藻糖合成酶活性。三个蛋白基因都含有GAAN/YTTC和C4T热休克元件,热诱导能提高酶活性。海藻糖的分解有多个途径,在酵母中被海藻糖磷酸化酶分解为葡萄糖和1磷酸葡萄糖[11]。在大肠肝菌中,海藻糖被磷酸化之后,又被6-磷酸海藻糖水解酶水解成葡萄糖与6-磷酸葡萄糖[12]。在生物界中,无论植物、真菌、动物还是细菌中多由海藻糖酶分解为葡萄糖[13-14]。
TPS1除直接参与海藻糖合成外,还参与对糖酵解途径的调节。原因之一是TPS1的产物6-磷酸海藻糖具有抑制己糖激酶的作用[10]。这一结果暗示在生物体遭遇环境胁迫而启动海藻糖途径后,葡萄糖进入糖酵解的途径也可被有效限制。TPS1基因编码的蛋白还起稳定海藻糖合酶复合体的作用。TPS1基因的缺失也使6-磷酸海藻糖磷酸酯酶活性大大降低,并导致海藻糖合酶复合体解体。TPS2基因编码的蛋白具有6-磷酸海藻糖磷酸酯酶活性,6-磷酸海藻糖磷酸酯酶的功能是催化6-磷酸海藻糖脱磷酸化形成海藻糖。植物中的与酵母TPS1和大肠肝菌OtSA同源的所有基因,都有一个约400氨基酸的C端结构域。植物中的这个结构域与酵母TPS2基因和大肠肝菌的OtSB基因有相当大的同源性。可能除了N端的合成酶活性外,在C端还有磷酸酶活性区域[15]。这有些类似于酵母中的TPS2基因,TPS2相当于一个双功能蛋白质基因,虽然带有一个N端TPS区域,但它不能像TPS1那样有合成6-磷酸海藻糖的作用,而是编码合成TPP[10]。
TPS是个多基因家族,到2001年已克隆的拟南芥TPS基因家族成员有11个[16]。从拟南芥中克隆到了酵母 TPS1、TPS2同源的基因,它们能弥补TPS1和 TPS2的不足[17]。从拟南芥中得到三个基因:AtTPSA、AtTPSD、AtTPSC,它们编码的蛋白质与TPS和TPP有很大程度的同源性。在缺少TPS活性的tps1突变体中表达AtTPSA和AtTPSC时,在供给葡萄糖或热冲击之后也不能补充海藻糖的形成。此外,AtTPSA和AtTPSC在缺乏TPP活性的酿酒酵母tps2突变体中也不能补充TPP的作用。因此,得出与TPS/TPP同源的拟南芥基因编码的蛋白质,在海藻糖合成中缺乏催化活性[18]。来源于鳞叶卷柏的编码TPS的cDNA,使得酿酒酵母的tps1突变体恢复生长[19]。
海藻糖的合成与分解不仅存在于低等生物中,在高等植物中也存在。使用了海藻糖酶的抑制剂——有效酶素A,发现转基因植物和野生型植物中海藻糖的积累增加[20],这说明,高等植物中存在有内源的海藻糖代谢途径。高等植物中不仅有海藻糖代谢存在,也有海藻糖酶存在,海藻糖酶的发现还先于植物中海藻糖代谢。早在1969年,从幼嫩甘蔗中发现了海藻糖酶。类似相继的报道,说明海藻糖酶在许多高等植物中存在。已从马铃薯和大豆中克隆到了海藻糖酶cDNA[21]。海藻糖酶在植物中很常见,海藻糖酶能被有效霉素A高效抑制其活性。内源海藻糖在高等植物中合成量很少,野生型植株在有海藻糖酶抑制剂有效酶素A存在下,只积累少量的海藻糖,少于植株鲜重的0.01%[20]。
2 海藻糖与植物糖代谢和糖调控
蔗糖和海藻糖不仅代谢途径类似,它们都有信号分子作用。海藻糖能代替蔗糖,调控碳水化合物的代谢。但海藻糖在高等植物中不像蔗糖那样常见,海藻糖发现较晚,海藻糖的进化起源可能更早。
2.1 海藻糖影响植物光合作用,影响植物生长。
植物通过光合作用合成糖分,糖分是植物的碳源和能源物质,海藻糖能影响碳代谢,影响植物生长。高浓度的海藻糖可以抑制植物正常的生长和发育。在培养基中添加外源的海藻糖,能明显抑制拟南芥幼苗根尖的伸长,外源的海藻糖强烈诱导淀粉合成基因APL3的表达,导致子叶中淀粉积累过多,分配到根中的碳水化合物少,从而抑制根的伸长[9]。也有分析认为:海藻糖抑制拟南芥幼苗生长是由于6-磷酸海藻糖积累的缘故。在加海藻糖培养基上生长的拟南芥植株会迅速积累6-磷酸海藻糖,抑制生长,而相同培养基上生长的转磷酸海藻糖水解酶基因的拟南芥植株,生长发育正常。在培养基中添加可代谢糖,可缓解6-磷酸海藻糖积累对生长的抑制[4]。突变体的研究发现拟南芥海藻糖合成酶基因AtTPS1是植株由营养生长转入生殖生长所必需的,Tps1突变体不能发育出成熟种子[5]。
把大肠肝菌的6-磷酸海藻糖合成酶基因OtsA转入烟草中,转基因植株与野生型相比,海藻糖合成增加了,并在表型上产生一些变化,植株变小,叶被针形,叶变薄,叶色变得暗绿,并且衰老加快[22]。酵母TPS1基因转入烟草中,转基因植物叶和根中积累了低水平海藻糖。转基因植物在转录水平上控制Rabisco酶N亚基的启动子,使得转基因植株的生长明显地被阻碍了[23]。单一转化大肠杆菌的TPS基因和TPP基因,或者两者同时转化的植株表型都会变化。但是在水稻中转入TPS和TPP的融合体。表达的融合体酶有高效专一的催化效率,使该实验成为引人瞩目的高效合成海藻糖的方法;它还有一个优点降低了6-磷酸海藻糖的含量。在这个实验中转化植株产生了高水平的海藻糖,但是没有引起生长受阻和明显的表型变化[24]。
2.2 海藻糖与糖代谢途径有相互作用
海藻糖不仅介入贮藏碳水化合物(淀粉、果聚糖)的合成调控[25],而且还作用在单糖的互变和酵解上[10]。海藻糖调节着糖代谢的途径。海藻糖代谢的基因调节与糖信号途径的相互作用,能增强光合能力[26]。蔗糖的添加促进大豆根中蔗糖的合成。在加海藻糖和有效酶素A时,也刺激蔗糖的合成。而添加葡萄糖时,却没有这种促进作用[27]。
酵母TPS1有控制糖酵解糖流的作用,研究发现6-磷酸海藻糖对己糖激酶有抑制作用,6-磷酸海藻糖与流进入糖酵解的糖流量有强烈的相关性[28]。6-磷酸海藻糖能调控糖代谢[29],但它不只限于控制己糖激酶活性这个方式[16]。6-磷酸海藻糖是酵母己糖激酶HXK2的有效抑制剂,但不能抑制拟南芥AtHXK1和AtHXK2[30]。拟南芥胚芽成熟的研究中发现,TPS1是拟南芥胚芽成熟所必须。Tps1突变体胚芽形态发育正常,但发育滞缓。在细胞膨大时,蔗糖水平会快速增长。在离体培养中,通过降低蔗糖水平,可以部分使tps1胚芽回复正常,但6-磷酸海藻糖不是AtHXK1或AtHXK2表达的抑制剂,也不降低己糖激酶活性。表明海藻糖代谢中的酶是植物胚芽发育的糖代谢所必须的。它不是通过己糖激酶的方式进行调控的[31]。
2.3 海藻糖与蔗糖感受机制
海藻糖不仅代谢上类似于蔗糖,在糖感受机制上也很类似于蔗糖。海藻糖代谢与植物中的糖感受机制有关[32]。植物中的糖感受可分为依赖于己糖激酶的感受和不依赖于己糖激酶的感受,不依赖己糖激酶的感受又包括蔗糖信号感受。在大麦的果聚糖合成过程中,果聚糖6-果糖基转移酶(6-SFT)是一个关键酶,能被碳水化合物强烈调控。用不同碳水化合物补充给叶片切段培养,并测定6-SFT酶活性及果聚糖含量,发现蔗糖处理时,酶活性及果聚糖含量都是最高的,蔗糖既是底物又是酶激活剂,海藻糖对酶活性的作用仅次于蔗糖处理,但果聚糖积累少。果糖和葡萄糖也能刺激6-SFT酶活性,但作用大大低于蔗糖与海藻糖。用能被己糖激酶磷酸化但不进入代谢的甘露糖或2-脱氧葡萄糖处理时,对果聚糖合成不起刺激作用,但用甘露糖加海藻糖时,强烈刺激了果聚糖和淀粉的合成。表明糖对大麦果聚糖合成调节是不依赖己糖激酶的,可能是以蔗糖的感受为基础。海藻糖在许多方面与蔗糖相似,海藻糖能代替蔗糖调节6-SFT活性。海藻糖能被海藻糖酶分解成葡萄糖,有效霉素A是海藻糖酶的有效抑制剂,在加与不加有效霉素A的情况下,海藻糖调节6-SFT的活性几乎无差别。也说明是海藻糖而不是海藻糖的分解物葡萄糖在调节6-SFT活性[25]。蔗糖和海藻糖在糖感受调控基因表达中有相似的作用,而海藻糖酶抑制剂比转化酶抑制剂易得到。在研究糖介导基因表达中,海藻糖可成为了一个很有用的工具。
2.4 海藻糖与蔗糖代谢酶调节
植物中的海藻糖与蔗糖相似,还表现在各自代谢的酶的活性调节上。糖产生的信号通常要进入信号转导的级联放大途径,由蛋白激酶、蛋白磷酸酶、钙调蛋白等的介入调控多种酶的活性,从而导致了植物的多种反应。SnRK是植物中的一类蛋白激酶,它分为3个亚族(SnRK1、2、3)。腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)被认为是淀粉合成途径中的关键酶。蔗糖能调节AGPase活性,这种调节涉及SnRK1信号途径,AGPase位于SnRK1的下游。海藻糖也能调节淀粉合成,6-磷酸海藻糖调节淀粉合成是通过还原活化AGPase完成[33]。SnRK1还可在转录水平上调控蔗糖合成酶基因的表达从而控制碳水化合物代谢。拟南芥中的Akin10,Akin11是SnRK1的同源基因。海藻糖可以上调Akin11基因表达,这种上调与6-磷酸海藻糖正相关。TPS蛋白占据多个SnRK1的磷酸化位点,Akin10过量表达会诱导TPS基因表达[34]。
14-3-3 是一个调节蛋白家族,14-3-3蛋白在信号转导过程中发挥着重要作用。植物中TPS能与14-3-3蛋白结合[35]。亲合色谱分析得出,TPS和SPS这些蛋白质有磷酸化位点与14-3-3蛋白结合,在植物中调节这些酶活性[36]。植物中硝酸还原酶(NR)的活性调节是通过特殊的丝氨酸残基上的磷酸化而控制的。如在波菜中,543号丝氨酸的磷酸化可改变其活性。有活性的NR可通过蛋白激酶作用生成有活性的磷酸化的NR。而磷酸化的NR就能与14-3-3蛋白结合,结合之后的复合物没有活性,它又可以通过蛋白磷酸酶生成有活性的NR。植物中NR、SPS、SS和羟甲基戊二酰辅酶A还原酶能被SnRK1磷酸化。之后结合上14-3-3蛋白能导致快速调节酶活性和代谢途径。蔗糖代谢中的SPS、SS以这种方式调控,对应的海藻糖代谢中的TPS也以这种方式调控其活性。
海藻糖在食品加工、药品保存、植物抗逆性研究上都有许多文献报道及实际的应用。而我们则更为关注它在植物生长、发育及代谢调控中的作用。蔗糖和海藻糖都是双糖,它们有许多相似的地方,但海藻糖在低等生物中广泛存在,在高等植物中也有其代谢。在高等植物中它不如蔗糖那样常见。可能海藻糖的进化起源更早。在高等植物中许多基因的表达受糖的调控。蔗糖也能调控许多代谢酶。蔗糖在高等植物中功能很多,而且易被蔗糖酶(转化酶)分解为己糖,而且蔗糖酶的抑制剂不易获得。这使蔗糖信号研究作用工作复杂化,海藻糖的有效抑制剂易获得,并已有广泛的应用。把海藻糖作为研究糖信号的一个有用工具,用作一种糖类似物,将为糖信号的感受及转导的详细过程的研究提供一个新视角。
[1] Gaff D.Tobacco plant desiccation to lerance[J].Nature,1996:382-502.
[2] Drennan PM.et al.The occurrence of trehalose in the leaves of the desiccation-tolerant angiosperm Myrothammus flabellifolius wel. [J].Plant Physiol,1993,142:493-496.
[3] Colaco C,Kampinga J,and Roser B.Amorphous stability and trehalose[J].Science,1995,268:788 -789.
[4] Schluepmann H,Dijken A,Aghdasi M,Wobbes B,Paul M,and Smeekens S.Trehalose Mediated Growth Inhibition of Arabidopsis Seedlings Is Due to Trehalose-6-Phosphate Accumulation [J].Plant Physiology,2004,135:879-890.
[5] Dijken A,Schluepmann H,Smeekens S Arabidopsis Trehalose-6-Phosphate Synthase 1 Is Essential for Normal Vegetative Growth and Transition to Flowering.[J].Plant Physiology,2004,135:969 -977.
[6] 王兴春,陈胜萍,刘姿娴,等.拟南芥海藻糖信号途径突变体筛选体系的建立[J].山西农业大学学报:自然科学版,2009,(6):550 -553.
[7] Mackenzie K.F,Singh K.K,and Brown AD.Water stress plating hypersensitivity of yeasts:protective role of trehalose in Saccharomyces cerevisie.[J].J.Gen Microbiol,1988,(134):1661-1666.
[8] Devirgilio C.et al.The role of trehalose Synthesis for the acquisition of thermotolerance in yeast I Genetic evidence that trehalose is a thermoprote ctant[J].Eur.J.Biochem,1994,219:179 -186.
[9] Wingler A,Fritzius T,Wiemken A,et al.Trehalose Induces the ADP - Glucose Pyrophosphorylase Gene,ApL3,and Starch Synthesis in Arabidopsis [J].Plant Physiology,2000,124:105 -114.
[10] Bell W.et al.Compositim and functional analysis of the Saccharomycescerevisiae trehalose Synthase complex[J].J.Biol.Chem,1998,(273):33311 -33319.
[11] Schick I,Haltrich D,and Kulbe K.D.Trehalose phosphorylase from Pichia fermentans and its role in the metabolism of trehalose[J].Appl Microbial Biobechnol,1995,43:1088-1095.
[12] Rimmele M and Boos W.Trehalose-6-phosphate hgdrdase of Escherichia coli. [J].J Bacteriol,1994,176:5654-5664.
[13] Nwaka s,Kopp M,and Holzer H.Expression and function of the trehalase genes NTH1 and YBR0106 in Sacharowyces cerevisiae [J].J Biolchem,1995,270:10193-10198.
[14] Horlacher,R.,Uhland,K.,Klein,W.et al.Characterization of a cytoplasmic trehalase of Escherichia coli. [J].Bacteriol,1996,178:6250 - 6257.
[15] Thaller M.C,Schippa S and Rossolini G.M.Conserved sequenee motifs amang bacterial,Ukaryotirc and archaeal phosphatases that define a new phosphohydrolase superfamily[J].Proteon Sci,1998,(7):1647 -1652.
[16] Leyman B.et al.An unexpeeted plethora of trehalose biosynthesis genes in Arabidopsis thdiana[J].Trends in Plant Science,2001,(6):510 -513.
[17] Blazquez.M.A.et al.Isolation and charaeterization of Arabidopsis TPS1 gene encoding trehalose-6-phosphate Synthase[J].Plant J,1998,(13):685 -689.
[18] Vogenl G.et al.Treholose metabolism in Arabidopsis:occurrence of trehalose and molecular cloning and characterization of trehalose-6-phosphate Synthase homologues[J].Journal of Experimental Botany,2001,52:1817-1826.
[19] Zentella R.et al.A Selaginella lepidophylla trehalose-6-phosphate synthase Complements growth and stresstolerance defects in a yeast tps1 mutant[J].Plant Physiol,1999,119:1 - 10.
[20] Goddijn O.J.M.et al.In hibition of trehalase activizy enhances trehalose accumulation in transgenic plants[J].Plant Physiol,1997,113:181 -190.
[21] Aeschbacher R.A.et al.Purification of the trehalass GMTRE1 from Soybean nodules and cloning of its cDNA GMTRE1 is expressed at a low level in multiple tissues[J].Plant Physiol,1999,119:489 - 495.
[22] Romer C.et al.Expression of the yeast trehalose-6 -
phosphate synthase gene in transgenic tobacco plants:pleiotopic phenotypes indude drought tolerance [J].Planta,1997,201:293 -297.
[23] Holmstrom K.O.et al.Prought tolerance in tobacco[J].Nature,1996,379:683 -684.
[24] Jang IC,Oh SJ,Seo JS,et al.Expression of a bifunctional fusion of the Escherichia coli genes for trehalose-6-phosphate synthase and trehalose-6-phosphate phosphatase in transgenic rice plants increases trehalose accumulation and abiotic stress tolerance without stunting growth.[J].Plant Physiology,2003,131:516 -524.
[25] Müller J,et al.Disaccharide - Mediated regulation of Sucrose:Fructan-6-Fructosgltransferase,a key enzyme of Fructan Synthesis in barley leaves[J].Plant Physiology,2000,123:265 -273.
[26] Paul M,Pellny T.Enhancing photosynthesis with sugar signals Review[J].Trends in Plant Science,2001,(16):197-200.
[27] Müller J,Boller T,Wiemken A.Trehalose affects sucrose synthase and invertase activities in soybean roots[J].J Plant Physiol,1998,153:255 -257.
[28] Thevelein J.M and Hohmann S.Trehalose synthase:guard to the gate of glycolysis in yeast[J].Trends Biochem Sci,1995,20:3 -10.
[29] Eastmond PJ,Li Y,Crraham IA.Is trehalose-6 -phisphate a regulator of sugar metabolism in plant[J].International Journal of dairy technology,2003,54:533 -537.
[30] Gonzah S.et al.Arabidopsis and yeast bexobinases overexprossed intransgenic lines are characterized by different catalytic properties[J].Plant Science,2002,163:943-954.
[31] Peter J,Eastmond.et al.trehalose-6 - phosphate Synthasa 1.Which catalyses the first Stop intrehalose Synthesis is essential for Arabidopsis embryo maturation[J].The Plant Jounal,2002,(29):285 - 235.
[32] Goddijn O.J.M and Smeekens S.Sensing trehalose biosynthesis in plants[J].Plant J,1998,(14):143 - 146.
[33] Kolbe A,Tiessen A,Schluepmann H,Paul M,Ulrich S,Geigenberger P.Trehalose 6-phosphate regulates starch synthesis via posttranslational redox activation of ADP-glucose pyrophosphorylase[J].Proc.Natl.Acad.Sci.USA,2005,102:11118 -11123.
[34] Glinski M,WeckwerthW.Differential multisite phosphorylation of the trehalose-6-phosphate synthase gene family in Arabidopsis thaliana:a mass spectrometrybased process for multiparallel peptide library phosphorylation analysis [J].Mol.Cell.Proteomics,2005,(4):1614-1625.
[35] Mackintosh C.Regulation of cytosolic enzymes in primary metabolism by reversible protein phosphory lation [J].Curr Opin.Plant Biol.,1998,(1):224 -229.
[36] Moorhead G.et al.Phosph or ylation-dependint interactions between enzymes of plant metabolism and 14-3-3 proteins[J].Plant J,1999,(18):1 -12.
