二氢槲皮素固体分散体片的制备及体外溶出度的研究
2011-01-25王秋红匡海学吴伦王知斌
王秋红,匡海学,吴伦,王知斌
(黑龙江中医药大学北药基础与应用研究省部共建重点实验室,黑龙江省中药及天然药物药效物质基础研究重点实验室,黑龙江哈尔滨150040)
二氢槲皮素(taxifolin)主要来源于松科落叶松属落叶松Sibirica Ledeb.、金缕梅科蚊母树Distylium racemosum等植物,属黄酮类化合物。它具有超强的抗氧化能力,在维持人的循环系统正常功能方面起着特殊的作用,可以使人体免受心脑血管疾病的困扰[1]。以往由于生产技术的原因,二氢槲皮素的纯度极低,进而限制了它的广泛使用。现今,采用一种低温提取技术,低成本地从落叶松中提取出二氢槲皮素,其纯度可达到95%以上,从而使二氢槲皮素被开发制备成药品并在临床广泛应用成为可能。
固体分散体(solid dispersions)可将难溶性药物以分子、胶体、无定形或微晶化状态分散于水溶性载体中,可以增加药物的溶解速度,提高药物生物利用度。固体分散体中药物的释放、吸收与所选择的载体以及载体的用量有很大的关系。载体的性质和制备工艺在很大程度上决定了固体分散体的溶出速度和稳定性[2]。
本实验采用固体分散技术制备了二氢槲皮素固体分散体。结果表明固体分散体可显著提高二氢槲皮素在水中的溶出度,解决了二氢槲皮素在水中溶解度差,口服后生物利用度低的技术性难题。
1 材料
1.1 仪器LC-2010A高效液相色谱仪(日本岛津公司);A-204电子分析天平(上海精密科学仪器有限公司);压片机(上海友跃机械制造厂);RC-8DS溶出度测定仪(天津市光学仪器厂)
1.2 试药二氢槲皮素(阿梅季斯有限责任公司);二氢槲皮素对照品(自制,经HPLC测定,面积归一化法计算纯度达99.0%);聚乙烯吡咯烷酮(PVP-K30)(德国BASF公司);聚乙二醇(PEG-4000)、聚乙二醇(PEG-6000)(天津天泰精细化学品有限公司);无水乙醇(分析纯)、羧甲基淀粉钠、微晶纤维素、硬脂酸镁(天津市恒兴化学试剂制品有限公司)
2 方法与结果
2.1 二氢槲皮素溶出度测定方法的建立
2.1.1 最大吸收波长的确定用流动相配制二氢槲皮素溶液,用紫外分光光度计在200~400 nm的波长范围内进行扫描,测定最大吸收波长。结果最大吸收波长为289 nm,且辅料没干扰,故选择289 nm为检测波长。
2.1.2 色谱条件色谱柱:Dikma Technologies Diamonsil®(钻石)C18(5 μm,250 mm×4.6 mm);流动相:V(甲醇)-(水)=40∶60(1%H3PO4);体积流量:1.0 mL/min;检测波长:289 nm;柱温:25℃。
图1 二氢槲皮素高效液相色谱图Fig.1 HPLC chromatograms of taxifolin
2.1.3 线性关系试验取二氢槲皮素对照品约50 mg,精密称定,加流动相制成每1 mL含二氢槲皮素0.5 mg的溶液,作为对照品溶液。分别精密量取上述对照品溶液1.0、2.0、4.0、6.0、8.0、10.0 mL于25 mL量瓶中,分别加入流动相稀释至刻度。分别进样20 μL,按2.1.2项的色谱条件进行测定。以峰面积对浓度进行线性回归,得标准曲线。结果表明二氢槲皮素在0.020~0.20 μg/μL内线性关系良好,线性回归方程为:Y=96 919X-120.5,r=0.999 9。
2.1.4 精密度试验取同一份供试品溶液,进样20 μL,连续进样6次,按2.1.2项的色谱条件进行测定,方法的精密度RSD为0.77%,精密度良好。2.1.5稳定性试验取供试品溶液,分别于2、4、6、8、10 h分别进样20 μL,按2.1.2项的色谱条件进行测定,实验结果表明,供试品溶液在10 h内是稳定的。
2.2 固体分散体的制备
2.2.1 溶剂法精密称取二氢槲皮素0.5 g(100目),用无水乙醇400 mL溶解,再分别称取4.5、3.0、1.5 g PVP-K30粉末(100目),加入上述无水乙醇中,搅拌使之溶解。将此乙醇液置减压干燥箱中干燥至干,取出,置干燥器中平衡24 h,粉碎过筛(100目),得到二氢槲皮素PVP-K30(1∶9、1∶6、1∶3)固体分散体,于干燥器中备用[6-10]。
2.2.2 熔融法精密称取0.5 g二氢槲皮素(100目)与4.5、3.0、1.5 g PEG-4000或PEG-6000共溶于100℃水浴上,搅拌均匀(1 h),迅速放置于-20℃冰柜中冷却4 h,取出放置干燥器中平衡24 h,粉碎过筛(100目),得二氢槲皮素PEG-4000和PEG-6000(1∶9、1∶6、1∶3)固体分散体,于干燥器中备用[11]。
2.3 固体分散体溶出度实验以水为溶出介质,取各处方固体分散体适量(相当于主药20 mg),照《中华人民共和国药典》2010年版二部附录XC第一法,以250 mL水为溶出介质,在37℃、100 r/min条件下,分别于10、20、30、40、50、60 min取样2 mL(同时补充同温等量介质),经0.45 μm滤膜过滤,取溶液1 mL,用纯化水定容于10 mL的量瓶中,进行HPLC测定[12-13]。测定结果代入标准曲线计算质量浓度,并换算成累积溶出率。
2.3.1 PVP-K30、PEG-4000、PEG-6000为载体的溶出度以3种载体的固体分散体[m(二氢槲皮素)∶m(载体)=1∶3、1∶6、1∶9]溶出情况如图2~4所示:二氢槲皮素从固体分散体中的溶出速率和程度明显随着载体比例增大,溶出速度加快。当m(二氢槲皮素)∶m(载体)=1∶9时,1 h内二氢槲皮素在介质中的累积溶出量达到70%以上,其中以PVP-K30为载体的固体分散体累计溶出量能达到90%以上。

图2 PVP-K30为载体的固体分散体累积溶出度曲线Fig.2 The accumulated dissolution curve of solid dispersion carried with PVP-K30
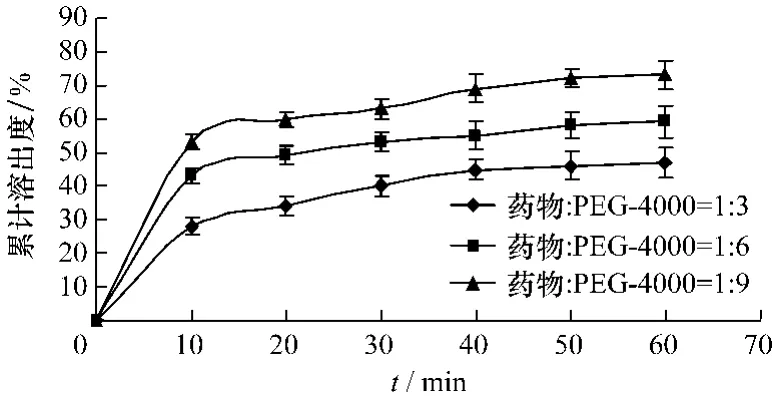
图3 PEG-4000为载体的固体分散体累积溶出度曲线Fig.3 The accumulated dissolution curve of solid dispersion carried with PEG-4000
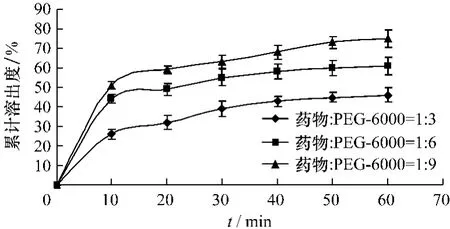
图4 PEG-6000为载体的固体分散体累积溶出度曲线Fig.4 The accumulated dissolution curve of solid dispersion carried with PEG-6000
2.3.2 PVP-K30为载体的溶出度比较以二氢槲皮素及PVP-K30为载体的物理混合物[m(二氢槲皮素)∶m(PVP)=1∶6]、固体分散体[m(二氢槲皮素)∶m(PVP)=1∶6]和二氢槲皮素原料的溶出情况如图5所示:二氢槲皮素从固体分散体中的溶出速率和程度明显大于其物理混合物和二氢槲皮素原料。可以看出固体分散体的溶出效果较好,物理混合物次之,二氢槲皮素原料的溶出效果较差,这说明固体分散体起到了提高二氢槲皮素体外溶出度的作用。
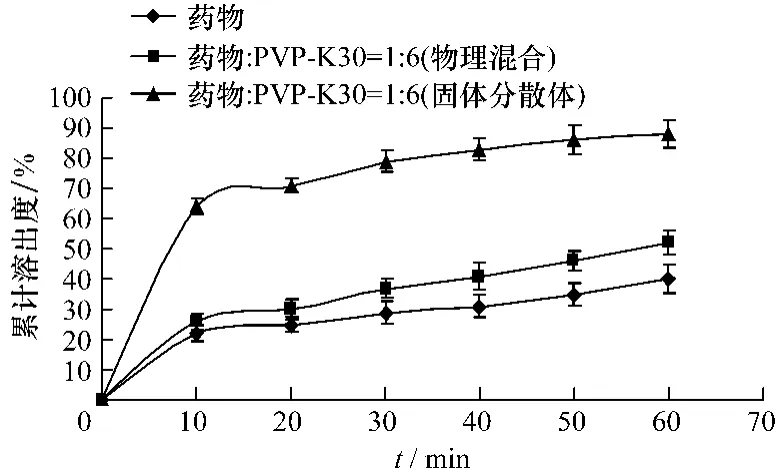
图5 二氢槲皮素、物理混合物和固体分散体累积溶出度曲线Fig.5 The accumulated dissolution curve of taxifolin physical mixtures and solid dispersions
2.4 片剂的制备精密称取二氢槲皮素20 g,用无水乙醇溶解,再分别称聚乙烯吡咯烷酮(PVP-K30)120 g粉末,加入上述无水乙醇中,搅拌使之溶解。将此乙醇液置减压干燥箱中干燥至干,取出,置干燥器中平衡24 h,粉碎过筛(100目),得到二氢槲皮素PVP-K30(1∶6)固体分散体,于干燥器中备用。取二氢槲皮素固体分散体140 g、微晶纤维素50 g、羧甲基淀粉钠8 g,硬脂酸镁2 g等辅料分别过100目筛,将二氢槲皮素固体分散体、微晶纤维素、羧甲基淀粉钠混匀,加硬脂酸镁适量,采用粉末直接压片法压制1 000片,片质量0.2 g,每片含二氢槲皮素20 mg。
2.5 二氢槲皮素固体分散片溶出度测定按照中国药典2010版溶出度测定第一法-转篮法。溶出介质为水250 mL,温度为(37±0.5)℃,转速(100±1)r/min。取二氢槲皮素固体分散片6片分别投放于溶出杯中,于45 min取样2 mL,过滤,取续滤液1 mL,用纯水定容于10 mL的量瓶中,采用高效液相色谱法测定峰面积,外标法计算[3]。结果见表1。结果表明:二氢槲皮素固体分散体片45 min时的溶出度的平均值为86.8%。
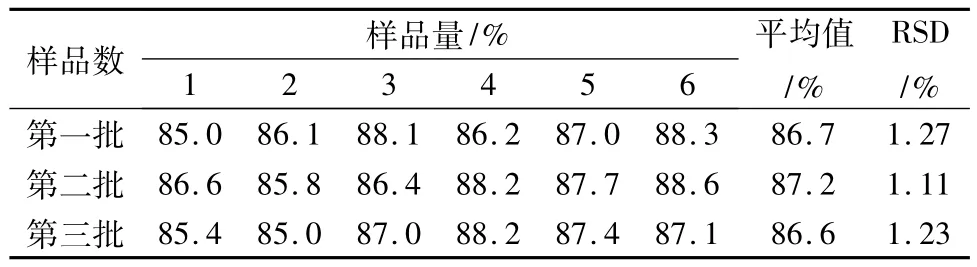
表1 二氢槲皮素固体分散体片溶出度Tab.1 The dissolution of solid dispersion tablets of taxifolin
4 讨论
4.1 处方前研究表明,二氢槲皮素水溶性差,大鼠口服吸收效果不好,但在水中稳定性较好。所以采用固体分散体技术增加其溶解度及溶出速度,以达到提高二氢槲皮素口服生物利用度的目的[4]。本试验将药物先制成固体分散体,再压制成片,增加了二氢槲皮素固体分散体片的体外溶出度。
4.2 PVP-K30为载体的固体分散体的作用机制讨论:PVP-K30的熔点较高,能溶于水及多种有机溶剂,故宜用溶剂法制备固体分散体,而不用熔融法制备[5]。PVP-K30在溶液中呈网状结构,在与药物共蒸发溶剂时,由于氢键作用(药物分子沿着PVP-链,以氢键形式与PVP-相结合)或络合作用及黏度不断增大从而抑制药物晶核的形成及成长,使药物形成具有较高能量的非结晶型无定性物,增加了药物在溶出介质中的释放速率。
4.3 我们制3批固体分散体溶出度重现性良好,说明该制备工艺稳定可靠。
4.4 本实验应用固体分散技术解决了二氢槲皮素在水中溶解度差,生物利用度低的技术性难题,针对今后溶解性差的天然药物成分开发成新药具有一定的理论和实践指导意义。
[1]金建忠,申屠超,许惠英,等.落叶松中二氢槲皮素的提取及鉴定[J].浙江林业科技,2004,24(5):15-17.
[2]洪涛,欧阳五庆.固体分散体的载体选择及质量评价的新进展[J].黑龙江畜牧兽医,2004,9:84-86.
[3]国家药典委员会.中华人民共和国药典:2010年版二部[S].北京:中国医药科技出版社,2010:附录85-87.
[4]Re R,Pellegrini N,Proteggente A,et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay[J].Free Rad Biol Med,1999,26(9-10):1231-1237.
[5]周毅生,翟冬燕,段琼辉,等.灯盏花素口腔崩解片的制剂处方和制备工艺的研究[J].中成药,2006,28(7):941-944.
[6]何丹,杨林,范琦.丹参酮ⅡA固体分散体的制备及溶出度考察[J].中国医院药学杂志,2009,29(8):649-651.
[7]尚校军,董若怡,马素英,等.冬凌草甲素固体分散体的制备及溶解性能研究[J].中国现代应用药学,2010,27(5):418-421.
[8]靖博宇,王志远,李燕,等.非洛地平固体分散体的制备和体外溶出度考察[J].沈阳药科大学学报,2010,27(3):185-190.
[9]何燕,聂金媛,徐孟文,等.落新妇苷固体分散体的制备及理化鉴别[J].中成药,2010,32(10):1695-1698.
[10]黄兰芷,赵志强,衡林森,等.青蒿琥酯缓释固体分散体的制备及体外溶出度研究[J].中成药,2010,32(10):1702-1704.
[11]魏敏,关皎,徐璐,等.熔融法制备布洛芬固体分散体[J].沈阳药科大学学报,2010,27(1):15-19.
[12]孙彦辉,李三鸣,彭博,等.尼美舒利固体分散体的制备及其性质考察[J].沈阳药科大学学报,2009,26(2):93-97.
[13]钱一鑫,康冀川,何珺.HPLC测定银杏黄铜苷元固体分散体胶囊剂的含量[J].中国现代应用药学,2010,27(8):723-726.
