红曲多糖液态发酵条件与抗氧化活性的研究
2011-01-12汪鹏荣陈攀攀蓝丽精蒋冬花林遥雪
汪鹏荣,陈攀攀,蓝丽精,蒋冬花,林遥雪
(浙江师范大学化学与生命科学学院,浙江金华 321004)
真菌多糖是从真菌子实体、菌丝体、发酵液中分离出的由10个以上的单糖以糖苷键连接而成的不溶于高浓度乙醇、正丁醇及丙酮等有机溶剂的高分子多聚物,与动、植物多糖不同,真菌多糖分子单体之间主要以β-1,3与β-1,6糖苷键结合,形成链状分子,具有螺旋状的立体构型[1]。自1970年日本千原羽田从香菇中分离出一种抗肿瘤的多糖后,科学界掀起了食用真菌多糖研究的热潮。真菌多糖在国际上被称为“生物反应调节物”(biological response modifier,简称BRM),具有很大的应用开发价值。大量的药理实验表明,真菌多糖具有还原能力,可以消除体内的自由基,具有抗氧化性,因而具有刺激免疫、抗肿瘤、降低糖脂、延缓衰老等活性,己经被广泛应用于医疗保健领域[2]。目前,已在国内临床应用的真菌多糖主要有香菇多糖、云芝多糖、云芝糖肽、灵芝肽多糖、猴头菌多糖、银耳多糖等[3]。红曲霉是一类十分重要的药用真菌,红曲霉发酵制成的中药红曲具有活血化瘀、健脾消食等功效及降脂、降压、降糖和抗肿瘤等作用[4],在食品、色素、中药等领域也有广泛的应用,随之红曲霉的次级代谢产物也成为研究焦点[5]。多糖类物质是红曲霉所含有的重要化学成分之一,相关研究表明红曲多糖具有抗肿瘤、抗病毒、提高免疫力等多种功能[6-8]。红曲多糖可像灵芝多糖一样通过液态发酵而实现工业化生产,但目前国内对红曲多糖的发酵生产工艺研究不多,相关报道的胞外多糖产量普遍较低,尚处于探索阶段。通过从不同环境中采集来的红曲米中分离筛选出1株高产胞外多糖红曲霉菌株Mr-70,对其培养基组分及液态发酵条件进行优化,并进一步对胞外粗多糖清除DPPH自由基的能力进行了研究,以期为红曲多糖的工业化生产及应用提供理论和实践指导。
1 材料与方法
1.1 材料
1.1.1 菌种来源 红曲霉菌株Mr-70分离自浙江金华地区采集来的红曲米。
1.1.2 培养基 ①斜面培养基(PDA培养基):马铃薯200 g,葡萄糖20 g,水1 000 mL,pH自然(固体培养基加琼脂粉18 g);②种子培养基[9]:葡萄糖50 g,蛋白胨5 g,酵母膏1 g,KH2PO41 g,FeSO4·7H2O 0.01 g,MgSO4·7H2O 0.5 g,水1 000 mL,pH 6.0;③发酵培养基(g/L):葡萄糖50,蛋白胨20,KH2PO4·3H2O 8,MgSO40.5,pH 6.0。
1.1.3 试剂 二苯代苦味酰基自由基(DPPH·)、甲醇、葡萄糖、蔗糖、麦芽糖、淀粉、番薯粉、乳糖、蛋白胨、酵母粉、牛肉膏、硫酸铵、硝酸钠、尿素、无水乙醇,均为国产分析纯;试验用水为去离子水。
1.1.4 实验设备 LRH-280生化培养箱,广东医疗器械厂;C24KC生物恒温摇床,CERTIFIED;M IKRO-22R高速冷冻离心机,德国Hettichi公司;UV-7504紫外可见分光光度计,上海欣茂仪器公司;DHG-9101.28A电热恒温鼓风干燥箱,山东鄄城科源仪器设备厂;HH-4数显恒温水浴锅,山东鄄城科源仪器设备厂;JA3003A天平,上海精天电子仪器有限公司。
1.2 方法
1.2.1 菌种活化 将保存的红曲霉菌株Mr-70用接种针接入斜面培养基,30℃恒温培养5 d。
1.2.2 种子液制备 用打孔器(直径0.8 cm)取30℃培养5 d的平板菌种5块分别接种到种子培养基中(250 mL三角瓶装入50 mL液体培养基),30℃,于200 r/min的旋转式摇床培养48 h。
1.2.3 液体发酵培养 将培养48 h的种子液接种到液体发酵培养基中,接种量为8%,250 mL三角瓶装100 mL培养液,180 r/min、30℃培养96 h,最后取发酵液分析检测粗多糖的产量。
1.2.4 发酵液中多糖含量的测定[10-11]发酵滤液定容至100 mL,取适量发酵液,5 000 r/min离心30 min,将所获上清液抽滤,除去其中的不溶物,取上清液15 mL加入60 mL无水乙醇中,在5℃下静置8 h过滤,沉淀在80℃烘干12 h至恒重,称量即为胞外粗多糖含量。
1.2.5 胞外粗多糖清除DPPH的测定方法[12-13]DPPH·是一种在有机溶剂中非常稳定的自由基,呈紫色,不溶于水,可溶于甲醇溶液,在517 nm处有一个特征吸收峰,当其遇到自由基清除剂时,与DPPH的孤电子配对,使其颜色变浅,在最大吸收波长处的吸光度变小。配制不同浓度的粗多糖溶液,离心取2 mL上清于试管中,再加入2 mL DPPH的甲醇溶液(DPPH浓度为1×10-4mol/L),混合均匀,0.5 h后用分光光度计在517.4nm处测定其吸光度Ai;同时测2 mL DPPH溶液+2 mL甲醇混合后的吸光度A0和2 mL提取液+2 mL甲醇混合后的吸光度Aj,实验中每个浓度平行做3次,取其平均值。按下式计算对自由基的清除率:

2 结果与分析
2.1 碳源对胞外多糖产量的影响
以液体发酵培养基为基础,分别采用葡萄糖、蔗糖、麦芽糖、淀粉、番薯粉、乳糖为碳源进行试验(碳源质量浓度设定为50 g/L),将红曲霉菌Mr-70接入上述各发酵培养基中,30℃条件下,以200 r/min的速度摇瓶培养96 h,对发酵液中的多糖含量和菌体生物量进行初测,实验重复3次。实验结果显示(表1),红曲霉菌Mr-70利用以上6种物质产胞外多糖的能力依次是葡萄糖>蔗糖>麦芽糖>乳糖>番薯粉>淀粉,其中以葡萄糖为唯一碳源时的胞外多糖产量最高达5.63 g/L,而从菌丝体产量来看葡萄糖和麦芽糖是最适合红曲霉生长的碳源,因此确定葡萄糖为最适碳源。

表1 不同碳源对M r-70发酵产胞外多糖能力的影响Table 1 The effects of carbon sources on the MEP yield of Mr-70
2.2 氮源对胞外多糖产量的影响
以液体发酵培养基为基础,分别采用蛋白胨、酵母粉、牛肉膏、硫酸铵、硝酸钠、尿素为氮源进行试验(氮源质量浓度设定为20 g/L),将红曲霉菌Mr-70接入上述各发酵培养基中,30℃、200 r/min摇瓶培养96 h,对发酵液中的多糖含量和菌体生物量进行初测。由表2显示有机氮源比无机氮源更有利于红曲霉菌Mr-70的生长,其中蛋白胨和酵母膏对菌丝体生长最有利,但是蛋白胨是最佳产胞外多糖所需的氮源,因此,选择蛋白胨作为红曲霉菌Mr-70的最适氮源。

表2 不同氮源对M r-70发酵产胞外多糖能力的影响Table 2 The effects of nitrogen sources on theMEP yield ofMr-70
2.3 碳氮比对胞外多糖产量的影响
以液体发酵培养基为基础,在上述碳氮源实验的基础上,分别选取碳氮比(质量比)1◇1、2◇1、3◇1、4◇1、5◇1、6◇1进行碳氮比筛选实验。将红曲霉菌Mr-70接入上述各类碳氮比不同的发酵培养基中,30℃、200 r/min摇瓶培养96 h,对发酵液中的多糖含量进行初测,实验重复3次。由图1可知,红曲霉菌Mr-70菌丝体的产量随碳氮比的增加而增加;胞外多糖产量先随着碳氮比的增加而增加,当碳氮比为3◇1时达到最大值8.40 g/L,然后随着碳氮比的增加多糖产量反而下降。过高的碳氮比只适合菌体的生长却不利于菌体分泌胞外多糖,过低则会影响菌体的生长和胞外多糖的分泌,因此红曲霉菌Mr-70最适产胞外多糖的碳氮比初步确定为3◇1。

图1 不同碳氮比对红曲霉菌M r-70菌丝体生长和产胞外多糖的影响Fig.1 The effects of ratio ofm(C):m(N)on theMEP yield ofMr-70
2.4 无机盐浓度对胞外多糖产量的影响
以上述最适碳氮比为基础配制液体发酵培养基,分别选取不同浓度的无机盐添加量:KH2PO4·3H2O(2、4、6、8、10、12 g/L)、MgSO4(0.3、0.5、0.7、0.9、1.1、1.3 g/L)进行最适无机盐浓度筛选实验。将红曲霉菌Mr-70接入上述各类无机盐浓度不同的发酵培养基中,30℃、200 r/min摇瓶培养96 h,对发酵液中的多糖含量进行初测,实验重复3次。无机盐是微生物生长和产代谢产物必须的营养物质。培养基中无机离子种类与浓度对微生物胞外多糖的合成有重要影响,并同时影响胞外多糖的化学组成和物性[14]。其中P、S、K、Mg 4种矿质元素必须通过外界添加才可达到菌体生长所需浓度,对于这几种元素来源,首选KH2PO4·3H2O和MgSO4,可以同时提供这4种元素[15],因此有必要通过实验确定KH2PO4·3H2O和Mg-SO4的最适添加量,实验结果见图2。由图2可知,无机盐浓度对红曲霉菌丝体生长的影响不太明显,但对胞外多糖产量的影响却很明显,当Mg-SO4和KH2PO4·3H2O浓度分别为1.1 g/L(图2a)、10 g/L(图2b)时多糖产量达到最大值8.56 g/L。

图2 无机盐添加量对胞外多糖产量的影响Fig.2 The effects of concentrations of KH2PO4·3H2O andMgSO4on theMEP yield ofMr-70
2.5 培养基起始pH对胞外多糖产量的影响

图3 培养基起始pH值对胞外多糖产量的影响Fig.3 The effects of initial pH on theMEP yield ofMr-70
将菌种接入液体发酵培养基中,以3.5为初始pH,0.5一个梯度,逐渐增加至7.0,通过对不同初始pH值的测试,获取最佳初始pH。将红曲霉菌Mr-70接入上述各类起始pH不同的发酵培养基中,30℃、200 r/min摇瓶培养96 h,对发酵液中的多糖含量进行初测,实验重复3次。多糖的合成在多种酶的共同催化作用下完成,pH可影响培养基中有效成分的溶解性及运输、相关酶活性、副产物的形成及发酵过程中的氧化还原反应,从而影响微生物的生长与代谢[16]。由图3可知,酸性环境更有利于菌丝体生长,却不利于胞外多糖的产生,当pH为6.5时红曲霉Mr-70胞外粗多糖产量达到最大值8.7 g/L。
2.6 摇床转速对胞外多糖产量的影响
将红曲霉菌Mr-70接入液态发酵培养基中,以最佳pH值为条件。选取0、50、100、150、200、250 r/min 6个转速梯度,测试Mr-70产胞外多糖的最佳摇床转速。大多数产胞外多糖的微生物需氧才能合成胞外多糖,故发酵过程中通气极为重要,过高或者过低都不利于菌丝体生长,进而影响胞外多糖产量。红曲霉是一种好氧真菌,本实验通过改变转速来改变摇瓶通气量,由图4可知,红曲霉菌丝体的生长随着摇床转速的增加而增加,当摇床转速为250 r/min时菌丝体量达到最大值21.04 g/L;摇床转速在50~200 r/min时,多糖产量随着摇床转速的增加而增加,但是过高的氧气含量却不利于胞外多糖的产生,当摇床转速为200 r/min胞外粗多糖产量达到最大值9.33 g/L。
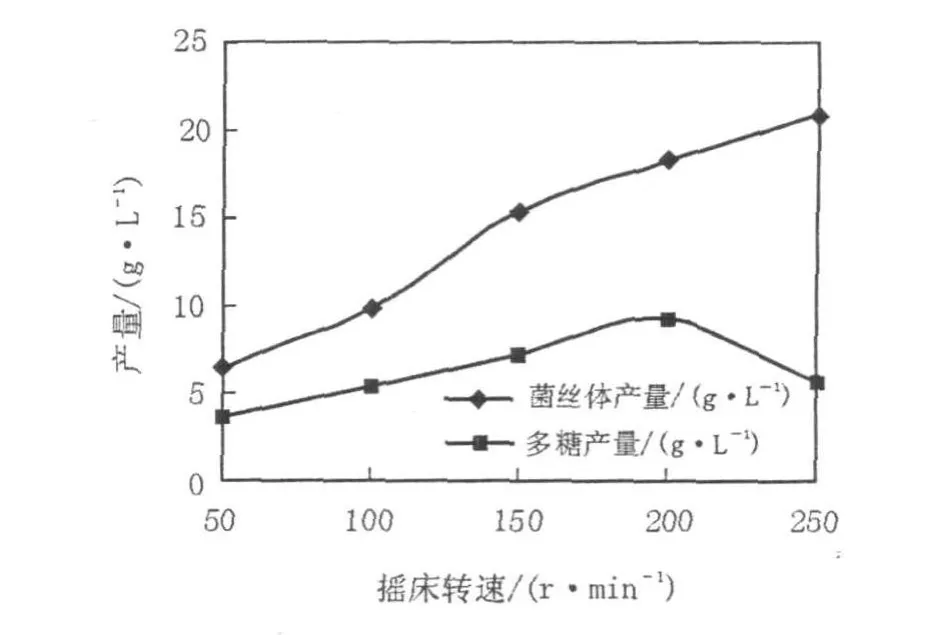
图4 摇床转速对胞外多糖产量的影响Fig.4 The effects of rotation speeds on theMEP yield ofMr-70
2.7 摇瓶温度对胞外多糖产量的影响
将红曲霉菌Mr-70接入液态发酵培养基中,以最优pH和最优摇床转速为条件,测试从20~40℃下不同的胞外多糖产量,以确定最佳摇瓶温度。微生物的生命活动都是由一系列生物化学反应组成的,这些反应都要在各种酶的催化下进行,而温度是保证酶活性的重要因素,因此,在发酵过程中保证稳定合适的温度具有重要意义[17]。温度可以影响微生物体内的各种化学反应的进行,进而影响微生物的生长和各种代谢产物的积累,因此每种微生物都有其最适的生长温度和最适的产胞外多糖温度。由图5可知,当摇瓶温度在20~36℃之间时,菌丝体的产量随着温度的增加而增加,当温度高于36℃时菌丝体产量开始缓慢下降;而胞外多糖产量在温度为32℃时达到最大值10.15 g/L,因此红曲霉菌Mr-70的最适生长温度(36℃)与其最适产胞外多糖温度(32℃)不完全一致。

图5 摇瓶温度(℃)对胞外多糖产量的影响Fig.5 The effects of temperature on the MEP yield of Mr-70
2.8 粗多糖的抗氧化活性测定结果

图6 不同浓度的胞外粗多糖对DPPH·的清除作用Fig.6 The scavenging effect ofMEP on DPPH·
DPPH·分析法被广泛用于清除自由基物质活性的研究,可评价有机清除剂的活性[18]。不同浓度的胞外粗多糖的DPPH·清除能力见图6。由图6可知,当粗多糖浓度在0.5~2 mg/mL时,对DPPH·的清除能力呈现对数增长趋势;当粗多糖浓度超过2 mg/mL时,对DPPH·的清除能力增加缓慢。Tseng等[19]从灵芝中提取的多糖,在浓度为5 mg/mL时,对DPPH·清除率为36.4%~58.4%;叶明等[20]从黑芝胞外提取的多糖,在浓度为40 mg/mL时对DPPH·清除率为23.4%,而5 mg/mL的红曲霉胞外粗多糖的DPPH·清除率就达82.24%,因此,红曲霉胞外粗多糖表现出较强的DPPH·清除能力。
3 结 论
通过对红曲霉液体发酵生产条件进行研究,初步得出红曲霉菌Mr-70产胞外多糖的最适培养条件:葡萄糖60 g/L,蛋白胨20 g/L,K2HPO410 g/L,MgSO4·7H2O 1.1 g/L,发酵液起始pH 6.5,32℃、200 r/min摇床培养96 h,红曲霉菌株Mr-70的胞外粗多糖产量可达10.15 g/L。
二苯代苦味酰基自由基(DPPH·)是一种很稳定的以氮为中心的自由基,若样品能清除它,则提示样品具有降低羟自由基、烷自由基或过氧自由基的有效浓度和打断脂质过氧化链反应的作用[21]。红曲霉胞外粗多糖对DPPH·具有较强的清除能力,表明红曲霉胞外粗多糖具有良好的体外抗氧化活性,而且红曲霉胞外粗多糖是一种天然提取物,具有成本低廉、安全无毒等特点,因此,红曲霉胞外粗多糖作为天然抗氧化剂具有很好的开发应用前景。
[1] WangQ,Huang X Q,Nakamura A,et al.Molecular characterisation of soybean polysaccharides:an approach by size exclusion chromatography,dynamic and static light scattering methods[J].Carbohydrate Research,2005,340(1):2637-2644.
[2] Yang XB,Gao X D,Han F,et al.Sulfation of a polysaccharide produced by a marine filamentous fungus Phoma herbarum YS4108 alters its antioxidant propertiesin vitro[J].Biochim BiophysActa,2005,1725(1):120-127.
[3] 王舒宁.真菌多糖免疫调节作用的研究进展[J].福建畜牧兽医,2009,31(3):14-16.
[4] 邢旺兴,程荣珍,宓鹤,等.几种常见红曲霉的生理学特性研究[J].药学实践,2001,19(4):231-232.
[5] 李秀岩,魏健,孙振雷.红曲多糖的提取与发酵工艺的优化[J].安徽农业科学,2006,34(21):5653-5654.
[6] 丁红梅.红曲多糖抑瘤作用初步研究[J].菌物研究,2007,5(3):171-173.
[7] 曾露燕,赵树欣,李燚.红曲霉抑菌成分糖肽类物质的分离纯化及稳定性[J].天津科技大学学报,2009,2(4):18-21.
[8] 张建峰,昌友权,陈光,等.红曲多糖的免疫活性研究[J].食品科学,2008,29(2):391-393.
[9] 蒋冬花,后家衡,李杰,等.红腐乳中高产γ-氨基丁酸红曲霉菌株的筛选[J].浙江师范大学学报(自然科学版),2007,30(4):447-452.
[10] 赵振锋,方惠英,诸葛健.红曲霉发酵产胞外多糖工艺的优化[J].无锡轻工大学学报,2002,2(3):289-295.
[11] 冮洁,宋红梅.铆钉菇菌丝体液体培养产胞外多糖条件的研究[J].食用菌,2009,31(3):14-16.
[12] 许平.黄瓜多糖抗氧化活性研究[J].重庆工商大学学报(自然科学版),2009,2(1):54-56.
[13] 赵爱云,胡博路,杭瑚,等.部分植物抗氧化活性的初步研究[J].天然产物研究与开发,2000,12(3):42-44.
[14] MartinsL O.Roles ofMn2+,Mg2+and Ca2+on alginate biosynthesis byPseudomonasae ruginosa[J].Enzyme Microbial Technol,1990,12(10):794-799.
[15] 周德庆.微生物学教程(第2版)[M].北京:高等教育出版社,2002:92.
[16] Forage R,Harisson D,Pit D.Effect of environment on microbial activity[J].In:Comprehensive Biotechnology,Moo-YoungM(eds)Oxford,New York:Pergamon Press,1985:253-279.
[17] 吴彩琴,陈野,郝迎.冬虫夏草液体发酵生产多糖和菌丝体的研究[J].食品科学,2009,30(5):171-174.
[18] 胡喜兰,韩照祥,陶莹,等.DPPH法测定17种植物的抗氧化活性[J].食品科技,2006,(10):264-268.
[19] Tseng YH,Yang JH,Mau JL.Antioxidant properties of polysaccharides from Ganoder ma tsugae[J].Food Chemistry,2008,107(2):732-738.
[20] 叶明,陈九山,杨柳,等.黑芝胞外多糖提取工艺条件优化及体外抗氧化活性研究[J].食品科学,2009,30(8):47-50.
[21] 康海权,陈亚琪,陈秋平,等.油茶果壳多糖的抗氧化作用及单糖组成[J].食品与发酵工业,2010,36(4):36-38.
